Биоинфлотмаитка. Биоинформатика Практикалық нұсқаулық 2. Биоинформатика пнінен практикаа арналан нсаулы Практикалы жмыс 1 Биологиялы деректер,оларды ерекшеліктерін талдау
 Скачать 0.98 Mb. Скачать 0.98 Mb.
|
|
Бақылау сұрақтары 1. Геномдық тізбектері салыстыруға қолданылатын бағдарламалар түрі; 2. «Бөлшектік секвенирлеу» әдісінің салыстырмалы түрде қолдану; 3. Геном тізбектерін салыстыру ғылымға қандай өзгеріс енгізді?: 4. Биоинформатиканың геномды құрастыру алгоритмдері; 5. Биоинформатика геномдық және протеомдық жобаларына түсініктеме; 6. Геномдарды салыстыруға қолданылатын әдістер түрлері; 7. Сүтқоректілердің геномындағы реттеушілік элементтері қалай анықталды? Практикалық жұмыс №8.Филогенетикалық ағаш құрастыру Филогенетикалық ағаш (эволюциялық ағаш, өмір ағашы) - әр түрлі түрлер немесе ортақ ата тегі бар басқа тұлғалар арасындағы эволюциялық қатынастарды көрсететін ағаш.Филогенетикалық ағаштың шыңдары үш класқа бөлінеді: жапырақтар, түйіндер және (ең көбі бір) тамыр. Жапырақтар - соңғы шыңдар, яғни әрқайсысының бір жиегі бар; әрбір жапырақ тірі организмнің қандай да бір түрін (немесе эволюцияға жататын басқа объектіні, мысалы, ақуыз аймағын) білдіреді. Әрбір түйін эволюциялық оқиғаны білдіреді: тектік түрдің екі немесе одан да көпке бөлінуі, кейіннен олар дербес эволюциялық жолмен дамыды. Түбір барлық қарастырылатын объектілердің ортақ атасын білдіреді. Филогенетикалық ағаштың жиектері «бұтақтар» деп аталады.«Ағаш» идеясы қарапайым формалардан күрделіге дейінгі даму процесі ретінде өмірдің алғашқы көзқарастарында пайда болды. Қазіргі эволюциялық биологтар эволюцияны суреттеу үшін ағаштарды пайдалануды жалғастыруда, өйткені олар тірі организмдер арасындағы қарым-қатынастарды анық көрсетеді.Тамырлы ағаш - таңдалған шыңы - тамыры бар ағаш. Тамырлы ағашты бағытталған график деп санауға болады, өйткені оның табиғи бағыты бар - тамырдан жапырақтарға дейін. Тамырлы ағаштың әрбір түйіні ағаштың астындағы жапырақтардың соңғы ортақ ата-тегіне сәйкес келеді. Суретте тірі организмдердің үш домендік жүйесіне сәйкес боялған тамырлы филогенетикалық ағаш көрсетілген[.Тамырсыз ағашта тамыр болмайды және ортақ атаның болжамды ұстанымынсыз жапырақтардың қатынасын көрсетеді. Тамырсыз ағаштарды қарастыру қажеттілігі көбінесе эволюция бағытына қарағанда түйіндер арасындағы байланыстарды қалпына келтіру оңайырақ болатындығынан туындайды. Суретте тамыры жоқ филогенетикалық ағаш көрсетілген[Тамырсыз ағашты тамырлы ағашқа айналдырудың ең сенімді әдісі (ол үшін не түйіндердің бірін түбір деп жариялау керек, не бұтақтардың бірін түбірден шығатын екіге бөлу керек) «сыртқы топты» пайдалану болып табылады. түрлер - бізді қызықтыратын түрлер жиынтығына жеткілікті жақын (біріктірілген түрлер жиынтығы үшін ағаштың топологиясын сенімді қалпына келтіру үшін), бірақ сонымен бірге жеке топ болып табылатыны анық. Кейде түбірдің орнын зерттелетін объектілердің (түрлердің, белоктардың және т.б.) табиғаты туралы кейбір қосымша білімдер негізінде болжауға болады.Тамырлы және тамырсыз филогенетикалық ағаш бифуркациялық немесе бифуркациялық емес, сонымен қатар таңбаланған немесе таңбаланбаған болуы мүмкін. Бифуркациялық ағашта әрбір түйінге дәл үш бұтақ жақындайды (тамырлы ағаш жағдайында бір кіретін және екі шығатын бұтақ). Осылайша, бифуркация ағашы барлық эволюциялық оқиғалар тектік объектіден дәл екі ұрпақтың шығуынан тұрады деп болжайды. Төрт немесе одан да көп бұтақ бифуркациясыз ағаштың түйініне жақындай алады. Белгіленген ағаш жапырақтардың атын қамтиды, ал таңбаланбаған ағаш жай ғана топологияны көрсетеді.Дендрограмма – филогенетикалық ағаштың схемалық бейнесінің жалпы термині.Кладограмма - бұтақтардың ұзындығы туралы ақпаратты қамтымайтын филогенетикалық ағаш.Филограмма (немесе фенограмма) - бұтақтардың ұзындықтары туралы ақпаратты қамтитын филогенетикалық ағаш; бұл ұзындықтар гендегі мутациялар саны сияқты кейбір сипаттамалардың өзгеруін білдіреді.Хронограмма - тармақтарының ұзындығы эволюциялық уақытты білдіретін филограмма.Филогенетикалық ағаштарды құрастыруҚазіргі уақытта филогенетикалық ағаштар әдетте ақуыз немесе нуклеин қышқылы (ДНҚ немесе РНҚ) тізбегінен қайта құрылады (Молекулалық филогенетиканы қараңыз). Ағаштар арнайы есептеу (филогенетикалық) алгоритмдерді пайдалана отырып, енгізу реттілігінің ерікті санынан құрастырылады. Берілген (тураланған) тізбектер жиынының берілген ағаш топологиясына сәйкестігінің ең сенімді өлшемі ең жоғары ықтималдық принципіне негізделген өлшем (критерий) болып табылады. Байес принципі де жиі қолданылады, дегенмен оның қолданылуы даулы[4]. Ықтималдық критерийлер (максималды ықтималдық және Байесиялық) оларды есептеу үшін көп компьютер уақытын қажет етеді. Басқа критерийлер - «максималды парсимония» деп аталатын, сондай-ақ кіріс тізбектері арасындағы қашықтықтарды алдын ала есептеуге негізделген бірнеше критерийлер - жылдамырақ есептеледі. Қашықтықты есептеуге негізделген кейбір критерийлер ең жоғары ықтималдыққа негізделген критерийлерге қарағанда тезірек есептеліп қана қоймай, сенімдірек екенін көрсететін нәтижелер бар.Кез келген критерий үшін оңтайлы (берілген өлшем үшін) ағашты табу мәселесі туындайды. Бақылау сұрақтары Біз тек осы тізбектерден олардың жақын түрлерге жататынын айта аламыз ба? Бұл кішігірім айырмашылықтар таңдауға байланысты эволюциялық аберрацияларды білдіреді ме, әлде олар жай ғана кездейсоқ шу немесе кездейсоқ ауытқу ма? Ұқсастықтар мен айырмашылықтардың маңыздылығын анықтау үшін сезімтал статистикалық тест болуы қажет пе? Бұл мәселелерді нақтылау үшін екі ұғым қолданылады: ұқсастық (немесе ұқсастық, ұқсастық) және гомология (гомология). Тізбектердің ұқсастығын (немесе макроскопиялық биологиялық сипаттамаларды) оларды туралау арқылы бағалауға болады және ешқандай тарихи гипотеза көзделмейді ме? Практикалық жұмыс №9.Ақуыздың кеңістік құрылымын анықтау. Белоктардың жіктелуі олардың химиялық құрамына негізделген. Бұл классификацияға сәйкес белоктар қарапайымжәне кешен. Қарапайым белоктар тек амин қышқылдарынан, яғни бір немесе бірнеше полипептидтерден тұрады. Адам ағзасында кездесетін қарапайым белоктар альбуминдер, глобулиндер, гистондар, тірек ұлпа ақуыздары. Күрделі ақуыз молекуласында амин қышқылдарынан басқа аминқышқылды емес бөлігі де бар. протездік топ.Бұл топтың құрылымына қарай мұндай күрделі белоктар болып бөлінеді фосфопротеиндер (фосфор қышқылы бар) нуклеопротеидтер(нуклеин қышқылы бар), гликопротеидтер(құрамында көмірсу бар) липопротеиндер(құрамында липоид бар) және т.б. Белоктардың кеңістіктік пішініне негізделген жіктелуі бойынша белоктар бөлінеді фибриллярлықжәне шар тәрізді. Фибриллярлы белоктар спиральдан тұрады, яғни негізінен екіншілік құрылымнан тұрады. Глобулярлы белоктардың молекулалары сфералық және эллипсоидты пішінге ие. Фибриллярлық белоктардың мысалы болып табылады коллаген -адам ағзасындағы ең көп ақуыз. Бұл белок ағзадағы белоктардың жалпы санының 25-30% құрайды. Коллаген жоғары беріктік пен серпімділікке ие. Бұл бұлшықеттердің, сіңірлердің, шеміршектердің, сүйектердің, тамыр қабырғаларының тамырларының бөлігі. Глобулярлы белоктардың мысалы болып табылады қан плазмасындағы альбуминдер мен глобулиндер. Белоктардың негізгі ерекшеліктерінің бірі олардың жоғары молекулалық салмақ, ол 6000-нан бірнеше миллион дальтонға дейін ауытқиды. Белоктардың тағы бір маңызды физика-химиялық қасиеті – олардың амфотерлік,яғни қышқылдық та, негіздік те қасиеттердің болуы.Амфотерлік кейбір аминқышқылдарының құрамында бос карбоксил топтарының, яғни қышқылдық және амин топтарының, яғни сілтінің болуымен байланысты. Бұл қышқыл ортада белоктардың сілтілі, ал сілтілі ортада қышқылдық қасиетін көрсететініне әкеледі. Дегенмен, белгілі бір жағдайларда белоктар бейтарап қасиеттерді көрсетеді. Белоктар бейтарап болатын рН мәні деп аталады изоэлектрлік нүкте. Әрбір ақуыз үшін изоэлектрлік нүкте жеке болып табылады. Осы көрсеткіш бойынша белоктар екі үлкен класқа бөлінеді - қышқыл және сілтіліөйткені изоэлектрлік нүкте бір жаққа да, екіншісіне де ығысуы мүмкін. Белок молекулаларының тағы бір маңызды қасиеті ерігіштігі.Үлкен молекулалық мөлшеріне қарамастан, ақуыздар суда жақсы ериді. Оның үстіне белоктардың судағы ерітінділері өте тұрақты. Белоктардың ерігіштігінің бірінші себебі – белок молекулаларының бетінде зарядтың болуы, соның салдарынан белок молекулалары іс жүзінде суда ерімейтін агрегаттарды түзбейді. Ақуыз ерітінділерінің тұрақтылығының екінші себебі - белок молекуласында гидрат (су) қабықшасының болуы. Гидратация қабығы белоктарды бір-бірінен ажыратады. Белоктардың үшінші маңызды физика-химиялық қасиеті тұздану,яғни сусыздандырушы заттардың әсерінен тұнбаға түсу мүмкіндігі.Тұздану - қайтымды процесс. Бұл шешімге, содан кейін одан шығу қабілеті көптеген өмірлік қасиеттердің көрінісі үшін өте маңызды. Ақырында, белоктардың ең маңызды қасиеті – олардың қабілеттілігі денатурация.Денатурация - бұл ақуыздың табиғи қасиетін жоғалту.Біз қуырылған табада жұмыртқаны жасағанда, біз қайтымсыз ақуыз денатурациясын аламыз. Денатурация – белоктың екінші және үшінші құрылымының тұрақты немесе уақытша бұзылуы, бірақ біріншілік құрылымы сақталады. Температурадан басқа (50 градустан жоғары) басқа физикалық факторлар денатурацияны тудыруы мүмкін: радиация, ультрадыбыстық, діріл, күшті қышқылдар және сілтілер. Денатурация қайтымды немесе қайтымсыз болуы мүмкін. Кішігірім әсерлермен ақуыздың екінші және үшінші құрылымдарының бұзылуы шамалы болады. Сондықтан денатурациялық әсер болмаған жағдайда, ақуыз өзінің табиғи құрылымын қалпына келтіре алады. Кері денатурация процесі деп аталады ренатурация.Дегенмен, ұзақ және күшті әсер етуменренатурация мүмкін емес, сондықтан денатурация қайтымсыз болады. Тиіндер - Бұл пептидтік байланыстармен (-CO-NH-) байланысқан α-амин қышқылы қалдықтарынан тұратын биополимерлер. Белоктар барлық тірі организмдердің жасушалары мен ұлпаларының бөлігі болып табылады. Ақуыз молекулаларында 20 түрлі амин қышқылы қалдықтары болады. белок құрылымы Белоктардың құрылымы таусылмайтын сан алуан. Белоктың бастапқы құрылымысызықтық полипептидтік тізбектегі амин қышқылы бірліктерінің тізбегі. қосалқы құрылым- бұл топтар арасындағы сутектік байланыстар есебінен полипептидтік тізбектің бұралуы нәтижесінде түзілетін спиральға ұқсайтын ақуыз молекуласының кеңістіктік конфигурациясы: CO және NH. Үшіншілік құрылым- бұл спиральға айналдырылған полипептидтік тізбек қабылдайтын кеңістіктік конфигурация. Төрттік құрылымбірнеше белок макромолекулаларының полимерлі түзілістері болып табылады. Гидратация процесі суды ақуыздармен байланыстыруды білдіреді, бұл ретте олар гидрофильдік қасиет көрсетеді: олар ісінеді, олардың массасы мен көлемі артады. Протеиннің ісінуі оның ішінара еруімен бірге жүреді. Жеке белоктардың гидрофильділігі олардың құрылымына байланысты. Құрамында бар және белоктың макромолекуласының бетінде орналасқан гидрофильді амид (–CO–NH–, пептидтік байланыс), амин (NH 2) және карбоксил (COOH) топтары су молекулаларын тартады, оларды қатаң түрде олардың бетіне бағыттайды. молекула. Ақуыз түйіршіктерін қоршап тұрған гидрат (су) қабығы белок ерітінділерінің тұрақтылығын болдырмайды. Изоэлектрлік нүктеде белоктардың суды байланыстыру қабілеті ең аз болады, ақуыз молекулаларының айналасындағы гидратациялық қабық бұзылады, сондықтан олар үлкен агрегаттар түзу үшін біріктіріледі. Белок молекулаларының агрегациясы олар этил спирті сияқты кейбір органикалық еріткіштермен сусызданғанда да болады. Бұл белоктардың тұнбаға түсуіне әкеледі. Ортаның рН өзгерген кезде белоктың макромолекуласы зарядталып, оның гидратация қабілеті өзгереді. Шектеулі ісіну кезінде концентрацияланған ақуыз ерітінділері желе деп аталатын күрделі жүйелерді құрайды. Желе сұйық емес, серпімді, пластикалық, белгілі бір механикалық беріктікке ие және пішінін сақтай алады. Глобулярлы белоктар суда (мысалы, сүт белоктары) еріп, концентрациясы төмен ерітінділер түзе отырып, толық гидратациялануы мүмкін. Белоктардың гидрофильдік қасиеттерінің биологияда және тамақ өнеркәсібінде үлкен маңызы бар. Негізінен ақуыз молекулаларынан тұратын өте қозғалмалы желе цитоплазма болып табылады - жасушаның жартылай сұйық құрамы. Жоғары гидратталған желе бидай қамырынан оқшауланған шикі глютен болып табылады және құрамында 65% дейін су бар. Бидай дәнінің, дән белоктары мен ұнның негізгі сапасы гидрофилділік дәнді сақтау мен өңдеуде, нан пісіруде маңызды рөл атқарады. Нан-тоқаш өнеркәсібінде алынатын қамыр суда ісінген белок, құрамында крахмал дәндері бар концентрлі желе. Көбіктену Көбік түзу процесі – ақуыздардың көбік деп аталатын жоғары концентрациялы сұйық-газ жүйелерін құру қабілеті. Ақуыз көбік түзуші болып табылатын көбіктің тұрақтылығы оның табиғаты мен концентрациясына ғана емес, сонымен қатар температураға да байланысты. Ақуыздар кондитерлік өнеркәсіпте көбік түзетін заттар ретінде кеңінен қолданылады (зефир, зефир, суфле).Нанның көбік құрылымы бар және бұл оның дәмдік қасиеттеріне әсер етеді. Жану Белоктар азоттың, көмірқышқыл газының және судың, сондай-ақ кейбір басқа заттардың түзілуімен жанады. Жану күйдірілген қауырсындардың тән иісімен бірге жүреді. түсті реакциялар. Ксантопротеин - сары түстің пайда болуымен бірге ақуыз молекуласындағы ароматты және гетероатомдық циклдердің концентрлі азот қышқылымен әрекеттесуі жүреді; Биурет – мыс (II) сульфатының ерітіндісімен белоктардың сәл сілтілі ерітінділерінің Cu 2+ иондары мен полипептидтер арасында комплексті қосылыстардың түзілуімен әрекеттесуі жүреді. Реакция күлгін-көк түстің пайда болуымен бірге жүреді; ақуыздарды қорғасын тұздарының қатысуымен сілтімен қыздырғанда құрамында күкірт бар қара тұнба пайда болады. Тиіндер- α-аминқышқылдарының қалдықтарынан тұратын жоғары молекулалы органикалық қосылыстар. AT ақуыз құрамыкөміртегі, сутегі, азот, оттегі, күкірт кіреді. Кейбір белоктар құрамында фосфор, темір, мырыш және мыс бар басқа молекулалармен кешен түзеді. Белоктардың молекулалық массасы үлкен: жұмыртқа альбумині - 36 000, гемоглобин - 152 000, миозин - 500 000. Салыстыру үшін: спирттің молекулалық массасы 46, сірке қышқылы - 60, бензол - 78. Белоктардың аминқышқылдық құрамы Тиіндер- мономерлері периодты емес полимерлер α-амин қышқылдары. Әдетте, α-амин қышқылдарының 20 түрі ақуыздық мономерлер деп аталады, бірақ олардың 170-тен астамы жасушалар мен ұлпаларда табылған. Амин қышқылдарының адам және басқа жануарлар организмінде синтезделу мүмкіндігіне байланысты: маңызды емес аминқышқылдары- синтездеуге болады маңызды аминқышқылдары- синтездеуге болмайды. Маңызды аминқышқылдары тамақпен бірге қабылдануы керек. Өсімдіктер аминқышқылдарының барлық түрлерін синтездейді. Амин қышқылының құрамына байланысты белоктар: толық- аминқышқылдарының барлық жиынтығын қамтиды; ақаулы- олардың құрамында кейбір аминқышқылдары жоқ. Егер белоктар тек амин қышқылдарынан тұрса, олар деп аталады қарапайым. Егер белоктардың құрамында амин қышқылдарынан басқа аминқышқылды емес құрамдас (протездік топ) болса, олар деп аталады. кешен. Протездік топ металдар (металлопротеидтер), көмірсулар (гликопротеидтер), липидтер (липопротеидтер), нуклеин қышқылдары (нуклеопротеидтер) арқылы ұсынылуы мүмкін. Бәрі амин қышқылдары бар: 1) карбоксил тобы (-COOH), 2) амин тобы (-NH 2), 3) радикал немесе R-тобы (молекуланың қалған бөлігі). Әр түрлі аминқышқылдарындағы радикалдың құрылымы әртүрлі. Амин қышқылдарын құрайтын амин топтары мен карбоксил топтарының санына байланысты: бейтарап амин қышқылдарыбір карбоксил тобы және бір амин тобы бар; негізгі амин қышқылдарыбірнеше амин тобының болуы; қышқыл амин қышқылдарыбірнеше карбоксил тобы бар. Амин қышқылдары амфотерлі қосылыстар, өйткені ерітіндіде олар қышқылдар да, негіздер де әрекет ете алады. Су ерітінділерінде аминқышқылдары әртүрлі иондық формаларда болады. Пептидтік байланыс Пептидтер- пептидтік байланыс арқылы байланысқан аминқышқылдарының қалдықтарынан тұратын органикалық заттар. Пептидтердің түзілуі аминқышқылдарының конденсациялану реакциясы нәтижесінде жүреді. Бір амин қышқылының амин тобы екіншісінің карбоксил тобымен әрекеттескенде олардың арасында ковалентті азот-көміртек байланысы пайда болады, оны пептид. Пептидті құрайтын аминқышқылдарының қалдықтарының санына байланысты бар дипептидтер, трипептидтер, тетрапептидтержәне т.б. Пептидтік байланыстың түзілуі бірнеше рет қайталануы мүмкін. Бұл қалыптасуына әкеледі полипептидтер. Пептидтің бір ұшында бос амин тобы (оны N-терминус деп атайды), ал екінші ұшында бос карбоксил тобы (оны С-соңы деп атайды) орналасады. 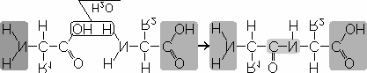 Белок молекулаларының кеңістікте ұйымдастырылуы Белгілі бір спецификалық функцияларды ақуыздардың орындауы олардың молекулаларының кеңістіктік конфигурациясына байланысты, сонымен қатар, жасушаның белоктарды кеңейтілген түрде, тізбек түрінде ұстауы энергетикалық жағынан қолайсыз, сондықтан полипептидтік тізбектер қатпарлану, сатып алу процесі жүреді. белгілі бір үш өлшемді құрылым немесе конформация. 4 деңгейді бөліңіз белоктардың кеңістіктік ұйымдастырылуы. Белоктың бастапқы құрылымы- белок молекуласын құрайтын полипептидтік тізбектегі аминқышқылдарының қалдықтарының реттілігі. Аминқышқылдары арасындағы байланыс пептид болып табылады. 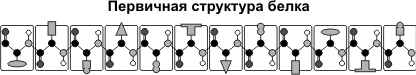 Егер ақуыз молекуласы тек 10 амин қышқылы қалдықтарынан тұрса, онда аминқышқылдарының кезектесу ретімен ерекшеленетін белок молекулаларының теориялық мүмкін нұсқаларының саны 10 20 . 20 аминқышқылдарының көмегімен сіз олардың бұдан да әртүрлі комбинацияларын жасай аласыз. Адам ағзасында бір-бірінен де, басқа организмдердің белоктарынан да ерекшеленетін он мыңға жуық түрлі белоктар табылды. Бұл белок молекулаларының қасиеттерін және оның кеңістіктік конфигурациясын анықтайтын ақуыз молекуласының бастапқы құрылымы. Полипептидтік тізбектегі бір ғана амин қышқылының екіншісімен алмастырылуы белоктың қасиеттері мен функцияларының өзгеруіне әкеледі. Мысалы, гемоглобиннің β-бөлімшесінде алтыншы глютамин амин қышқылын валинмен ауыстыру гемоглобин молекуласының тұтастай алғанда өзінің негізгі қызметін – оттегін тасымалдауды орындай алмайтындығына әкеледі; мұндай жағдайларда адам ауруды дамытады - орақ жасушалы анемия. қосалқы құрылым- полипептидтік тізбектің спиральға реттелген бүктелуі (созылған серіппеге ұқсайды). Спиральдың катушкалары карбоксил топтары мен амин топтары арасындағы сутектік байланыстармен нығайған. Барлық дерлік CO және NH топтары сутектік байланыстардың түзілуіне қатысады. Олар пептидтерге қарағанда әлсіз, бірақ бірнеше рет қайталанып, олар осы конфигурацияға тұрақтылық пен қаттылық береді. Екінші реттік құрылым деңгейінде белоктар: фиброин (жібек, тор), кератин (шаш, тырнақ), коллаген (сіңір) болады. |
