Химия Задание 2 вариант 4. Росдистант Химия задание 2 вариант 4. Бланк выполнения задания 2
 Скачать 24.16 Kb. Скачать 24.16 Kb.
|
Бланк выполнения задания № 2Цель работы: определение теплового эффекта системы, в которой происходит химическая реакция, и энтальпии реакции в нестандартных условиях Опыт 1 Реакция нейтрализации серной кислоты гидроксидом натрия в одну стадию: H2SO4 + 2NaOH = Na2SO4 + 2H2O; ± ∆Н1 Результаты опыта 1 занесите в таблицу 1. Таблица 1
Расчеты: 2.1. Рассчитайте количество теплоты для каждого из веществ:Q = V · ρ · c ∙ t, округляя до целого значения: 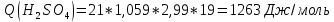 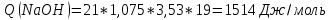 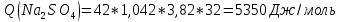 2.2. Определите число молей, округляя до тысячных: 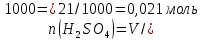 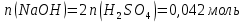 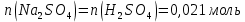 2.3. Рассчитайте энтальпию каждого вещества: ∆Н = 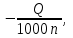 округляя до сотых: округляя до сотых: 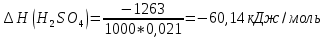 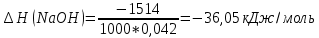 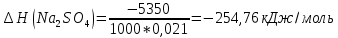 2.4. По следствию из закона Гесса определите тепловой эффект системы и энтальпию реакции: 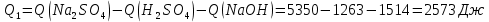 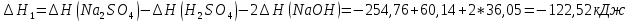 Опыт 2 Реакция нейтрализации серной кислоты гидроксидом натрия в две стадии: H2SO4 + NaOH = NaНSO4 + H2O; ± ∆Н2.1 NaHSO4 + NaOH = Na2SO4 + H2O; ± ∆Н2.2 Результаты опыта 2 занесите в таблицу 2. Таблица 2
Расчеты: 4.1. Рассчитайте количество теплоты для каждого из веществ:Q = V · ρ · c ∙ t, округляя до целого значения: 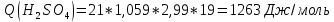 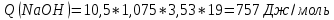 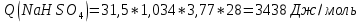 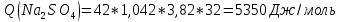 4.2. Определите число молей, округляя до тысячных: 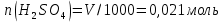 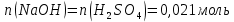 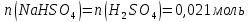 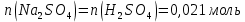 4.3. Рассчитайте энтальпию каждого вещества: ∆Н = 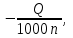 округляя до сотых: округляя до сотых: 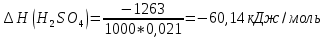 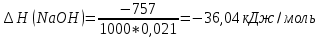 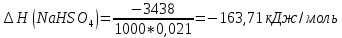 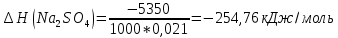 4.4. По следствию из закона Гесса определите тепловые эффекты систем и энтальпии реакций: 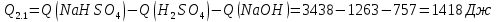 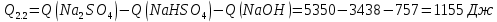 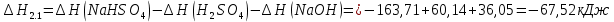 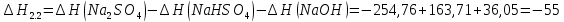 4.5. Выполните проверку: – по тепловому эффекту системы: 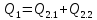 ; ;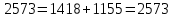 – по энтальпии реакции: 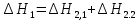 ; ;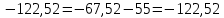 4.6. Рассчитайте относительную ошибку опыта: ∆= 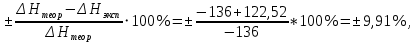 если ∆Нтеор = – 136кДж, ∆Нэксп = ∆Н1 Сделайте вывод к работе. Посредством проведенных опытов удалось доказать, что тепловой эффект и энтальпия процесса нейтрализации не зависят от количества стадий реакции. Высокая относительная погрешность опыта объяснима потерей тепла в окружающую среду и тепло, затраченное на нагревание дополнительно выделившегося количества воды, которая также является продуктом нейтрализации. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
