орг химия. Что такое органическая химия Органическая химия это химия соединений углерода Что изучает органическая химия
 Скачать 3.15 Mb. Скачать 3.15 Mb.
|
|
Что такое органическая химия? Органическая химия– это химия соединений углерода Что изучает органическая химия? Признаком, общим для всех органических соединений, является наличие углерода в их молекулах. Задание. Объясните, почему данные соединения- органические соединения. 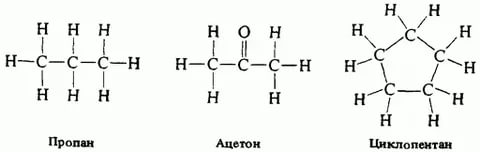 Данное соединение – органическое, поскольку состоит из атомов углерода, которые связаны друг с другом, и каждый из них образует четыре связи. Разнообразие органических молекул. Органические соединения − это соединения, которые содержат атомы углерода, связанные друг с другом и с другими неметаллическими атомами за счет ковалентных связей. Молекулярная формула показывает количественный состав вещества, но не показывает, как они соединены атомы в молекуле. Например, молекулярная формула бутана С 4 Н 10, и молекулярная формула этанола С 2 Н 6 О. Молекулярные формулы очень редко используется в органической химии, потому что они не дают никакой полезной информации о связи в молекуле. Их используют в записи уравнений реакций для сжигания простых углеводородов, например: Структурная формула показывает, каким образом различные атомы связаны между собой. Отображаемая формула показывает все связи в молекуле в виде отдельных линий. Вы должны помнить, что каждая строка представляет собой пару общих электронов. Многообразие органических веществ в отличии от неорганических. (в 1880году было известно больше 12000 органических соединений, которые были в основном образованы тремя элементами: углерод, водород, кислород, реже фосфор и сера, В то время, как неорганических веществ было известно в четыре раза меньше и образованы они множеством химических элементов, известных тогда около60.) Обратите внимание на состав органических веществ. Что общего в химических формулах органических веществ? 2.Валентность. Вы знаете, что наивысшая валентность атома углерода равна 4. Почему? 3. Почему одна и та же молекулярная формула соответствует названиям двух разных веществ? Например: этанол и диэтиловый эфир - (С2Н5ОН); Чтобы ответить на все эти вопросы, нужен был какой-то закон, которого ещё не было, но уже возникли важнейшие научные предпосылки теории химического строения органических веществ. Это: 1853год-Франкланд ввёл понятие «валентность» 1857год-Кекуле и Купер выдвинули идею о соединении атомов углерода в цепи; 1858год- немецкий учёный Кекуле предложил понятие четырёхвалентности атома углерода; 1860год - проходил международный съезд химиков в г. Карсруэ, где окончательно утвердилось атомно-молекулярное учение; были приняты первые единые определения атома и молекулы, понятие «атомный вес». Но это были только отдельные высказывания, которые не представляли собой единой системы теоретических взглядов. Большинство химиков 19 века отрицали возможность познания строения веществ. На этом фоне представлений о неопознаваемости молекул Бутлеров обобщает накопленный материал в органической химии и создаёт новую, революционную для того времени теорию. Бутлеров первым ввёл в науку понятие о химическом строении и дал новое определение природы вещества; доказал теоретически и показал на практике, как можно определить химическое строение молекулы и выразить его формулой. И в 1861году А.М.Бутлеров выступил с докладом «О химическом строении веществ на съезде немецких естествоиспытателей и врачей в городе Шлейер. Теория строения органических соединений. Первое положение. Атомы в молекулах соединяются в определенной последовательности согласно их валентности. Углерод во всех органических и в большинстве неорганических соединений четырехвалентен. Второе положение. Свойства веществ зависят не только от их качественного и количественного состава, но и от строения их молекул. Это положение объясняет явление изомерии. Вещества, имеющие одинаковый состав, но разное химическое или пространственное строение, а, следовательно, и разные свойства, называют изомерами. Третье положение: Атомы или группы атомов взаимно влияют друг на друга. Например: в уксусной кислоте в реакцию со щелочью вступает только один из четырех атомов водорода. На основании этого можно предположить, что только один атом водорода связан с кислородом: с другой стороны, из структурной формулы уксусной кислоты можно сделать вывод о наличии в ней одного подвижного атома водорода, то есть, о её одноосновности. Четвёртое положение: По свойствам вещества можно определить строение, а по строению свойства.  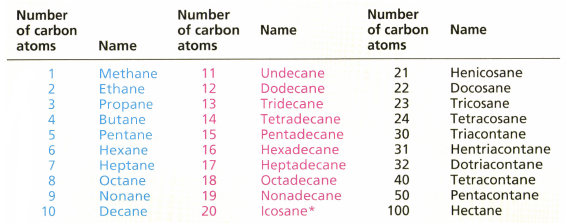 Определения: 1. Гомологическим рядом называют ряд соединений, сходных по своему строению и свойствам, но отличающихся друг от друга по составу на одну или несколько групп – СН2 -, которую называют гомологической разностью. 2. Изомерия – это явление существования изомеров, т.е. веществ различного строения, но с одинаковым качественным и количественным составом (одинаковой молекулярной формулой). 3. Органическая химия – химия углеводородов и их прооизводных, т.е. продуктов, образующихся при замене атомов водорода другими атомами или группами атомов. 4. Гибридизация атомных орбиталей – это модельное представление о смешении разных, но близких по энергии орбиталях данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по энергии и форме. 5. Структурная формула – формула, отражающая последовательность соединения атомов в молекуле, но не показывающая, как эти атомы расположены в пространстве.
Если цепь углеродных атомов не замкнута (открыта), вещество относится к группе ациклических соединений (алифатические соединения). Соответственно наличие замкнутой цепочки атомов позволяет назвать вещество циклическим. Если замкнутую цепочку циклического вещества составляют только атомы углерода, его называют карбоциклическим. Кислород входит в состав органических веществ не как отдельные атомы, а в виде группы атомов. Такая группа называется функциональной. Именно она определяет важнейшие физические и химические свойства вещества в целом, а также его принадлежность к тому или иному классу веществ. Соединения из одного гомологического ряда имеют аналогичные свойства, что значительно упрощает изучение органической химии и позволяет вывести общие закономерности. Например, в гомологическом ряду алканов имеют место следующие закономерности, определяемые увеличением относительной молекулярной массы: 1) осуществляется переход агрегатного состояния от газообразного к жидкому, затем к твердому; 2) увеличиваются, как правило, температура плавления и кипения Гибридизация Основные типы гибридизации, характерные для атома углерода: SP3 Гибридизация характерна для предельных органических соединений. В этом случае атомы углерода образуют четыре одинарные связи, т.е. валентность атомов углерода равна IV. Такую валентность атом углерода имеет в возбужденном состоянии: . В результате гибридизации одной 2s-орбитали и трех 2p-орбиталей образуются четыре -гибридные орбитали, одинаковые по форме и энергии: 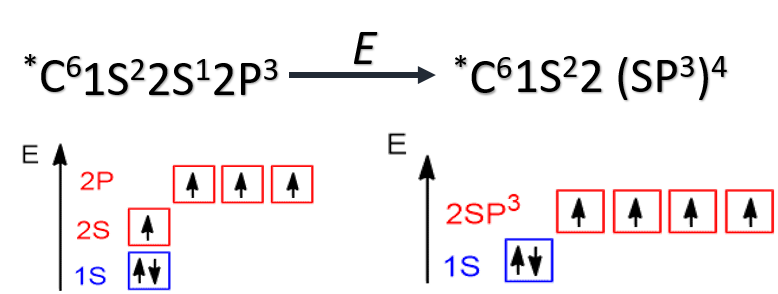 Образование -гибридизованных АО в атоме углерода, можно показать также с помощью графической картинки: 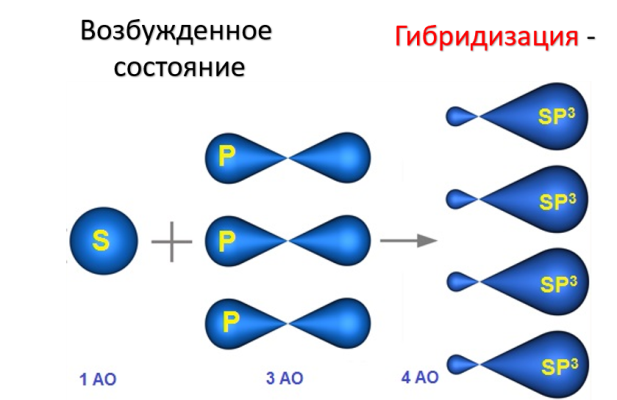 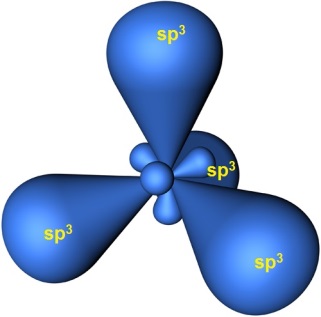 Образовавшиеся гибридные АО могут перекрываться другими АО, например 1s-орбиталями атомов водорода. Химические связи в молекуле метана образуются вдоль линии, соединяющей ядра атомов. Геометрическая форма молекулы - тетраэдр: 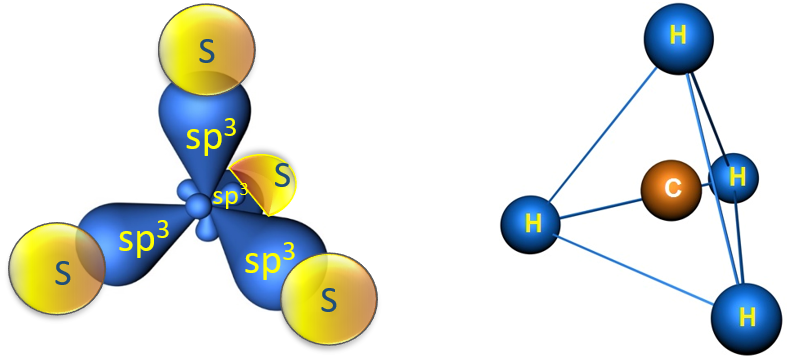 SP2 - ГИБРИДИЗАЦИЯ SP2-гибридизация характерна для органических соединений, содержащих двойную связь. В этом случае одна 2s-орбиталь и две 2p-орбитали образуют три -гибридные орбитали, одинаковые по форме и энергии, а негибридизованная 2р-АО выше по энергии и имеет форму гантели: 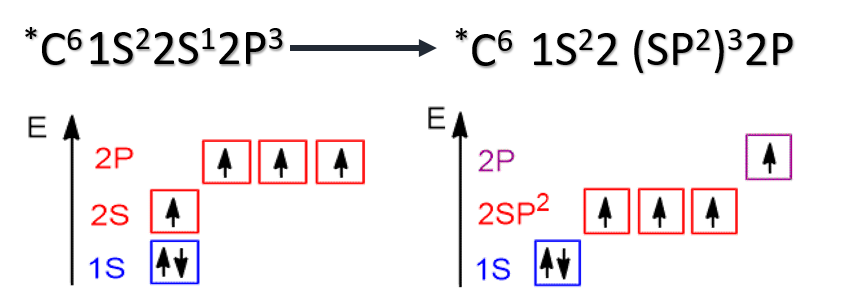 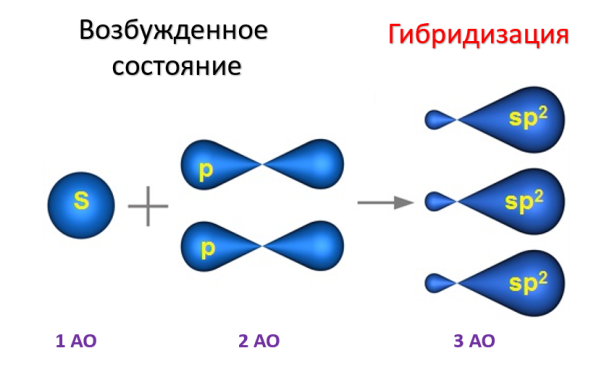 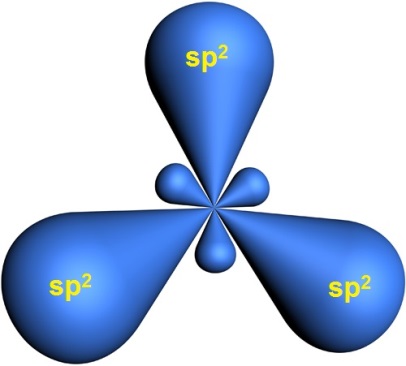 Три p-гибридные орбитали атома углерода образуют три -связи с 1s-орбиталями атомов водорода или орбиталями других атомов, например углерода . Негибридная р-АО также участвует в образовании связи в результате бокового перекрывания с другой негибридной p-АО орбиталью другого атома углерода: 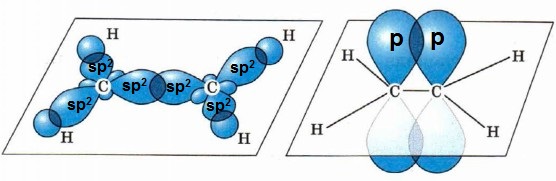 SP - ГИБРИДИЗАЦИЯ -Гибридизация характерна для органических соединений, содержащих тройную связь. В этом случае одна 2s-орбиталь и одна 2p-орбиталь образуют две -гибридные орбитали, одинаковые по форме и энергии, а негибридизованные две 2р-АО выше по энергии и имеют форму гантели: 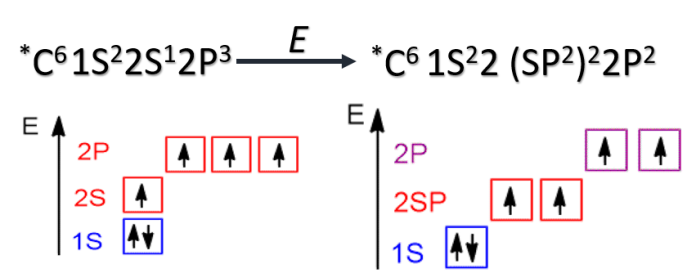 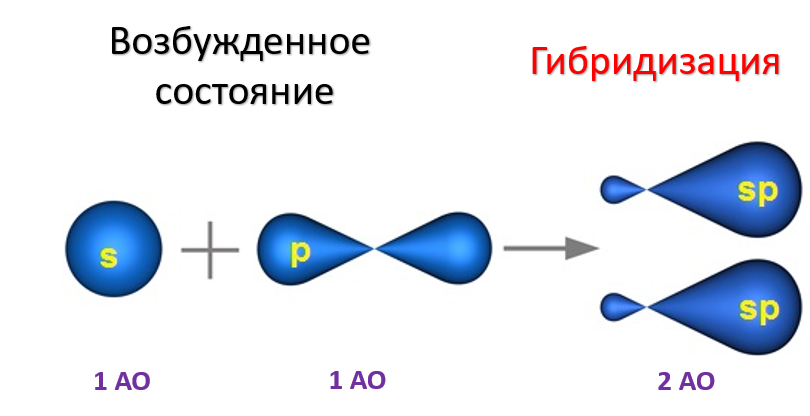  Две гибридные sp-АО участвуют в образовании -связей, а две негибридные 2р-АО образуют две -связи с соседними негибридными p-АО в результате бокового перекрывания: 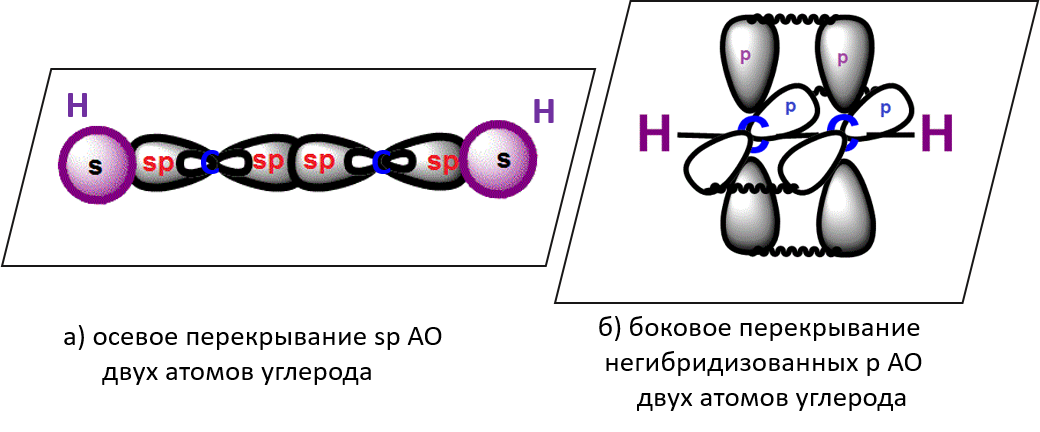 Термин «изомерия» ввел в 1830 г Й.Я. Берцелиус, который объяснял различие свойств изомеров «различным распределением атомов в молекуле вещества». Различают два вида изомерии: структурную и пространственную (стереоизомерию). Структурные изомеры отличаются друг от друга порядком связи атомов в молекуле, стереоизомеры – расположением атомов в пространстве при одинаковом порядке связей между ними. Структурная изомерия. Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию). Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Молекулярной формуле С4Н10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводородов С5Н12 возможны три изомера: н-пентан, изопентан и неопентан. 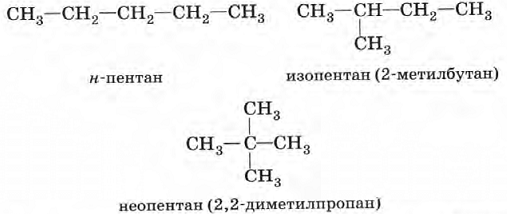 С увеличением числа атомов углерода в молекуле число изомеров быстро растет. Для углеводорода С10Н22 их уже 75, а для углеводорода С20Н42 – 366319. Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы. 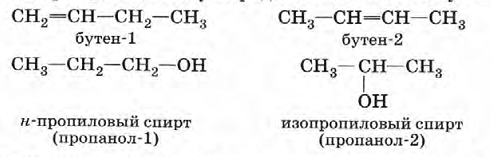 Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих разным классам. Так, молекулярной формуле С6Н12 соответствует ненасыщенный углеводород гексен-1 и циклический углеводород циклогексан. 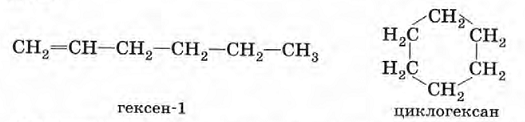 Изомерами являются углеводород, относящийся к алкинам, - бутин-1 и углеводород с двумя двойными связями в цепи – бутадиен-1,3. Диэтиловый эфир и бутиловый спирт имеют одинаковую молекулярную формулу С4Н10О. 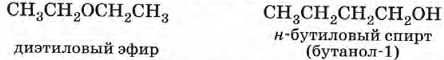 Изомеры этого типа содержат различные функциональные группы и относятся к разням классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения. 1. Какие из соединений, формулы которых приведены ниже, являются: а) изомерами; б) гомологами: 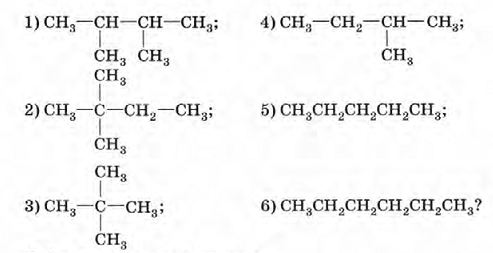 2. Какие виды изомерии возможны для соединений, имеющих следующие формулы (напишите структурные формулы всех возможных изомеров): а) С6Н14; б) С4Н8; в) С3Н8О; г) С4Н9Сl; д) С4Н10О? 3. Найдите среди предлагаемых формул соединений изомеры: 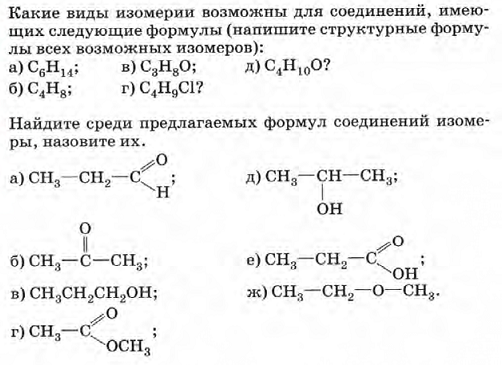 «Лото» Представлено 9 обозначенных буквами изомеров алкана C7Н16. Найдите им пару из обозначенных цифрами изомеров такого же строения. Некоторые цифры могут быть не использованы, а некоторые могут быть использованы дважды. 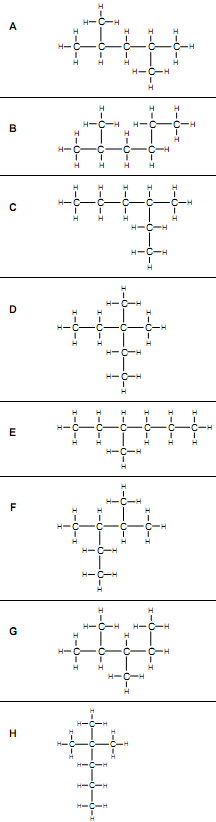 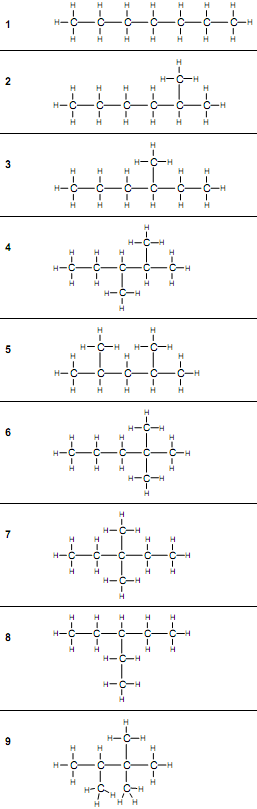 Индивидуальная работа. 1. Определите, сколько веществ обозначено следующими формулами. 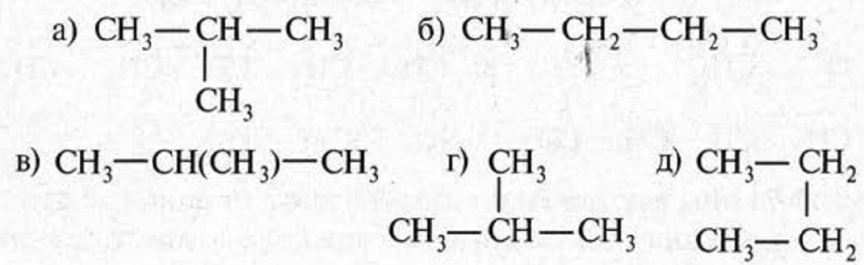 2. Найдите изомеры среди следующих веществ: 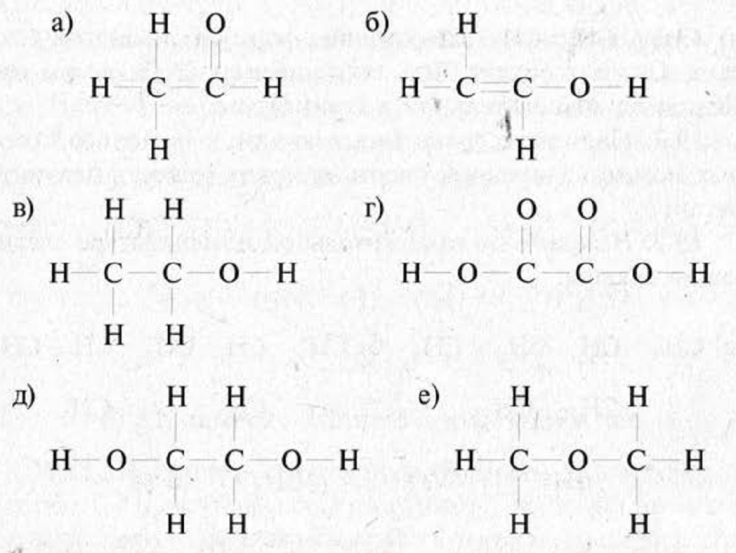 3. Являются ли следующие вещества изомерами? Ответ поясните. 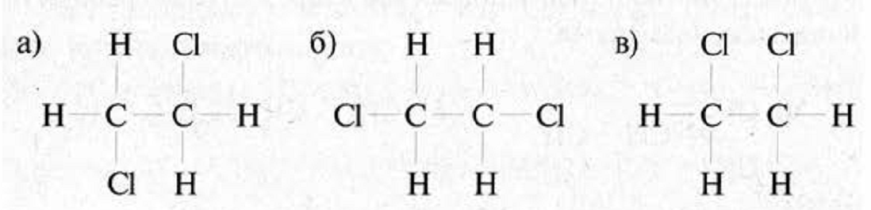 4. Какие из записанных формул органических соединений являются изомерами? 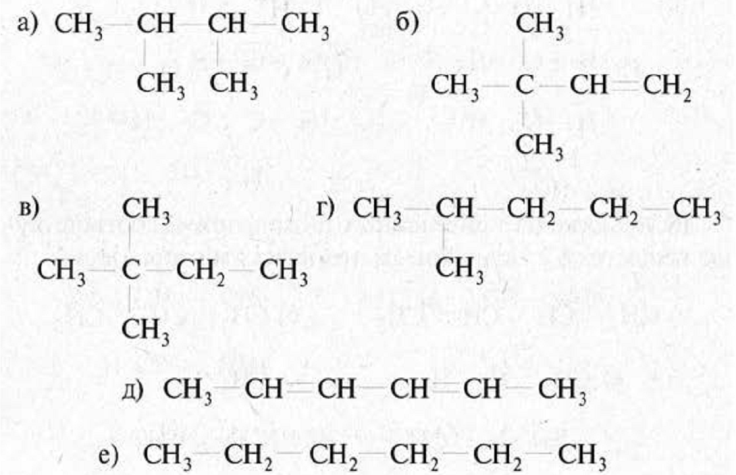 5, Сколько изомеров может иметь соединение, имеющее эмпирическую формулу C3H7Br? Изобразите структурные формулы всех изомеров. 6. Какие из записанных молекул имеют разветвленную углеводородную цепь? 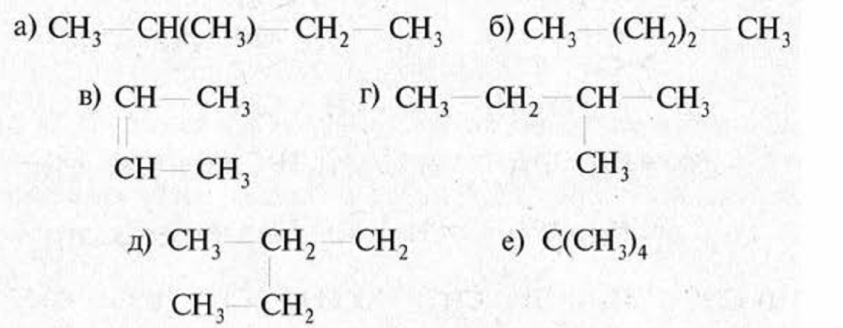 Функциональная группа – это атом или группа атомов неуглеводородного характера, которые определяют принадлежность соединения к определённому классу. На приведенных примерах указывается на необходимость уметь называть органические вещества. Учитель отмечает, что признаком, по которому органические вещества относят к тому или иному классу, является природа функциональной группы. Например, при замене одного атома водорода в молекуле этана на атом хлора образуется соединение, относящееся к классу галогенпроизводных. Если же заменить атом водорода на гидроксогруппу, то образуется вещество, относящееся к классу спиртов. Именно функциональные группы определяют во многом химические свойства данного класса органических соединений. Учащиеся рассматривают таблицу «Важнейшие функциональные группы и классы органических соединений»:  Индивидуальное задание Выберите формулы соединений с функциональными группами: 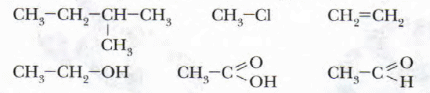 Многие функциональные группы не содержат атомов углерода, а в карбоксильной и карбонильной группах атом углерода связан с атомами кислорода. Соединения могут содержать не одну, а несколько функциональных групп (аминокислоты). Если эти группы одинаковые, то соединения называют полифункциональными (глицерин). Соединения, содержащие различные функциональные группы, называют гетерофункциональными. Их можно одновременно отнести к нескольким классам соединений. Например, молочную кислоту СН3СН(ОН)СООН можно рассматривать и как кислоту, и как спирт. Тривиальные названия (исторически сложившиеся) появились первыми в органической химии. Их давали веществам, структура которых даже была не известна. Учитель указывает, что тривиальные названия давали либо по источнику выделения вещества (мочевина – в моче), либо по некоторым свойствам (глицерин, глицин, глюкоза – сладкий вкус). Тривиальные названия широко распространены среди природных соединений – аминокислот, углеводов, алкалоидов и др. эти названия удобны своей лаконичностью, но они не могут быть объединены в систему. Номенклатура - способ наименования соединений. По мере развития и систематизации химических знаний веществам стали давать названия, указывающие на их сходство с другими веществами по строению (метиловый, этиловый, пропиловый спирт). Они составляют рациональную номенклатуру (от лат. ratio – разум). Рациональная номенклатура рассматривает все вещества определенного класса как производные главного и наиболее простого его представителя. Например, для предельных углеводородов таким веществом является метан, для непредельных – этилен и ацетилен (обсуждение): СН4 / СН3 – СН2 – СН3 диметилметан Н3С – СН=СН – С3Н7 метилпропилэтилен Н3С – С≡С – С2Н5 метилэтилацетилен Рациональную номенклатуру используют для названия сравнительно небольших молекул. Объясняются понятия: первичный, вторичный, третичный и четвертичный атом углерода. Главное место занимает международная систематическая заместительная номенклатура (IUPAC – International Union of Pure and Applied Chemistry), разрабатываемая комиссией Международного союза теоретической и прикладной химии (ИЮПАК). Согласно этой номенклатуре строение молекул органических веществ выражают при помощи сложных слов-названий. Различные части этих слов отражают особенности строения. Затем учащиеся составляют название соединения по формуле: 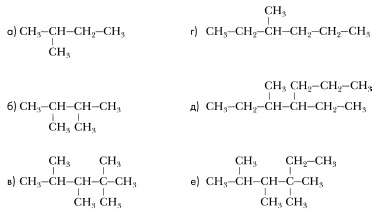 Учитель обращает внимание на то, что органические вещества многообразны. Как же дают названия другим органическим соединениям? Учащиеся рассматривают раздаточный материал – таблицу по наименованию кратных связей и функциональных групп. Правила составления названия рассматриваются на следующем примере (вводится понятие старшинства группы):  |
