2 вариант кванты. Что такое волновая функция Требования, которым отвечает волновая функция
 Скачать 105.98 Kb. Скачать 105.98 Kb.
|
|
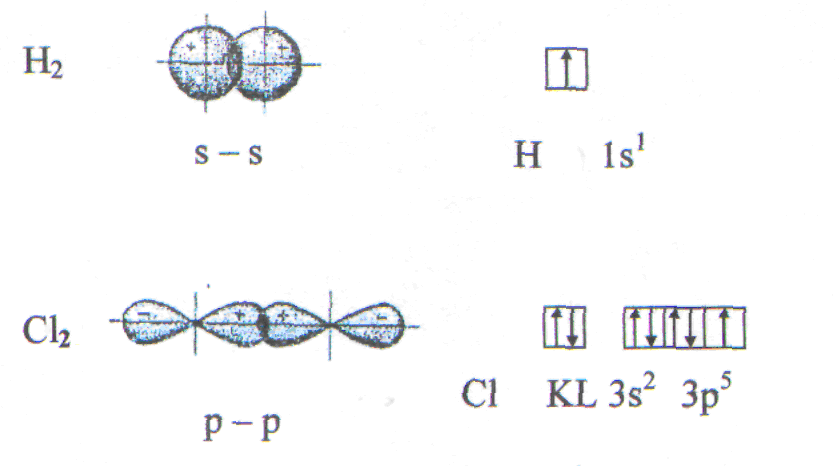
Что такое волновая функция? Требования, которым отвечает волновая функция Каждое состояние системы n частиц полностью описывается функцией координат частиц xi и времени t - волновой функцией (x1, x2, …, xn, t) ({x},t). Требования к «идеальной» ВФ • Конечна • Однозначна • Непрерывна и непрерывно дифференцируема • Нормирована <| > * rrdr 1 ВФ – функция координат всех частиц системы и времени: (x1 , y1 ,z1 ,...,xn , yn ,zn ,t) (r1 ,...,rn ,t) (r ,t) Если временной зависимости нет: (x1 , y1 ,z1 ,...,xn , yn ,zn ) (r1 ,...,rn ) (r) Запишите выражение для электронной волновой функции в приближении центрального поля. Поясните смысл входящих в него величин. Потенциал 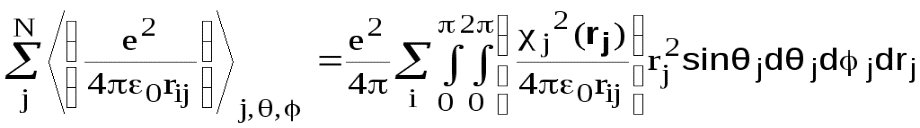 . . Это - приближение центрального поля: оно позволяет рассматривать ССП-решения для любого атома как модифицированные решения для одноэлектронного водородоподобного атома с потенциалом (r) = N(n,l) Rn,l ( r )Ylm (, ), +где N(n,l) - нормировочный множитель, Rn,l ( r ) - радиальная функция, Ylm (, ) - угловая функция; n, l и m – главное, орбитальное и магнитное квантовые числа, соответственно. Приведите примеры эффективного (S ij>0) перекрывания атомных орбиталей s- , p- , d- типа при образовании химической связи а) Положительное (эффективное) перекрывание. В области перекрывания волновые функции обоих электронов ( a и b) имеют одинаковый знак. При положительном перекрывании растет электронная плотность в зоне перекрывания и происходит образование связи.
Запишите условие нормировки волновой функции. Вероятность обнаружить частицу во всем бесконечном пространстве равна единице. Отсюда следует условие нормировки волновой функции: Величина | |||||||||||||||||||||||||||||