катализаторы. Действие катализаторов
 Скачать 173.47 Kb. Скачать 173.47 Kb.
|
|
Действие катализаторов Можно действие катализаторов увеличить скорость реакции, используя специальные вещества, которые изменяют меха низм реакции и направляют ее по энергетически более выгодному пути с меньшей энергией актива ции. Их называют катализаторами (от лат. katalysis — разрушение). То есть вещества А и В серией последовательных реакций с третьим веществом К требуют гораздо меньших затрат энергии и протекают при данных условиях быстрее, чем прямая реакция без катализатора. ![clip_image018[4]_thumb_thumb](77248_html_m34c9950a.jpg) Катализаторы — это вещества, участвующие в химической реакции и изменяющие ее скорость или направление, но по окончании реакции остаю щиеся неизменными количественно и качественно. Биологические катализаторы белковой природы называются ферментами. Изменение скорости химической реакции или ее направления с помощью катализатора называ ют катализом. Катализаторы широко использу ют в различных отраслях промышленности и на транспорте (каталитические преобразователи, пре вращающие оксиды азота выхлопных газов авто мобиля в безвредный азот). Различают два вида катализа. Гомогенный катализ, при котором и катализа тор, и реагирующие вещества находятся в одном агрегатном состоянии. Гетерогенный катализ, при котором катализа тор и реагирующие вещества находятся в разных агрегатных состояниях (обычно, катализатор - в твердом, а реагенты – в жидком или газообразном). Например, разложение пероксида водорода в присутствии твердого катализатора оксида мар ганца (IV): Оксид марганца образует промежуточное соединение с перекисью водорода, которое разлагается на кислород и воду легче, чем сама перекись водорода. При этом также вновь образуется оксид марганца, поэтому по окончании реакции количество оксида марганца не изменяется. В случае использования ферментов катализ называют ферментативным ( изготовление вина и сыра, выпекание хлеба, варка пива и тп.) Известны другие интересные вещества — ин гибиторы (от лат. inhibere — задерживать). Они с высокой скоростью реагируют с активными ча стицами с образованием малоактивных соедине ний. В результате реакция резко замедляется и за тем прекращается. Ингибиторы часто специально добавляют в разные вещества, чтобы предотвратить нежелательные процессы (стабилизи руют растворы пероксида водорода). Роль катализа в экологии Огромную роль призван сыграть катализ в решении актуальнейшей проблемы - охраны окружающей среды. Человеку некуда сбрасывать отходы, кроме как в ту же среду, в которой мы живем. Это довольно грустная тема, но о ней стоит говорить, так как человек уже начинает ощущать отрицательные стороны своей бурной и во многом бесконтрольной деятельности. Химики - каталитики настойчиво работают над этой проблемой и уже добились некоторых результатов. Разработаны специальные устройства для дожигания выхлопных газов автомобилей, работающие на основе каталитического окисления вредных компонентов газов. Подобраны катализаторы и условия для обезвреживания отходящих газов химических производств. О них я подробней и расскажу. Как разнообразна деятельность человека, так и широк спектр токсичных газов, выбрасываемых при этом в атмосферу. Выбросы оксида азота осуществляется ТЭС, автотранспорт, предприятиями химической промышленности, аммиак - при производстве минеральных удобрений, сероводород — за счет газодобычи и нефтепереработки. А также диоксид углерода, закиси азота, метану и др. Каталитическая очистка токсичных соединений основана на протекании ряда химических реакций. Наибольшее промышленное распространение для очистки газов от оксидов азота в присутствии в отходящих газах кислорода имеет процесс их селективного восстановления аммиаком (см. рис. 1, реакция 1). Проблема очистки газов от сероводорода решается путем применения катализатора, позволяющего селективно окислять H2S до элементарной серы (см. 2). Очистку газов от аммиака проводят с помощью катализаторов, на которых образуется только молекулярный азот и не появляются оксиды азота (см. 3). * Наиболее разнообразными являются органические загрязнители. Их очистка основана на глубоком окислении загрязнителей до углекислого газа и паров воды (см. 4). Очистка газов от закисей азота осуществляется путем разложения закиси азота на азот и кислород (см. 5). Для удаления метана предлагается окислять его до С02 и Н20 (см. 6). Учитывая соотношение цен на выбросы метана и углекислого газа (см. табл. 2), это экономически вполне оправданно. Для очистки сточных вод от различных токсичных соединений разрабатывается метод, основанный на окислении загрязнителей в жидкой фазе на твердом катализаторе. Процесс проводят при давлении 20 — 30 атм. при температуре 200 — 250С. Вода при таких условиях остается жидкой. Например, такой метод позволяет очищать сточную воду от аммиака с эффективностью до 99%. Продуктами окисления являются только азот и вода. В качестве катализатора служит синтетический пористый углеродный материал. Особенно такой метод эффективен для очистки сточных вод, содержащих много различных загрязнителей. 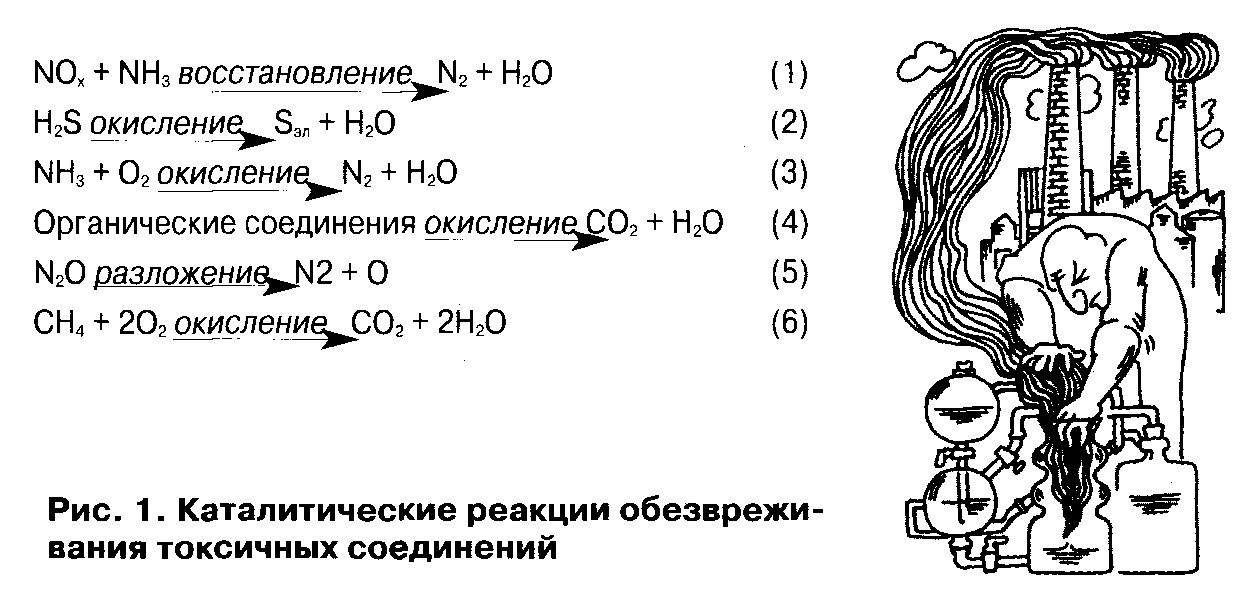 Применение катализаторов Применение катализаторов способствовало бурному развитию химической промышленности. Они широко используются при переработке нефти, получении различных продуктов, создании новых материалов (например, пластмасс), нередко более дешевых, чем применявшиеся прежде. Примерно 90% объема современного химического производства основано на каталитических процессах. Значение катализаторов и каталитических процессов в нефтепереработке и нефтехимии невозможно переоценить. Ведь именно они являются базой технического прогресса в важнейших областях обеспечения потребностей современного человеческого общества. Дело прежде всего в том, что нефть различных месторождений содержит обычно лишь от 5 до 20%соединений, соответствующих бензину. Потребность же в бензине при современном развитии автомобильного и авиационного транспорта огромна. Применение же современных каталитических методов переработки позволяет повысить выход соединений бензина до 75% от массы нефти. В качестве катализаторов применяют содержащие окиси Si и Al, а также катализаторы, содержащие, , Ni, и платиновый катализатор. В качестве катализаторов используют сульфид вольфрама, смешанные вольфрам никелевые суль-фидные катализаторы на носителях, кобальт-молибденовые катализаторы на оксиде алюминия, алюмосиликаты, окиси меди, марганца, добавки Ni, Pt, Pd, Со и других металлов на аморфных или кристаллических цеолитах. 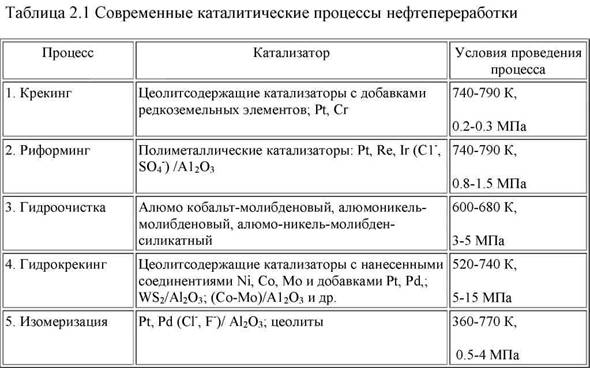 |
