химия важные материалы. 7_ДМ_В2_Химия_8_Расчеты по химическим уравнениям. Дидактический материал Расчёты по химическим уравнениям. Соотношение реагирующих веществ
 Скачать 29.49 Kb. Скачать 29.49 Kb.
|
|
Дидактический материал Расчёты по химическим уравнениям. Соотношение реагирующих веществ Химическими уравнениями называют условную запись химической реакции посредством химических знаков, формул и коэффициентов. Уравнение химической реакции показывает, какие вещества вступают в реакцию и какие образуются, а также соотношение количеств этих веществ. Иными словами, химическое уравнение – это способ выражения (передачи) качественной и количественной информации о химическом явлении. Запишем уравнение реакции в общем виде: aA + bB ® cC +dD, где А и В – исходные вещества, С и D – продукты реакции, a, b, c, d – стехиометрические коэффициенты. Стехиометрические коэффициенты подбирают на основе того, что число атомов каждого элемента до и после реакции остается неизменным. Это можно рассматривать как следствие закона сохранения массы. Рассмотрим информацию, содержащуюся в стехиометрических коэффициентах. Отношение стехиометрических коэффициентов равно: отношению числа частиц, вступивших в реакцию и образовавшихся в результате реакции a : b : c : d = N(A) : N(B) : N(C) : N(D) отношению молярных количеств веществ, вступивших в реакцию и образовавшихся в результате реакции a : b : c : d = n(A) : n(B) : n(C) : n(D) отношению объемов, вступивших в реакцию и образовавшихся в результате реакции газообразных веществ a : b : c : d = V(A) : V(B) : V(C) : V(D). Последнее отношение выполняется, если: это газообразные вещества, близкие по свойствам к идеальному газу, объемы этих газов измерены при одинаковом давлении и температуре. Несмотря на большое разнообразие задач данного типа, принцип решения их одинаков: по известному параметру (N, m, V) одного вещества рассчитывается неизвестный параметр X (Nx, mx, Vx) другого вещества. Такая задача является простейшей (базовой). Алгоритм решения базовой задачи (последовательность действий). Составляем уравнение химической реакции и выписываем мольные соотношения прореагировавших и получившихся веществ. По формулам, отображающим взаимосвязь физических величин, переводим заданную по условию величину в количество (n или ν) исходного вещества. По мольным отношениям рассчитываем n определяемого вещества (Х). По формулам, отображающим взаимосвязь физических величин, рассчитываем неизвестный параметр X. Графическая схема решения базовой задачи. 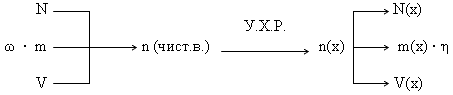 В качестве базовых рассмотрим решение следующих задач: Задача 1. Вычислите n, m, V углекислого газа, полученного при действии на 50 г карбоната кальция избытком раствора соляной кислоты. 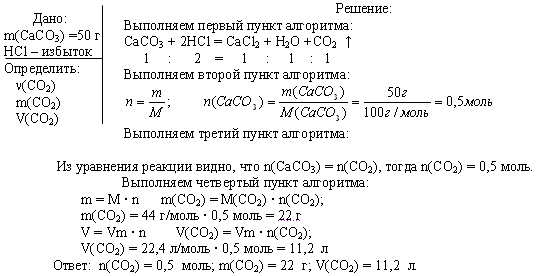 Задача 2. При взаимодействии цинка с избытком раствора соляной кислоты выделилось 1,12 л водорода (н.у.). Вычислите массы растворившегося цинка и образовавшейся соли. 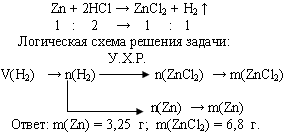 Задача 3. При взаимодействии с избытком соляной кислоты металла (валентность, которого во всех соединениях равна II) массой 12 г образовался водород объемом 6,72 л (н.у.). Определите, какой это металл. 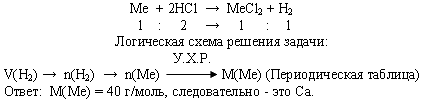 Используемая литература: Манкевич Н.В. Неорганическая химия. Весь школьный курс в таблицах. Минск,2010 Кузьменко Н.Е. Еремин В.В. Химия. 2400 задач для школьников и поступающих в вузы. М. Дрофа, 1999 |
