аналити. Семинарско-практическое занятие № 5. Дисперсные системы. Растворы Вставьте пропущенные в тексте слова
 Скачать 27.75 Kb. Скачать 27.75 Kb.
|
|
Дисперсные системы. Растворы 1. Вставьте пропущенные в тексте слова. Химические системы с точки зрения их однородности и состава подразделяются на чистые вещества и смеси. Чистые вещества бывают простыми и сложными. Смеси бывают гомогенными и гетерогенными . Если смесь веществ однородна, между различными ее компонентами нет границы раздела, она называется гомогенной. Раствор – это гомогенная система, состоящая из растворителя, частиц растворенного вещества и продуктов их взаимодействия. Смесь, состоящая из веществ, которые не растворяются друг в друге, называется Нерастворимые .Дисперсная система – это гетерогенная система, в которой одно вещество в виде очень мелких частиц равномерно распределено в объеме другого. 2. Выделите (подчеркните) верное. Чистые вещества встречаются редко / часто. Абсолютно чистые вещества в природе существуют / не существуют. 3. Выполните задания. А.Дайте определения понятиям. Дисперсная фаза – это, совокупность мелких однородных твёрдых частиц, капелек жидкости или пузырьков газа, равномерно распределённых в окружающей (дисперсионной) среде. Дисперсионная среда – это непрерывная фаза (тело), в объёме которой распределена другая (дисперсная) фаза в виде мелких твёрдых частиц, капелек жидкости или пузырьков газа. Дисперсионная среда может быть твёрдой, жидкой или газовой; в совокупности с дисперсной фазой она образует дисперсные системы. Б. Ознакомьтесь с информацией,ответьте на поставленный вопрос и сделайте вывод. Дисперсная фаза и дисперсионная среда могут находиться в различных агрегатных состояниях. То есть существуют различные типы дисперсных систем. Также дисперсные системы классифицируют по величине частиц дисперсной фазы. Различают: 1. Истинные растворы – размеры частиц менее 1 нм. 2. Тонкодисперсные системы (коллоидные системы) – размеры частиц от 1 до 100 нм (гели, золи). Фаза и среда отстаиванием разделяются с трудом. 3. Грубодисперсные системы – размеры частиц более 100 нм (аэрозоли, суспензии, эмульсии). Фаза и среда легко разделяются отстаиванием. С химической точки зрения, какую систему представляет из себя организм? Сделайте вывод о том, какое значение имеют коллоидные системы для медицины и фармации.___ Растворы имеют чрезвычайно важное значение в жизни человека. Так, процессы усвоения пищи человеком и животными связаны с переводом питательных веществ в раствор. Растворами являются все важнейшие физиологические жидкости (кровь, лимфа и т.д.)._____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ ________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________ В. Подчеркните ряд, содержащий верный ответ. Свертывание крови наглядно демонстрирует: а) коагуляцию; б) седиментацию; в) синерезис; г) эффект Тиндаля. 4. Заполните недостающее в Таблице 1. Таблица 1 Типы дисперсных систем
5. Заполните недостающее в Таблице 2. Таблица 2 Типы растворов
6. Дайте развернутые ответы на вопросы. 1. Какие растворы называются разбавленными, а какие концентрированными? Разбавленные растворы – это растворы с относительно низким содержанием растворенного вещества. Концентрированные растворы – это растворы с относительно высоким содержанием растворенного вещества. Это деление очень условно, и не связано с делением раствора по насыщенности. Разбавленный раствор может быть насыщенным, а концентрированный раствор не всегда может оказаться насыщенным. 2. Как найти необходимый для нейтрализации объем раствора кислоты, если известны нормальности щелочи и кислоты и исходный объем раствора щелочи? Алгоритм расчета объема исходного раствора кислоты 1. Найти, сколько моль эквивалентов кислоты необходимо для приготовления заданного раствора по формуле: nэкв. (кислоты) = Vр-ра·СN , где: Vр-ра - объем раствора, в литрах, который надо приготовить; СN - нормальная концентрация заданного раствора. 2. Найти массу данного количества эквивалентов кислоты по формуле: m = nэкв.·МЭ , где: МЭ - молярная масса эквивалента кислоты. МЭ(HCl) = M/1 = 36.5 г/моль; МЭ(H2SO4) = M/2 = 49 г/моль. 3. Найти, в какой массе исходного раствора содержится нужная Вам масса кислоты: где: w - массовая доля кислоты в исходном растворе. 4. Найти объем исходного раствора по формуле: 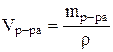 , ,где: r - плотность, определенная экспериментально с помощью ареометра. Определение точной концентрации кислоты методом титрования Определение концентрации раствора кислоты, основанное на реакции нейтрализации, выполняется следующим образом: 1. Чисто вымытую бюретку установите вертикально в зажиме штатива и ополосните ее несколькими миллилитрами того раствора кислоты, который будет затем наливаться в бюретку. 2. Налейте в бюретку приготовленный раствор кислоты и установите уровень жидкости на нулевом делении, считая по нижнему мениску, уберите воронку из бюретки. Следите, чтобы кончик бюретки был заполнен раствором и не содержал пузырьков воздуха. 3. Ополосните чистую пипетку раствором щелочи известной концентрации, отмерьте ею 10 мл раствора и вылейте его в коническую колбочку, прибавив туда 1-2 капли индикатора метилоранжа. 4. Поместите колбочку с раствором щелочи под бюретку и приливайте постепенно раствор кислоты из бюретки в колбочку до нейтрализации раствора щелочи, то есть до изменения цвета раствора от желтого до слаборозового. Прибавляйте раствор в колбу небольшими порциями при непрерывном перемешивании. Изменение окраски раствора должно произойти от прибавления одной лишней капли раствора кислоты. После этого отмерьте уровень жидкости в бюретке, считая по нижнему мениску. Титрование повторите 3 раза. Отклонение результатов отдельных титрований не должно превышать 0.2 мл (данные с большим отклонением в расчет не принимать). 7. Решите задачи. 1. Определите массовую долю соли в растворе, содержащем 100 г воды и 51,2 г соли.
2. Рассчитайте массовую долю соли в растворе, полученном при смешивании 300 г 5% и 200 г 15% растворов NaNO3.
3. Определите массу соли NaNO3, которая потребуется для приготовления 2 л 0,3 М раствора.
4. Определите массовую долю HNO3 в 1 л 3,6 М раствора HNO3 (ρр-ра HNO3=1,08 г/мл). |
