Дәріс 5 Апта 5-1. Дріс 5 катиондар мен аниондарды жіктелуі. Ккірттісутекті жіктелуі
 Скачать 165.7 Kb. Скачать 165.7 Kb.
|
|
ДӘРІС - 5 КАТИОНДАР МЕН АНИОНДАРДЫҢ ЖІКТЕЛУІ. Күкіртті-сутекті жіктелуі Күкіртті-сутекті жіктелу бойынша катиондар бес аналитикалық топқа бөлінеді: Бірінші аналитикалық топкатиондары Ag  , Hg , Hg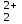 , Pb , Pb топтық реагентпен (сұйытылған тұз қышқылы HClерітіндісімен) суда нашар еритін ақ түсті тұнбалар түзеді. топтық реагентпен (сұйытылған тұз қышқылы HClерітіндісімен) суда нашар еритін ақ түсті тұнбалар түзеді.Қорғасын хлориді AgCl тұнбасы сұйылтылған қышқылдарда ерімейді (H2SO4, HNO  ), аммиак ерітіндісінде комплексті иондар түзу арқылы ериді. ), аммиак ерітіндісінде комплексті иондар түзу арқылы ериді.AgCl + 2NH 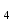 Cl Ag(NH Cl Ag(NH ) )  + Cl + Cl + H + H O OЕрітіндіден Ag  катионыкалий иодиді Kl ерітіндісімен анықталады, себебі I катионыкалий иодиді Kl ерітіндісімен анықталады, себебі I аниондары Ag аниондары Ag катиондарымен өте нашар еритін қосылыс түзеді (KSAgI=8,3 ‧ 10-17). катиондарымен өте нашар еритін қосылыс түзеді (KSAgI=8,3 ‧ 10-17).Ag(NH  ) )  комплекс ионының тұрақсыздық константасының мәні KH=5,8 ‧ 10-8. Сол себепті осы ерітіндіде Ag комплекс ионының тұрақсыздық константасының мәні KH=5,8 ‧ 10-8. Сол себепті осы ерітіндіде Ag иондарының концентрациясы AgI қосылысын түзуге жеткілікті болады. иондарының концентрациясы AgI қосылысын түзуге жеткілікті болады.Ag(NH  ) )  +I +I + 2 H + 2 H O AgI +2 NH O AgI +2 NH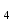 OH OHСынап (І) хлориді Hg  Cl Cl – ақ түсті тұнба, аммиак ерітіндісінде ерімейді, бірақ әрекеттеседі: – ақ түсті тұнба, аммиак ерітіндісінде ерімейді, бірақ әрекеттеседі:Hg  Cl Cl + 2NH + 2NH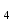 OH NH OH NH Hg Hg Cl+ NH Cl+ NH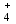 + Cl + Cl + 2H + 2H O ONH  Hg Hg Cl сынаптың комплексті қосылысы тұрақсыз, сондықтан ыдырайды: Cl сынаптың комплексті қосылысы тұрақсыз, сондықтан ыдырайды:NH  Hg Hg Cl NH Cl NH Hg Hg Cl+ Hg Cl+ HgҚорғасын хлориді PbCl  ақ түсті тұнба, Тұз қышқылы HCl, натрий хлориді NaCl ерітінділерінде,ыстық суда жақсы ериді. 200C –тағы ерігіштігі 10 г/л тең. Сондықтан тұз қышқылы HCl әсерінен Pb ақ түсті тұнба, Тұз қышқылы HCl, натрий хлориді NaCl ерітінділерінде,ыстық суда жақсы ериді. 200C –тағы ерігіштігі 10 г/л тең. Сондықтан тұз қышқылы HCl әсерінен Pb катиондары толық тұнбаға түспейді. катиондары толық тұнбаға түспейді.Екінші аналитикалық топқа Cu  , Cd , Cd , Hg , Hg , Bi , Bi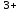 , As(III,V), Sb(III,V), Sn(II,IV) катиондары жатады. Топтық реагенті күкіртті сутекH2S, тұз қышқылы ерітіндісінде (рН 0,5). , As(III,V), Sb(III,V), Sn(II,IV) катиондары жатады. Топтық реагенті күкіртті сутекH2S, тұз қышқылы ерітіндісінде (рН 0,5).Екінші аналитикалық топ екі топқа бөлінеді: мыс топшасы (Cu  ,Cd ,Cd ,Hg2+, Bi ,Hg2+, Bi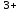 ) және аммиак (As(III, V), Sb(III, V), Sn(II,IV)) топшасы. Cu ) және аммиак (As(III, V), Sb(III, V), Sn(II,IV)) топшасы. Cu , Cd , Cd , Hg2+, Bi3+ катиондары қара түсті тұнба түзеді (CuS, HgS, Bi , Hg2+, Bi3+ катиондары қара түсті тұнба түзеді (CuS, HgS, Bi S S , Cd , Cd катиондары ашық сары түсті тұнба береді). катиондары ашық сары түсті тұнба береді).CuS, CdS, Bi  S S – сульфидтері сұйылтылған қышқылдарда ерімейді. – сульфидтері сұйылтылған қышқылдарда ерімейді.3CuS + 2NO  + 8H + 8H 3Cu 3Cu +3S+2NO+H +3S+2NO+H O OКадмий сульфиді CdS–концентрлі тұз қышқылы HCl ерітіндісінде комплексті ион түзу арқылы ериді. CdS + 4HCl CdCl 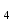  + H + H S + 2H S + 2H Сынап сульфиді HgS–өте нашар еритін сульфидтерге жатады (НРHgS=1,6‧10 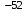 ), еріту үшін патша сұйығы қолданылады. ), еріту үшін патша сұйығы қолданылады.3HgS + 2HNO  +2HCl 3H +2HCl 3H CdCl CdCl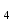 + 3S+2NO+4H + 3S+2NO+4H O OМышьяк топшасы сульфидтерінің ерекшелігі: натрий сульфиді, аммоний сульфидтерінде тиотұздар түзіледі: As  S S + 3Na + 3Na S 2Na S 2Na AsS AsS Мышьяк сульфиді As2S3аммоний карбонатында ериді, бұл жағдай оны қалайы және сурьма сульфидтерінен бөліп алуда қолданылады. As  S S + 3(NH + 3(NH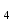 ) ) CO CO (NH (NH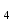 ) ) AsS AsS + (NH + (NH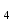 ) ) AsO AsO + 3CO + 3CO Қалайы, сурьма сульфидтері концентрлі тұз қышқылында HCl жақсы ериді, ал As2S  , As2S5тұз қышқылымен әрекеттеспейді. , As2S5тұз қышқылымен әрекеттеспейді.Үшінші аналитикалық топты: Fe2+, Fe 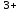 , Co , Co , Al , Al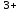 , Ni , Ni , Zn , Zn , Mn , Mn , Cr2+ катиондары құрайды. Топтық реагенті аммоний сульфиді аммиак буфер ерітіндісінде (рН=9). Топтық реагенттің әсерінен FeS, CoS, NiS, Fe , Cr2+ катиондары құрайды. Топтық реагенті аммоний сульфиді аммиак буфер ерітіндісінде (рН=9). Топтық реагенттің әсерінен FeS, CoS, NiS, Fe S S қара түсті тұнбалар түзеді: ZnS – ақ, MnS – ақшыл түсті тұнбалар. Fe қара түсті тұнбалар түзеді: ZnS – ақ, MnS – ақшыл түсті тұнбалар. Fe S S , FeS, ZnS, MnS сульфидтері сұйылтылған HCl, H2SO , FeS, ZnS, MnS сульфидтері сұйылтылған HCl, H2SO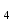 ерітінділерінде ериді. ерітінділерінде ериді.CoS пен NiS тотықтырғыштар қатысында немесе тотықтырғыш қышқылдарда ериді: NiS + 2H  + H + H O O Ni Ni + 2H + 2H O + S O + S3CoS + 8H  +2NO +2NO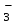 3Co 3Co + 3S + 2NO +4H + 3S + 2NO +4H O OAl 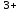 және Cr және Cr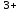 катиондары топтық реагенттің қатысында гидроксидтер түзеді: катиондары топтық реагенттің қатысында гидроксидтер түзеді:Al 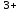 + 3S + 3S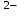 +3H +3H O Al(OH) O Al(OH) + 3HS + 3HS Төртінші аналитикалық топқа: Сa  , Ba , Ba , Sr , Sr катиондары жатады. Топтық реагенті аммоний карбонаты (NH4)2CO3 ерітіндісі, аммоний карбонаты гидролизденеді, сондықтан оның гидролизін баяулату үшін ерітіндіге аммоний гидроксидінNH4OH қосады, ал 5 аналитикалық топта орналасқан Mg катиондары жатады. Топтық реагенті аммоний карбонаты (NH4)2CO3 ерітіндісі, аммоний карбонаты гидролизденеді, сондықтан оның гидролизін баяулату үшін ерітіндіге аммоний гидроксидінNH4OH қосады, ал 5 аналитикалық топта орналасқан Mg бұл топпен ілесе тұнбаға түспеу үшін ерітіндіге аммоний хлориді NH бұл топпен ілесе тұнбаға түспеу үшін ерітіндіге аммоний хлориді NH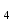 Cl ерітіндісін қосады, ерітіндінің рН=9,2. Аммоний карбонатындағы аммоний карбамидін NH2COONH Cl ерітіндісін қосады, ерітіндінің рН=9,2. Аммоний карбонатындағы аммоний карбамидін NH2COONH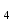 бұзу үшін ерітінді 70C дейін қыздырылады. Топтық реагентінің әсерінен ақ түсті карбонаттар тұнбаға түседі (CaCO бұзу үшін ерітінді 70C дейін қыздырылады. Топтық реагентінің әсерінен ақ түсті карбонаттар тұнбаға түседі (CaCO , BaCO , BaCO , SrCO3). , SrCO3).Бесінші аналитикалық топты Na  , K , K , NH , NH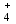 , Li , Li , Mg , Mg катиондары құрайды, бұл топ катиондарының топтық реагенті жоқ. Оларды ерітіндіден бөлшектеп анықтайды. Алдымен NH катиондары құрайды, бұл топ катиондарының топтық реагенті жоқ. Оларды ерітіндіден бөлшектеп анықтайды. Алдымен NH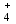 пен Li пен Li катиондары анықталады, содан соң Li катиондары анықталады, содан соң Li мен Mg мен Mg катиондары фосфаттар күйінде, ал NH катиондары фосфаттар күйінде, ал NH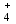 катионын қыздырып ұшыру арқылы бөліп алып, қалған ерітіндіден Na катионын қыздырып ұшыру арқылы бөліп алып, қалған ерітіндіден Na мен K мен K иондары анықталады. иондары анықталады.Кесте – 3. Катиондардың күкіртті – сутектік(сульфидті) жіктелуі
Аммиакты – фосфатты жіктелуі Аммиак – фосфатты жіктеу бойынша катиондарды бес аналитикалық топтарға бөледі. Бұл әдіс фосфаттардың суда, әлсіз және күшті қышқылдарда, сілтілерде және аммиак ерітінділерінде әр түрлі ерігіштігіне негізделген. Бірінші аналитикалық топқа Na  , K , K , NH , NH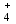 катиондары жатады, бұл топ катиондарының топтық реагенті жоқ. катиондары жатады, бұл топ катиондарының топтық реагенті жоқ.Екінші аналитикалық топты Li  , Сa2+, Ba , Сa2+, Ba , Mg2+, Fe2+, Fe3+, Al3+, Cr3+, Mn2+, Bi3+ катиондары құрайды, топтық реагенті (NH4)2HPO4 аммиак қатысында. Топтық реагентімен түрлі–түсті фосфаттар түзеді. Al3PO4, Ва3(РО4)2, Cr3(PO4)2, Ca , Mg2+, Fe2+, Fe3+, Al3+, Cr3+, Mn2+, Bi3+ катиондары құрайды, топтық реагенті (NH4)2HPO4 аммиак қатысында. Топтық реагентімен түрлі–түсті фосфаттар түзеді. Al3PO4, Ва3(РО4)2, Cr3(PO4)2, Ca (PO4)2, BiPO4, AlPO4– ақтүсті, FePO4 сары түсті, Fe3(PO4)2– ашық жасыл түсті, Cr3(PO4)2–жасыл түсті, Mg+, Mn (PO4)2, BiPO4, AlPO4– ақтүсті, FePO4 сары түсті, Fe3(PO4)2– ашық жасыл түсті, Cr3(PO4)2–жасыл түсті, Mg+, Mn қос тұздар (MnNH4PO2, MgNH4PO4) түзеді. Фосфаттардың сірке қышқылымен әрекеттесуіне байланысты екі топқа бөлінеді: қос тұздар (MnNH4PO2, MgNH4PO4) түзеді. Фосфаттардың сірке қышқылымен әрекеттесуіне байланысты екі топқа бөлінеді:Li+, Сa2+, Ba2+, Mg2+, Mn2+, Sr2+– бұлардың фосфаттары сірке қышқылында ериді. Fe2+, Fe3+, Al3+, Cr3+, Bi3+, Fe  (PO4)2 – тен басқасының фосфаттары сірке қышқылында ерімейді. (PO4)2 – тен басқасының фосфаттары сірке қышқылында ерімейді.Екінші аналитикалық топ катиондарының фосфаттары азот қышқылында ериді (BiPO 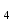 ерімейді). ерімейді).Үшінші аналитикалық топты Co2+, Zn2+, Cu2+, Cd2+, Hg2+, Ni2+ құрайды, топтық реагенті натрийдің гидрофосфаты Na2HPO 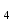 концентрлі ерітіндісі. Үшінші аналитикалық топ катиондарының фосфаттары концентрлі аммиак ерітіндісінде комплексті тұздар түзе ериді: Cu(NH3)42+, Cd(NH3)42+, [Hg(NH3)4]2+,Ni(NH3)62+, Co(NH3)62+, Zn(NH3)42+.Үшінші топ катиондарының фосфаттары сірке қышқылында СН3СООН да ериді. концентрлі ерітіндісі. Үшінші аналитикалық топ катиондарының фосфаттары концентрлі аммиак ерітіндісінде комплексті тұздар түзе ериді: Cu(NH3)42+, Cd(NH3)42+, [Hg(NH3)4]2+,Ni(NH3)62+, Co(NH3)62+, Zn(NH3)42+.Үшінші топ катиондарының фосфаттары сірке қышқылында СН3СООН да ериді.Төртінші аналитикалық топты As(III,V), Sb(III,V), Sn(II,IV) катиондары құрайды. Сурьма және қалайы катиондары азот қышқылы HNO3ерітіндісін қосып қыздырғанда суда нашар еритін H2SnO3 және HSbO3тұнбаларын түзеді. Мышьяк H3AsO 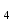 күйінде болады, бірақ H2SnO3 оны өз бетінде адсорбциялап, мына (H2SnO3) күйінде болады, бірақ H2SnO3 оны өз бетінде адсорбциялап, мына (H2SnO3)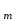 - (H - (H AsO AsO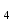 ) )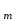 күйінде тұнбаға түсіреді. күйінде тұнбаға түсіреді.Бесінші аналитикалық топқа Pb2+, Ag+, Hg 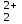 катиондары жатады, топтық реагенті тұз қышқылы HCl ерітіндісі, тұнбаға хлоридтер түседі. катиондары жатады, топтық реагенті тұз қышқылы HCl ерітіндісі, тұнбаға хлоридтер түседі.Кесте – 4. Катиондардың аммиакты - фосфатты жіктелуі
Катиондардың қышқылды - негіздік жіктелуі Қышқыл-негіздік жіктеуде гидроксидтер, хлоридтер, сульфаттар және металл аммиакаттарының әртүрлі ерігіштігі негізге алынады. Жүйелі талдау негізінен күрделі көп компонентті қоспаларда иондарды анықтау үшін қолданылады. Қышқылдық - негіздік жіктелу бойынша катиондар алты аналитикалық топқа бөлінеді. Бірінші аналитикалық топқа: Na  , K , K , NH , NH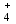 , Li , Li катиондары жатады. Бұл катиондардың топтық реагенті жоқ. Анализ барысында бөлшектеп анықталады. катиондары жатады. Бұл катиондардың топтық реагенті жоқ. Анализ барысында бөлшектеп анықталады.Екінші аналитикалық топқа: Ag+, Hg 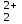 , Pb2+катиондары жатады, топтық реагенті 2н тұз қышқылы HCl ерітіндісі. Топ реагентінің әсерінен қышқылдарда ерімейтін, ақ түсті AgCl, Hg2Cl , Pb2+катиондары жатады, топтық реагенті 2н тұз қышқылы HCl ерітіндісі. Топ реагентінің әсерінен қышқылдарда ерімейтін, ақ түсті AgCl, Hg2Cl , PbCl2 тұнбалар түзіледі. , PbCl2 тұнбалар түзіледі.Үшінші аналитикалық топты: Сa2+,Ba2+,Sr  құрайды. Топтық реагенті сұйытылған күкірт қышқылы H2SO4. Топтық реагенттің әсерінен ақ кристалдық тұнбаларCaSO құрайды. Топтық реагенті сұйытылған күкірт қышқылы H2SO4. Топтық реагенттің әсерінен ақ кристалдық тұнбаларCaSO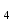 , BaSO , BaSO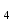 , SrSO , SrSO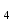 түзіледі. Арасындағы өте нашар еритіні BaSО4, ал CaSO4 және SrSO4 ерігіштігі жоғары, сондықтан оларды органикалық еріткіштер (спирт) қатысында тұндырады. Бұл топ сульфаттары қышқыл және сілті ерітінділерінде ерімейді, тек CaSO түзіледі. Арасындағы өте нашар еритіні BaSО4, ал CaSO4 және SrSO4 ерігіштігі жоғары, сондықтан оларды органикалық еріткіштер (спирт) қатысында тұндырады. Бұл топ сульфаттары қышқыл және сілті ерітінділерінде ерімейді, тек CaSO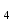 қана (NH4)2SO4 ерітіндісінде суда еритін комплексті тұз (NH4)2Ca(SO4)2 түзеді. қана (NH4)2SO4 ерітіндісінде суда еритін комплексті тұз (NH4)2Ca(SO4)2 түзеді.Төртінші аналитикалық топты Al3+, Cr3+, Zn2+, Sn(II,IV), As(III,V) катиондары құрайды. Бұл топ катиондары амфотерлі қасиет көрсетеді, сондықтан натрий гидроксидінің NaOH артық мөлшерінде еритін гироксидтер түзеді: Al(OH)3, Zn(OH)2, Sn(OH)2, H2Sn(OH)6. Сілтінің артық мөлшерінде еріп гидроксокомплекстер түзеді: NaAl(OH)4, NaCr(OH)4, Na2Zn(OH)4, ал мышьяк Na3AsO3 және Na3AsO4 күйінде болады. Сондықтан, натрий гидроксидінің NaOH артық мөлшері топтық реагент болып табылады. Бірақ жүйелік анализ барысында натрий гидроксиді NaOH ерітіндісімен қатар, сутегінің асқын тотығы Н2О2 қолданылады, бұл кезде ауыспалы валенттіліктері бар иондар тотығып, жоғары тотығу дәрежесіне ауысады: (AsO 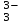 AsO AsO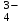 ; Sn ; Sn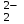 SnO SnO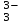 ; CrO ; CrO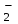 CrO CrO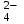 ). ).Бесінші аналитикалық топты Mg2+, Mn2+, Fe2+, Fe3+-, Bi3+, Sb(III,V) катиондары құрайды. Топтық реагенті натрий гидроксиді NaOH ерітіндісі, реакция нәтижесінде суда нашар еритін гидроксидтер түзеді:Mg(OH)2, Bi(OH)3, Mn(OH)2, Fe(OH)2,Fe(OH)3, Sb(OH)3,SbO(OH)3. Жүйелік анализде сутек пероксиді Н2О2 қолданылатындықтан, ауыспалы тотығу дәрежелері бар элементтердің жоғарғы тотығу дәрежесіндегі гидроксидтері түзіледі: MnО(OH)2, Fe(OH)3, SbO(OH)3. Алтыншы аналитикалық топты Cu2+, Cd2+, Hg2+, Co2+, Ni2+ катиондары құрайды. Топтық реагенті аммиак ерітіндісінің NH4OH артық мөлшері. Жүйелік анализ барысында түзілген гидроксидтер NH4OH ерітіндісінің артық мөлшерімен әрекеттесіп комплексті тұздар түзеді: Cu(NH3)42+, Cd(NH3)42+,[Hg(NH3)4]2+, Ni(NH3)62+, Co(NH3)62+. Кесте –5. Катиондардың қышқылды–негіздік жіктелуі
Аниондарды анықтаудың жалпыға бірдей қабылданған жіктеуі жоқ. Жекелеген аниондарды барий мен күміс тұздарының ерігіштігі және олардың сулы ерітінділерідегі тотығу қасиеттері ескеріліп жіктеледі. Кесте – 6. Барий мен күмістің нашар еритін тұздарының түзілуіне негізделген аниондардың жіктелуі
Иондарды анықтауда көптеген реакциялар әдетте сулы ерітіндіде (ылғал), сулы органикалық ортада және бір-бірімен араласпайтын екі еріткіштен құралатын жүйеде, құрғақ заттарды өзара араластырып ысқылау (құрғақ тәсіл) арқылы жүргізіледі. Аталған реакциялар келесі әдістермен жүзеге асырылады: тамшылату, микрокристаллоскопиялық әдістермен. Реакцияны сынауықтаорындау үшін: зерттелетін ерітіндіні капилярлы тамшуырмен алып сынауықтың қабырғасына тигізбей 2–3 рет тамшылатады. Реакцияның жүру жағдайын жасау үшін 2–3 тамшы реагент ерітіндісін қосып, реакцияның сыртқы өзгерісі бақыланады. Микрокристаллоскопиялық әдіс–нәтижесінде микроскоппен қаралатын, әрбір ионның өзіне тән пішінді кристалдар түзетін реакциялар көмегімен компонентті анықтауға негізділген. Реакцияны орындау үшін: зерттелетін ерітіндінің бір тамшысын таза, құрғақ заттық шыныға тамызады, жанына реагент ерітіндісін тамызып, шыны таяқшасымен екі ерітіндіні қосып араластырады. Микроскоппен түзілген кристалдардың пішінін бақылайды. Тамшылату реакцияны орындау үшін: фильтр қағазға бір тамшы реагент ерітіндісін тамызғанда, қағаз бетінде дөнгелек дақ пайда болады. Осы дөңгелек дақтың ортасына зерттелетін ерітіндінің бір тамшысын тамызып, пайда болған дақтың түсі бақыланады. Аналитикалық реакциялардың негізгі сипаттамасы–оның сезгіштігімен жинақтылығы (селективтілігі). Реакцияның сезгіштігі үш шамамен сипатталады: анықтау шегі немесе анықталатын (немесе ашылатын минимумі, табу шегі деп те атауға болады) минимумі, шекті концентрация немесе шекті көлем және шекті сұйытылған ерітіндінің минимальді көлемі. Ашылатын минимум- белгілі реакцияның көмегімен анықталатын ионның ең кіші мөлшері. Өлшем бірлігі -мкг (1мкг =10-6г). Минимальді концентрация ерітіндінің қандай сұйылу шегінде реакция әлі оң нәтиже көрсететінін анықтайды. Сапалық анализде анақталатын минимум 50 мкг-нан аспайтын, ал минимальді концентрация шамасы 1:1000 төмен болып келетін реакциялар қолданады. Көрсетілген шамалар төмен, ал сұйылу шегі көп болса, реакция соғұрлым сезімтал болады. Реакцияның сезгіштігікелесі факторларға тәуелді: реакцияның жүру ережелеріне, концентрацияға, температураға, уақытқа және т.б. Сапалық реакция тез әрі жылдам жүреді; тәжірибе кезінде реакция қайтымсыз болу керек; сыртқы өзгерістің болуы және реакцияның жоғары сезгіштігі және арнайылығымен ерекшеленеді. Сапалық реакцияларды орындағанда, олар жүру үшін белгілі жағдай жасалынады: ерітіндінің тиісті ортасы, рН-ы; анықталатын ионның конценртациясының жеткіліктілігі; тиісті температура және т.б. |
