P-элементы в химии. Р - элементы. Элементы iii a группы. Бор. Алюминий
 Скачать 78.82 Kb. Скачать 78.82 Kb.
|
|
Азот Свойства азота. Молекула азота двухатомна N2. Связь осуществляется тремя парами р-электронов (N:::N),а это предполагает наличие одной Ϭ- и двух π- связей. Энергия связи в молекуле равна 945 КДж/моль .Прочность молекулы азота определяет его химическую инертность при обычной температуре. По значению электроотрицательности азот занимает третье место после фтора и кислорода, поэтому только по отношению к этим элементам азот проявляет восстановительные свойства и в соединениях с ними его степень окисления положительна. При взаимодействии с галогенами (кроме фтора), водородом и металлами азот является окислителем и степень окисления его будет отрицательной. Химические свойства азота. а) с О2 .Образование NO из простых веществ при обычной температуре не происходит. Примерно с 12000 начинает заметно протекать обратимая реакция: N2 + O2 ↔ 2NO. Около 15000 равновесие этой реакции еще почти нацело смещено влево. При 20000 в равновесии со смесью азота и кислорода, соответствующей по составу атмосферному воздуху, находится 1,2об.% NO, а при 30000 – 5,3об.% NO. По этим причинам NO всегда образуется в атмосфере при грозовых разрядах. б) с Hal2 и S азот соединяется только при очень высоких температурах в) с Met азот взаимодействует только при сильном нагревании с образованием нитридов, например Mg3N2, и только с литием при обычных условиях: 6Li + N2 = 2Li3N. г) с Н2 азот реагирует с образованием аммиака: N2+ 3H2 ↔ 2NH3. Реакция протекает в присутствии катализатора (например, губчатое железо), при повышенном давлении (≈ 30МПа) и температуре (≈ 4500 -5000С). Свойства соединений азота Аммиак NH3. Степень окисления азота в аммиаке равна -3. Молекула аммиака имеет форму пирамиды с углом между связями HNH = 1070. Аммиак – газ, без цвета, с резким запахом, очень хорошо растворимый в воде (1 объем Н2О растворяет до 700 объемов NH3). Раствор аммиака в воде является слабым основанием Кд= 1,74*10-5. NH3 + H2O ↔ NH4OH ↔ NH4+ + OH- Для аммиака характерны два типа реакций: 1.NH3 – восстановитель (средней силы) за счет азота со степенью окисления +3: → NO + H2O (t0, кат. Pt) NH3 + O2 → N2 + H2О (t0) 2. NH3 – комплексообразователь: a) в кислых и водных растворах образуется ион аммония NH3 + H+ → [NH4]+ NH3(г) + HCl(г) = NH4Cl(тв) – хлорид аммония б) образование амминокомплексов: AgCl(тв) + 2NH3(р-р) = [Ag(NH3)2]Cl2(р-р) Соли аммония хорошо расворимы в воде, гидролизованы: NH4Cl + HOH ↔ NH4OH + HCl NH4+ + HOH ↔ NH4OH + H+ - среда кислая При нагревании соли аммония разлагаются. Кислородсодержащие соединения азота Оксиды.
2. Кислоты. Азотистая кислота HNO2 Степень окисления азота в азотистой кислоте - +3. Азотистая кислота существует только виде растворов, слабая кислота Кд = 5,1*10-4. Получить эту кислоту можно при добавлении к растворам ее солей сильных кислот 2KNO2 + H2SO4 = K2SO4 + HNO2 . Об образовании HNO2 судят по появлению голубого окрашивания раствора. Соли HNO2 - нитриты Met(NO2)n, в воде гидролизованы NO2- + HOH ↔ HNO2 + OH-.   Все соединения, содержащие азот в степени окислении +3, обладают и N0,N+2 N +5 восстановление N +3 окисление окислительными и восстановительными свойствами +3 +5 +2 В растворе HNO2 диспропорционирует : 2HNO2 = HNO3 + H2O + NO↑. В присутствии восстановителей N+3 проявляет окислительные свойства: 2HNO2 + 2HI = I2 + 2NO + 2H2О , а в присутствии окислителей – свойства восстановителя: 5NaNO2 + 2KMnO4 + 8H2SO4 = 5NaNO3 + K2SO4 + 2MnSO4 + 8H2O Азотная кислота HNO3 Степень окисления азота в азотной кислоте - +5. Сильная кислота. В любой концентрации – сильный окислитель. 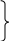 Взаимодействие с неметаллами: С → СО2 HNO3(конц.) + S → H2SO4 + H2O + NO2↑ P→ H3PO4 Взаимодействие с металлами: Al, Cr, Fe, Be → «пассивируются» HNO3(конц.) + Bi, Cu, Hg, Ag → соль + NO2↑ + Н2О 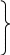 Cu, Pb, Ag → NO HNO3(разб.) + Mn, Fe → N2O + соль +Н2О Zn, Al, щелочн. → NH4NO3 и щелочно-земел.мет. Смесь 1 объема концентрированной HNO3 и 3 объемов концентрированной HCl – называется «царской водкой» - очень сильный окислитель, растворяет золото и платину 3Pt + 4HNO3(конц) + 12HCl(конц) = 3PtCl4 + 4NO +8H2O Соли азотной кислоты – нитраты- сильные окислители, при нагревании разлагаются с выделением кислорода 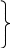 Met (доMg) → Met(NO2)n Met(NO3)n + t0 Met(Mg –Cu) → MetO +NO2↑ + O2↑ Met(после Cu) → Met +NO2↑ Фосфор Фосфор - элемент III периода. В отличие от азота участие в образовании химических связей у фосфора могут принимать 5 неспаренных электронов – три р- ,один из s-электронов внешнего уровня и один из s- электронов, который при возбуждении переходит на d-подуровень, таким образом валентность фосфора в соединениях может быть равна 5. Фосфор образует соединения типа – PCl 5 ,а азот – нет. Наиболее устойчивая степень фосфора в соединениях - +5. Основные химические свойства фосфора: Простое вещество – фосфор существует в виде нескольких аллотропических модификаций: фосфор – белый, красный, черный и т.д. Самая устойчивая модификация – черный фосфор. Самый реакционноспособный – белый фосфор, его кристаллы состоят из четырех атомов Р4. Белый фосфор – ЯД! Взаимодействие с простыми веществами: а) с О2 .Белый фосфор даже при небольшом трении воспламеняется на воздухе ( его хранят под водой ) и сгорает с выделением большого количества теплоты: 4Р + 3О2 = 2 Р2О3 (в недостатке кислорода ) , 4Р + 5О2 = 2Р2О5 ( в избытке кислорода ). б) с Hal2 взаимодействует труднее 2P + 5Cl2 = 2PCl5 в) с S при t0 >1000 образует соединения P4Sx, где х = от 3 до 10. г) с Met при нагревании образуются соединения называемые – фосфиды. Степень окисления фосфора в них равна -3, т.е. фосфор проявляет окислительные свойства 4P + 6Ca = 2Ca3P2 ( или Mg3P2). Взаимодействие со сложными веществами: а) отношение к воде и кислотам – неокислителям. С Н2О , HCl ,H2SO4(разбавл.) фосфор не взаимодействует. б) с кислотами–окислителями и сложными окислителями,например KMnO4, фосфор взаимодействует проявляя свойства восстановителя: 5HNO3 (конц.) + P = H3PO4 +5NO2↑ + H2O 2KMnO4 + 2P + 3H2SO4 = 2H3PO4 + K2SO4 +2MnSO4 в) при взаимодействии фосфора со щелочами происходит реакция диспропорционирования 0 +1 -3 4P + 3NaOH + 3H2O = 3NaH2PO2 + PH3↑ (NaH2PO2-гипофосфит натрия, РН3-фосфин). Свойства соединений фосфора Фосфин РН3– газ с запахом чеснока, менее устойчив, чем аммиак, ядовит. Сильный восстановитель. В отличие от NH3 мало растворим в воде, но присоединяет галогенводороды с образованием солей фосфония, например PH4F. Кислородсодержащие соединения фосфора. а) Оксиды: Р2О3 – оксид фосфора (III), фосфористый ангидрид. Р2О5 – оксид фосфора (V), фосфорный ангидрид. Оксиды имеют кислотный характер: Р2О3 + 3Н2О = 2Н3РО3 ( фосфористая кислота ); 2Р2О5 + 2Н2О = 4НРО3 ( метафосфорная кислота ); Р2О5 + 3Н2О(горячая) = 2Н3РО4( ортофосфорная кислота). б) Кислоты. Метафосфорная кислота НРО3 – в воде хорошо растворима, медленно взаимодействует с ней с образованием ортофосфорной кислоты Н3РО4 НРО3 + Н2О = Н3РО4 ( при нагревании реакция идет быстрее ). При дальнейшем нагревании Н3РО4 теряет воду, образуя пирофосфорную кислоту Н4Р2О7,которая при 4000 отщепляет воду, превращаясь снова в НРО3 2Н3РО4 = Н2О + Н4Р2О7 Н4Р2О7 = 2НРО3 + Н2О Ортофосфорная кислота Н3РО4 –– трехосновная кислота .По первой ступени диссоциации - кислота средней силы : Н3РО4 ↔ Н+ + Н2РО4-; Кд ≈ 7,5*10-3 По второй и третьей ступеням – слабая: Н2РО4- ↔ Н+ + НРО42-; Кд ≈ 6*10-8 НРО42- ↔ Н+ + РО43-; Кд ≈2*10-13. в) Соли Н3РО4 в растворе гидролизованы: К3РО4 + НОН ↔ К2НРО4 + КОН РО43- + НОН ↔ НРО42- + ОН- (среда щелочная ). Элементы VI A группы. Кислород. Сера. VI A группа состоит из типичных неметаллов – кислорода , серы и их аналогов – селена, теллура. Сверху вниз по группе радиус атомов возрастает, неметаллические свойства элементов убывают, соответственно восстановительные свойства увеличиваются, а окислительные ослабевают. Последний элемент в группе – полоний является металлом. Элементы этой подгруппы относятся к р- элементам. На внешнем уровне у них 6 электронов ns2np4. За исключением кислорода у всех остальных элементов во внешнем уровне имеются вакантные d-орбитали, поэтому участие в образовании связей могут принимать не только 2 неспаренных р- электрона. В возбуждённом состоянии число неспаренных электронов возрастает до 4 и до 6. Степень окисления кислорода во всех соединениях равна – 2, кроме фторида кислорода OF2 (степень окисления + 2). Остальные элементы имеют в соединениях степени окисления от -2 до +6. Кислород При обычных условиях кислород – газ, без цвета, без вкуса, без запаха, ограниченно растворим в воде. Кислород виде простого вещества имеет две аллотропические формы: кислород - О 2 и озон - О3. При обычных условиях более устойчив кислород, составляющий около 21% воздуха (по объему). Химические свойства кислорода. В химическом отношении при обычных условиях кислород довольно инертен, но при нагревании его химическая активность увеличивается. Кислород образует соединения со всеми элементами – оксиды Э2Оn, кроме He, Ar, Ne, но не со всеми (галогены, золото, платина) непосредственно соединяется, их оксиды получают косвенным путем. а) С большинством металлов О2 взаимодействует как при обычных условиях, так и при нагревании: 4Li + O2 = 2Li2O; 4Al + 3O2 = 2Al2O3; б) С неметаллами, как правило, О2 взаимодействует при нагревании: S + O2 = SO2 ( t0 = 2500); C + O2 = CO2 ( t0 = 7000-8000); N2 + O2 = 2NO ( t0 = 30000) в) При различных условиях кислород взаимодействует со сложными веществами : 2NO + O2 = 2NO2 (при обычной температуре); 4NH3 + 3O2 = 2N2 + 6H2O ( t0, катализатор). Во всех приведенных реакциях кислород является окислителем. Озон О3 образуется из кислорода при электрическом разряде под действием УФ излучения: 3О2(г) = 2О3(г) (t0 = 30000). Самопроизвольно эта реакция протекает только в обратном направлении. Растворимость О3 в воде в10 раз больше, чем кислорода. Озон – более сильный окислитель,он окисляет даже золото и платину. Реакция окисления раствора иодида калия озоном используется для обнаружения иона I- и озона: 2KI + O3 + H2O = I2 +2KOH + O2. Соединения кислорода с водородом: вода – Н2О (степень окисления кислорода -2 ) и пероксид водорода – Н2О2 ( степень окисления кислорода -1 ). Свойства воды можно разделить на две группы: 1) вода – полярный растворитель. 2) химические свойства: а) окислитель за счет Н+1 – 2Na + 2H2O = 2NaOH + H2↑; б) участие в реакциях присоединения с оксидами - Na2O + H2O = 2NaOH ; SO3 + H2O = H2SO4; в) участие в реакциях обмена (гидролиза): - галогенангидридов: PCl3 + 3H2O = H3PO3 + 3HCl; - солей: Na2CO3 + HOH ↔ NaHCO3 + NaOH ; CuSO4 + 2HOH ↔ (CuOH)2SO4 + H2SO4 Свойства пероксида водорода. Водный раствор Н2О2 является слабой кислотой Н2О2 ↔( НО2)- + Н+; Кд = 1,5*10-12. Степень окисления кислорода в молекуле Н2О2 равна -1. Для кислорода это промежуточная и малохарактерная степень окисления, поэтому и пероксид водорода и его производные неустойчивые соединения и легко разлагаются с образованием кислорода и соединений кислорода(-2) –реакция диспропорционирования: 2Н2О2 = О2 + 2Н2О ( быстрее реакция идет на свету ). В химических реакциях пероксид водорода, в зависимости от условий, может проявлять и окислительные 2О-1 -2е → О20(при взаимодействии с восстановителями ) и восстановительные 2О-1 + 2е → 2О-2(при взаимодействии с окислителями ) свойства. Н2О2 – восстановитель:5H2O2 + 2KMnO4 + 3H2SO4 = 5O2↑ + 2MnSO4 + K2SO4 + 8H2O. H2O2 – окислитель: H2O2 + 2KI + H2SO4 = I2↓ + K2SO4 + 2H2O. |
