Энтропия. Энтропия
 Скачать 114.5 Kb. Скачать 114.5 Kb.
|
|
www.testent.ru ЭНТРОПИЯ. Энтропия – это мера беспорядка. Р         1 а произвольный обратимый 1 а произвольный обратимый  Цикл Цикл  Разобьем его близкими адиабатами на Разобьем его близкими адиабатами на   d циклы Карно. d циклы Карно. 2 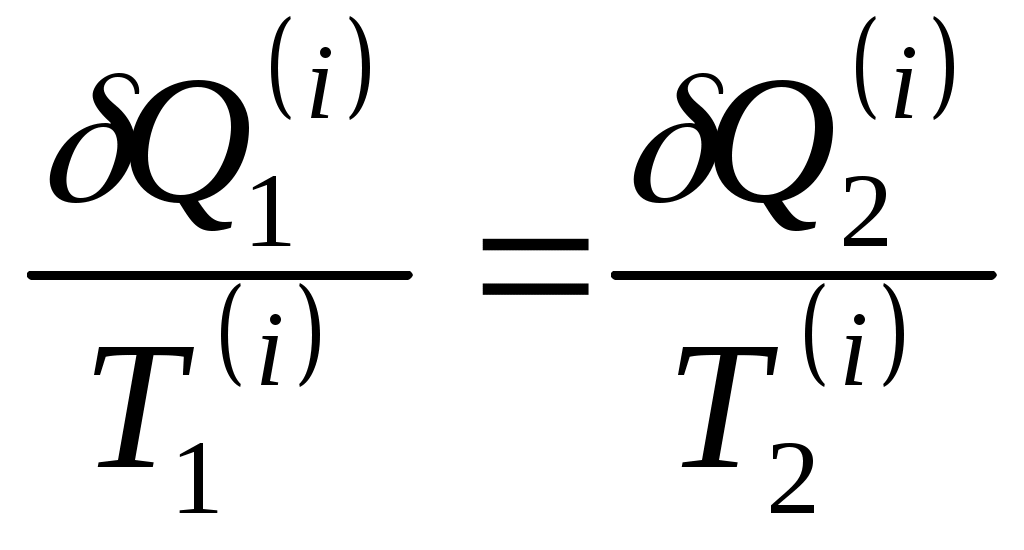 учитывая, что учитывая, что V мы переносим все влево: произвольный обратимый цикл 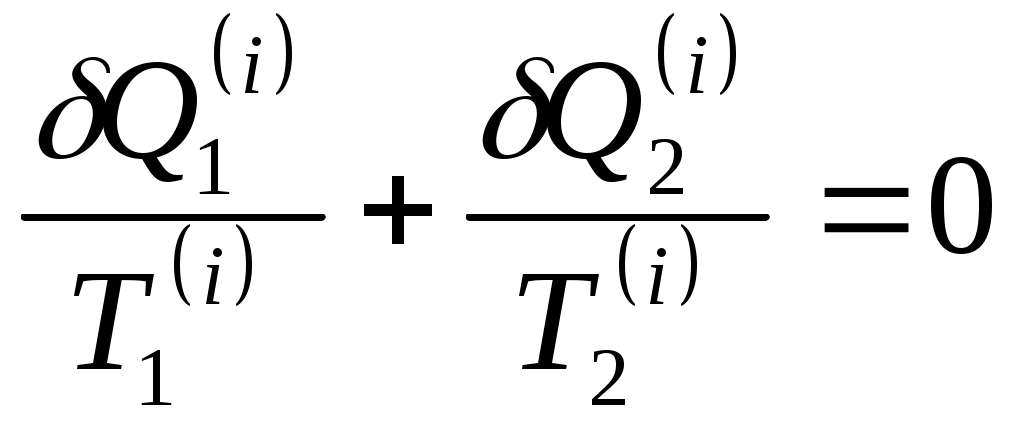 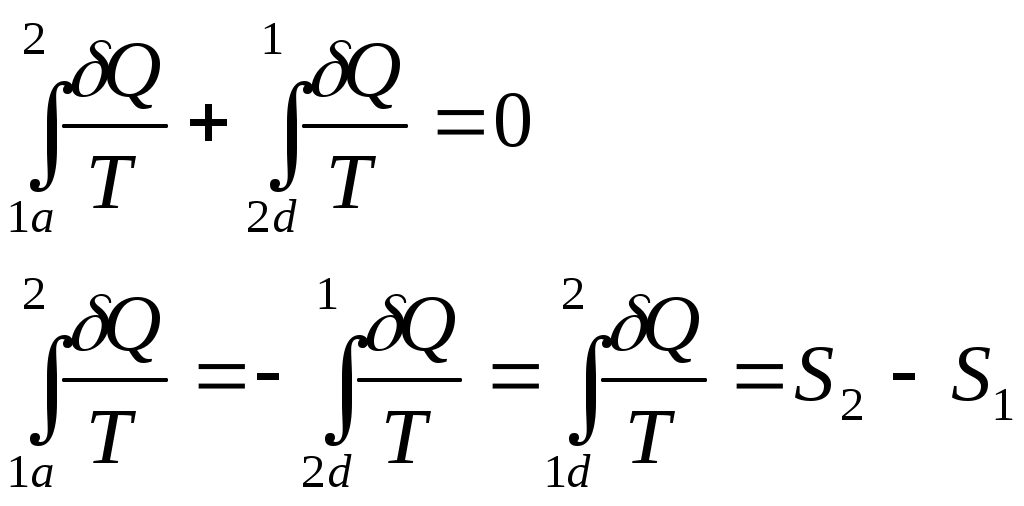 Интеграл не зависит от того, переводим мы систему из состояния 1 в состояние 2 по верхней ветке или по нижней. Интеграл S (энтропия) – однозначная функция состояния термодинамической системы. Изменение энтропии характеризует направление протекания процессa. Если система изолированная, т.е. Т       2 Цикл Карно   3 S Теперь рассмотрим необратимый процесс: Р     Дополним его обратимым процессом Дополним его обратимым процессома и разобьем близкими адиабатами 1 d 2 V Вторая формулировка второго начала термодинамики: все реально протекающие процессы в изолированной (замкнутой) системе идут с возрастанием энтропии. Все процессы идут до тех пор, пока энтропия достигнет максимума. Максимум энтропии – равновесное состояние системы. Задача 1: Есть 1 моль идеального газа, с ним происходят процессы. Как измениться энтропия? (об изоляции речь не идет) Решение: 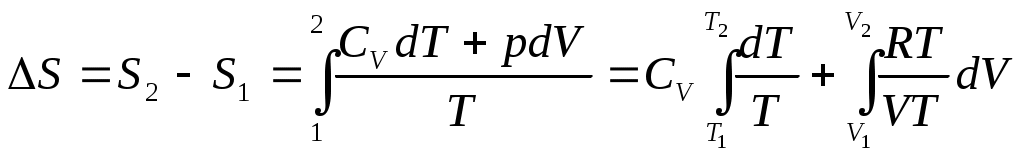 Если процесс изотермический, то останется только второе слагаемое, если изохорический - останется только первое слагаемое. Задача 2: Есть 2кг льда при температуре -10˚С. Как измениться энтропия, если этот лед превратить в пар при температуре 100˚С? Решение: Лед нагревали, он плавился, нагревали воду, происходило испарение. Нагревание льда: 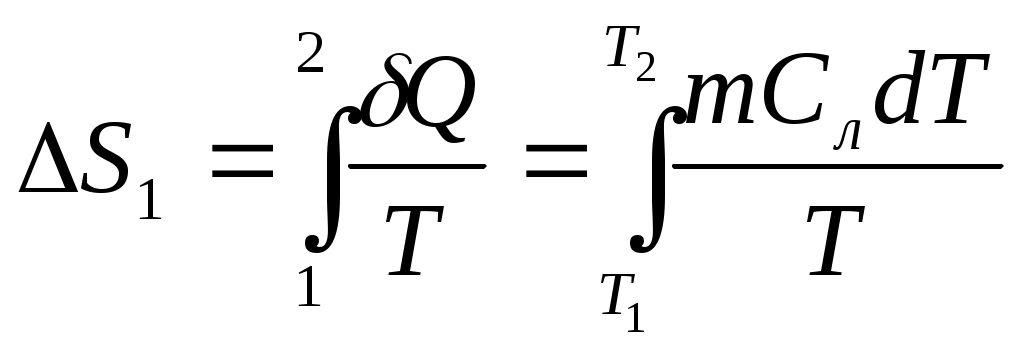 Плавление льда: Нагревание воды: 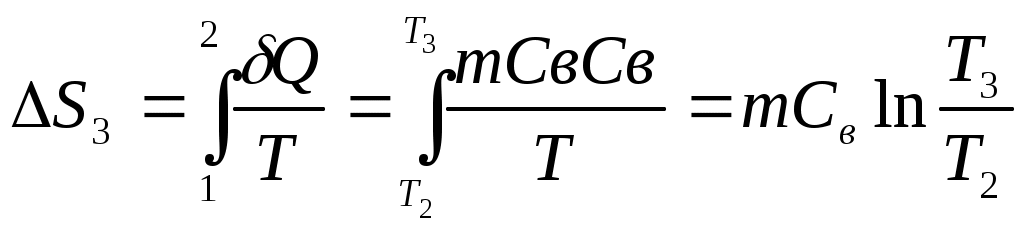 Испарение: Статистический смысл Второго начала термодинамики: (2) – определение энтропии с помощью статистики, т.е. чем разупорядоченнее система, тем больше энтропия, ведь энтропия мера беспорядка. 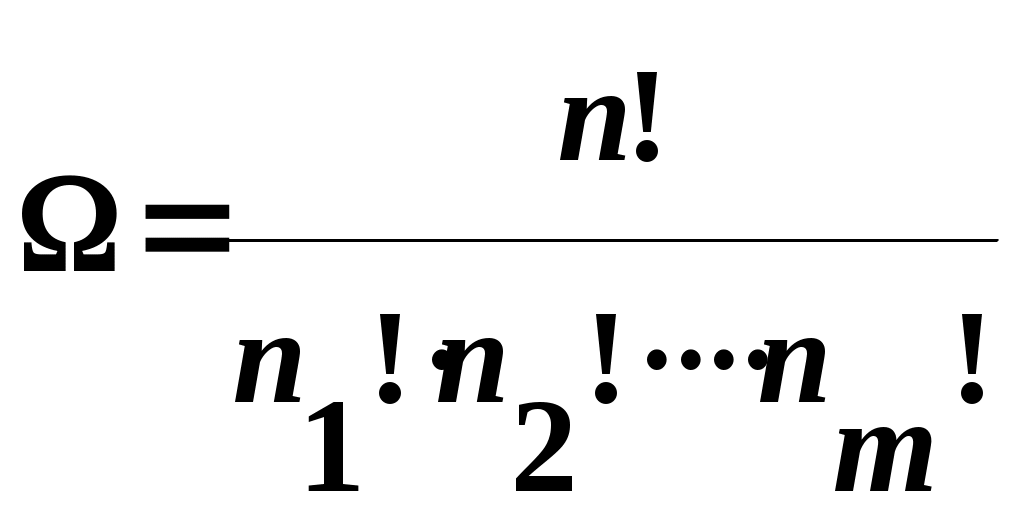 n – полное число частиц n – полное число частицni- число частиц, находящихся в i-ом состоянии.    - самое неупорядоченное состояние - самое неупорядоченное состояние    |
