экстракция. Это физ хим процесс распределения вва между двумя несмешивающимися фазами (обычно между водой и орг рлем)
 Скачать 204.79 Kb. Скачать 204.79 Kb.
|
|
Экстракция – это физ.-хим. процесс распределения в-ва между двумя несмешивающимися фазами (обычно между водой и орг. р-лем). Орг. в-во. отвечающее за экстрагирование в-ва называется – экстрагентом. Инертный орг. р-ль применяемый для улучшения экстракционных св-в экстрагента называется – разбавителем. Орг. фаза, отделяемая от водной и содержащая экстрагированное соед. называется – экстрактом. Условия экстракции в-ва Для перехода иона металла в орг. фазу необходимо нейтрализовать его заряд, связав его в незаряженный комплекс; Чем больше энергия сольватации и меньше энергия гидратации экстрагируемого соед., тем выше степень извлечения; Для полного экстрагирования соед. необходимо обеспечить его гидрофобность; С увеличением размера экстрагируемой молекулы увеличивается степень извлечения; Экстракция ионных ассоциатов уменьшается с увеличением заряда и уменьшением радиуса иона; Более устойчивые комплексы экстрагируются лучше. О К К С К Способы осуществления экстракции Периодическая экстракция Представляет собой экстракцию в-ва из вод. фазы отдельными порциями экстрагента. Ч 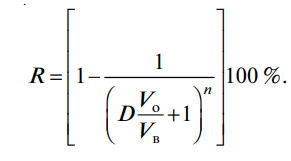 асто одной экстракции не хватает и тогда используют многократную экстракцию, и степень извлечения для n‑кратной экстракции рассчитывается по формуле: Эффективность многократной экстракции снижается с увеличением последующих экстракций. Периодическую экстракцию проводят в делительно воронке. Непрерывная экстракция Существует при непрерывном и относительном перемешивании двух фаз. Экстракция орг. соед. (жидкостно – жидкостная экстракция) В качестве экстрагентов, для извлечения орг. соед., используют различные орг. р-ли, но все они должны отвечать ряду требований: Извлечение должно быть с высоким коэф. распределения; Мало растворимы в воде; Имеют высокую температуру кипения; Плотность отличается от плотности анализируемого р-ра. Экстракция ионов металлов Экстракцию проводят после перевода заряженных частиц в незаряженные комплексы или ионные ассоциаты. Экстрагенты и разбавители О 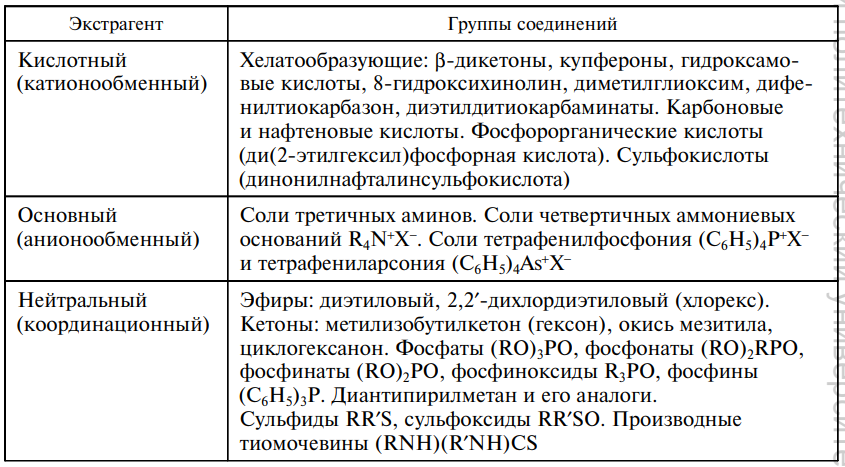 бычно все экстрагенты используют в виде их р-ров в орг. р-ле. С реди кислотных экстрагентов часто используют хелатообразующие реагенты. Э кстракция с основными экстрагентами протекает по механизму ионного обмена. Н ейтральные экстрагенты используют для экстракции незаряженных комплексов ионов металлов с лигандами галогенид-анионами. Экстрагируемые соединения Можно выделить два типа экстрагируемых соединений: неионизированные соед. и ионные ассоциаты. Координационно-несольватированные нейтральные соед. (HgCl2, AsCl3; RuO4, OsO4) К 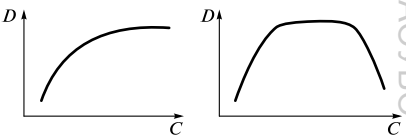 этой группе относятся соединения с преимущественно ковалентной связью, они в заметной степени не сольватируются и не гидратируются. Эти соед. экстрагируются р-лями различной природы, а инертными р-лями – избирательно. этой группе относятся соединения с преимущественно ковалентной связью, они в заметной степени не сольватируются и не гидратируются. Эти соед. экстрагируются р-лями различной природы, а инертными р-лями – избирательно. Вид кривой распределения КННС в зависимости от конц. к-ты определяется их способностью образовывать катионные или анионные комплексы с анионом этой кислоты. Внутрикомплексные соед. (8 – гидроксихинолинаты, дитизонаты, диэтилдитиокарбоминаты.) В большинстве случаев они представляют собой продукты взаимодействия катионов металлов с органическими реагентами, содержащими солеобразующие группировки атомов: -ОН, -СООН, =NОН и др. Незаряженные ВКС Для обеспечения экстракции ненасыщенных (гидратированных) ВКС необходимо вытеснить воду и блокировать ее молекулами орг. соед. (ТБФ - трибутилфосфат). В этом случает экстракция зависит от природы р-ля. Для экстракции насыщенных ВКС природа р-ля не столь важна. (хлороформ) Заряженные ВКС Катионные ВКС можно экстрагировать при введении крупных гидрофобных анионов (нафталинсульфонат, тетрафенилборат) Анионные ВКС можно экстрагировать при введении крупных гидрофобных катионов (тетрафениларсоний, тетрафенилфосфоний) Координационно – сольватированные нейтральные комплексы (Zr(NO3)4(ТБФ)2, ScCl3(ТБФ)3) Во внутреннюю координационную сферу иона металла такого комплекса обычно входит неорганический лиганд (Сl-, Br-, NO3-) и экстрагент (например ТБФ – трибутилфосфат). При экстракции подобных комплексов необходимо присутствие нейтральных экстрагентов имеющих электродонорные атомы, например атом азота, кислорода или серы. К таким экстрагентам относят нейтральные экстрагенты (спирты, кетоны, эфиры). Координационно – несольватированные ионные ассоциаты (соли) ((C6H5)4As]ClO4↓, [(C6H5)4P]MnO4↓) Это соединения крупных гидрофобных катионов (например, тетрафениларсоний, тетрафенилфосфоний) с анионами СlО4-, ReO4-, MnO4-, IO4- и другими крупными анионами, которые не сольватированы или почти не сольватированы. Комплексные кислоты (H2CdI4, HFeCl4) Можно сказать, что комплексные металлокислоты образуются в результате взаимодействия катиона металла с анионами галогеноводородных кислот. Экстрагируются лишь экстрагентами способными к протонированию в кислой среде. А также солями четвертичных амониевых оснований (диэтиловый эфир, метилизобутилкетон). Экстракция комплексных кислот определяется след. факторами: Чем меньше заряд аниона, тем слабее гидротация и лучше извлечение; Увеличение размера комплексного аниона улучшает экстракцию; |
