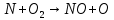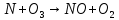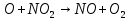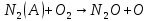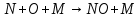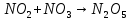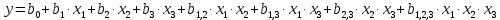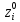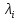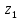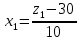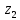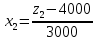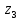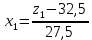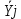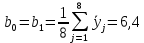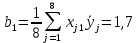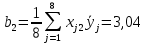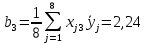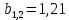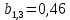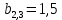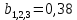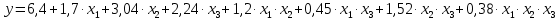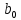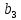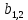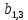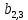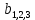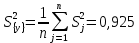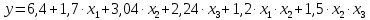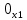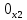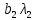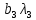НКР 18.03.21 (2). Федеральный научный агроинженерный центр вим
 Скачать 3.16 Mb. Скачать 3.16 Mb.
|
|
3.2.4 Приготовление градуировочного раствора для рН-метр/иономер ИТАН по методике РД 52.24.367-2010 Для определения HNO3 в воде применяют рН-метр/иономер. Его используют для определения водородного показателя (pH), а также анионов и катионов в воде полученных из различных источников (артезианских скважин, сточных, искусственных и природных вод и тд). Согласно ГОСТ 27987 данный прибор относят к анализаторам растворов потенциометрическим. Используется в научно – исследовательских лаборатория и центрах. РН-метр/иономер представляет устройство настольного исполнения, содержащий металлический корпус 1, в котором находится измерительный преобразователь, сенсорный дисплей 2, магнитная мешалка и держатель электродов рисунок 3.12. В нижнем правом углу имеется гнездо для установления стакана с анализируемым раствором.  1 – металлический корпус; 2 – дисплей с сенсорной панелью управления; 3 – держатель для электродов; 4 - гнездо для крепления стакана Рисунок 3.12 – рН-метр/иономер Для измерений выбирают методику анализа, а также, выполняют приготовление градуировочных растворов (растворов, необходимых для получения градуировочного графика). Для измерения 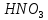 в воде была выбрана методика измерения нитратов в воде РД 52.24.367-2010 [51] рисунок 3.13. в воде была выбрана методика измерения нитратов в воде РД 52.24.367-2010 [51] рисунок 3.13. Рисунок 3.13 – Подготовка и выбор методики измерения Используя аттестованные растворы, содержащие молярную концентрацию нитрат - ионов от 1,00∙10-1; 1,00∙10-2; 8,00∙10-3 моль/дм3 изготавливают градуировочный раствор. Согласно руководящему документу РД 52.24.367-2010 приложению Б.5 процедура изготовления аттестованных растворов AP1-NO3 состоит в следующем. Для получения аттестованных растворов AP1-NO3 необходимо взвесить на лабораторных весах 2,527 г нитрата калия, подсушенным в сушильном шкафу в течение 1 часа соблюдая температуру 110°C. Затем его охлаждают в эксикаторе, поднося к хлориду кальция. Пересыпают в мерную колбу с объёмом 250 см3, добавляют дистиллированную воду и перемешивают до растворенного состояния. Переливают в банку темного стекла с пластиковой крышкой. Данному раствору приписывают молярную концентрацию 1,00∙10-1 моль/дм3. Чтобы получить растворов AP2-NO3, пипеткой необходимо отобрать 25,0 см3 раствора AP1-NO3 и перенести в колбу с объемом 250 см3. Доливают дистиллированную воду и перемешивают. Изготовленному раствору приписывают концентрацию молярную 1,00∙10-2 моль/дм3. Для приготовления AP3-NO3 отбирают пипеткой 20,0 см3 раствора AP1-NO3, переносят в колбу с объёмом 250 см3. Заливают в колбу дистиллированную воду и перемешивают. Данному раствору подписывают молярную концентрацию 8,00∙10-3 моль/дм3. После приготовления аттестованных растворов переходят к приготовлению градуировочного раствора. Для приготовления градуировочого раствора №1 с содержанием нитрат – ионов 5,00∙10-3 моль/дм3, пипеткой отбирают 5,00 см3 раствора (аттестованного) с концентрацией 1,00∙10-1. Погружают в мерную колбу, доливают дистиллированную воду и мешают. Раствор подписывают pNO3 c концентрацией 2,30. Градуировочный раствор №2 с концентрацией нитрат – ионов 1,00∙10-3, получают отбирая пипеткой 10,0 см3 раствора ( аттестованного) с нитрат – ионов 1,00∙10-2 моль/дм3. Все содержимое переносят в колбу доливают дистиллированную воду с объёмом 100см3. Раствор подписывают pNO3 c концентрацией 3,00. Для получения градуировочного раствора №3 с концентрацией 4,00∙10-4 моль/дм3, пипеткой отбирают 5,00 см3 аттестованного раствора с концентрацией 8,00∙10-3 моль/дм3. Переливают в колбу с объёмом 100 см3, добавляют дистиллированную воду и мешают. Раствор подписывают pNO3c концентрацией 3,40. Градуировочный раствор №4 с нитрат – ионов 1,00∙10-4 моль/дм3, пипеткой берут 10,0см3 раствора №2 (градуировочного) с концентрацией 1,00∙10-3 моль/дм3. Переносят в колбу, заливают дистиллированной водой с объёмом 100 см3 и перемешивают. Раствор подписывают pNO3 c величиной 4,00. Для получения градуировочного раствора №5 с концентрацией 4,00∙10-5 моль/дм3, пипеткой отбирают 10,0 см3 приготовленного градуировочного раствора №3. Перемешают в колбу, добавляют дистиллированную воду с объёмом 100 см3, затем размешивают получившийся раствор. Раствор подписывают pNO3 c концентрацией 4,40. Градуировочный раствор №6 с нитрат – ионов 1,00∙10-5 моль/дм3, пипеткой забирают 10,0 см3 раствора (градуировочного) №4 с нитрат – ионов 1,00 ∙10-4 моль/дм3. Перемещают в мерную колбу, добавляют 100 см3 дистиллированной воды и перемащивают. Градуировочный раствор №7 с концентраций 2,00 ∙10-6 моль/дм3, получают, если пипеткой взять 2 см3 раствора (градуировочного №4) с нитрат – ионов 1,00∙10-4 моль/дм3, и погрузить в колбу и залить дистиллированной водой с объёмом с 100 см3 и перемешать. После этого все градуировочные растворы по очереди устанавливают в гнездо для крепления стаканов и нажимают на дисплее «градуировка». В таблице 3.10 представлены данные градуировки. Таблица 3.10 – Данные для построения градуировочного раствора
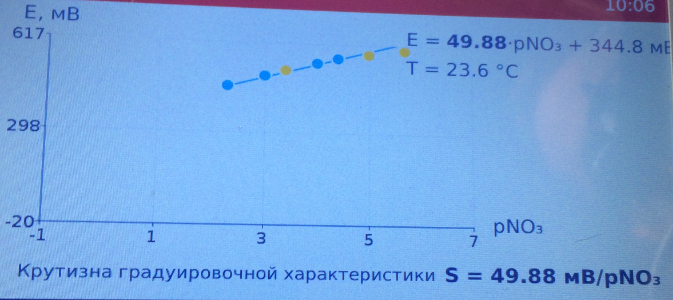 Рисунок 3.14 – Построение градуировочного графика После нажатия «далее» автоматически строится градуировочный график, показанный на рисунке 3.14. После построения градуировочного графика, можно проводить измерения по определению нитратов в воде. 3.2.5. Теоретическое объяснение возникновения нитратного азота в воде при электроискровом разряде Получение оксида азота возможно при взаимодействии свободных элементов кислорода с участием азота, при температурах от 1000 °C. Повышение температуры в разрядном канале и во всем диапазоне межэлектродного промежутка, увеличивает образование оксидов азота, потому что их реакция прямо пропорциональна температуре. Авторами [76], выдвигается теория образования оксида азота, всего рассматривается 4 реакции.
В зарубежной статье [3] изложен ещё один новый способ получения 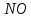
Когда 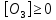 ,существует лишь реакция (46). При ,существует лишь реакция (46). При 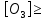 0,05% происходит реакция оксида азота (47). Реакцию (48) оценить очень тяжело т.к атомы кислорода 0,05% происходит реакция оксида азота (47). Реакцию (48) оценить очень тяжело т.к атомы кислорода 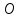 участвуют в синтезе озона участвуют в синтезе озона 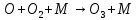 . Реакция (49) на данный момент полностью не изучена. Во всех изложенных вариантов выше, . Реакция (49) на данный момент полностью не изучена. Во всех изложенных вариантов выше, 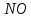 окисляется до двух и трехокисьного азота окисляется до двух и трехокисьного азота 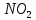 и и 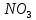 . Он же в свою очередь приводит к возникновению реакции кислотного оксида . Он же в свою очередь приводит к возникновению реакции кислотного оксида 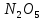
Оксидный азот в взаимодействии с 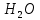 образует азотную кислоту образует азотную кислоту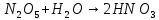 Измерение нитратного азота в воде после электроискровых разрядов Азотную кислоту в сельском хозяйстве используют при получении минеральных удобрений. Азотная кислота ключевой элементом для аммиачной, натриевой и калийной селитры. Хорошо растворяется в воде и усваивается растениями. Азотная кислота является компонентом для приготовления питательного раствора. Во время использования азотных удобрений необходимо придерживаться дозировок, ведь превышение дозы приводит к накоплению нитратов в продуктах. В эксперименте использовали воду двух образцов водопроводную и прудовую (полученную из Московской области г. Люберцы). Используя прибор ИТАН pH-метр/иономер, были проведены измерение нитратного азота после электрогидравлической обработки. На рисунке 3.15 построены зависимости по изменению содержания нитратного азота при напряжении от 20 кВ до 40 кВ, емкости 0,2 мкФ и индуктивности 15 нГн. 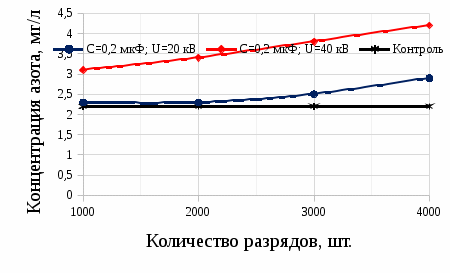 Рисунок 3.15 – Зависимость изменения концентрации азота в водопроводной воде На рисунке 3.16 изображена зависимость при аналогичных параметрах, но только для прудовой воды. 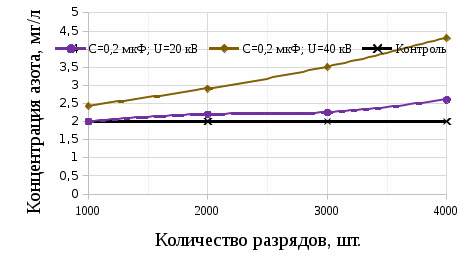 Рисунок 3.16 – Зависимость изменения концентрации азота воды из пруда Следующим этапом было изменение емкости и индуктивности, влияющий на выход нитратного азота. Емкость уменьшили до 0,05 мкФ и индуктивность до 4 нГн, на рисунке 3.17 и 3.18 построены зависимости. 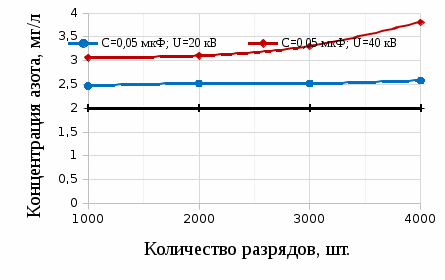 Рисунок 3.17 – Зависимость изменения концентрации азота в водопроводной воде На рисунке 3.17 видно, что азот незначительно повышается. Из рисунка 3.17 заметно, что при повышении напряжения до U =40 кВ, нитратный азот начинает резко возрастать, кривая при U=20 кВ остается параллельной линии контрольного образца. 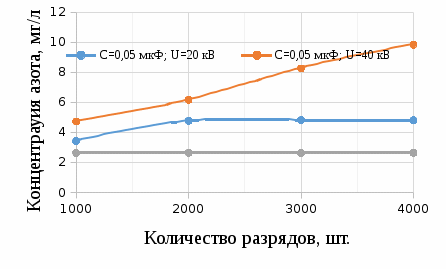 Рисунок 3.18 – Зависимость изменения концентрации азота в воде из пруда Анализ построенных зависимостей (рисунок 3.15–3.18) указывает, что на выход нитратного азота при электрогидравлическом ударе в воде оказывают влияние не только изменяемые параметры такие как: напряжение, количество импульсов, индуктивность в разрядном контуре. Снижая индуктивность при постоянных параметрах (напряжение, кол-во импульсов и энергию), можно увеличивать нитратный азот в обрабатываемой жидкости. Эксперимент позволил выявить основные факторы, влияющие на процесс и уровни их варьирования: 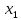 – амплитуда импульса 20-40 кВ, – амплитуда импульса 20-40 кВ,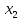 – кол-во импульсов 1000-7000 , – кол-во импульсов 1000-7000 ,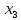 – энергия импульса от 5 до 60 Дж. На рисунке 3.19 изображена зависимость изменения концентрации нитратного азота в воде из пруда от основных факторов. – энергия импульса от 5 до 60 Дж. На рисунке 3.19 изображена зависимость изменения концентрации нитратного азота в воде из пруда от основных факторов.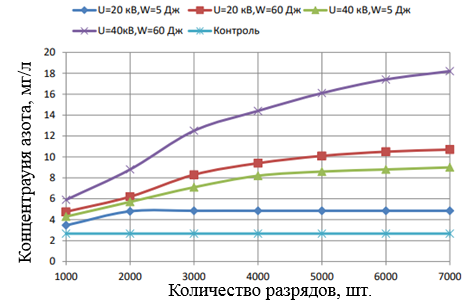 Рисунок 3.19 – Зависимость изменения концентрации азота в воде из пруда от напряжения, энергии, количества искровых разрядов при индуктивности 1,2 мкГн
x1, x2, x3 – факторы; b0 – свободный член не содержащий переменную, при хi= 0; b1, b2, b3 – коэффициенты регрессии, оказывающие влияние на тот или иной фактор;b1,2, b1,3, b2,3 – коэффициенты регрессии, вычисленные при умножении факторов, показывающее двойную взаимосвязь факторов; b1,2,3 – коэффициент регрессии с тройной взаимосвязью. Чтобы изучить влияние факторов 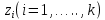 на величину на величину 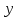 . Для этого нужно провести эксперимент по плану, чтобы определить все возможные комбинации. Число данных опытов будет находиться как . Для этого нужно провести эксперимент по плану, чтобы определить все возможные комбинации. Число данных опытов будет находиться как 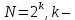 количество рассматриваемых факторов. Для этого воспользуемся ПФЭ количество рассматриваемых факторов. Для этого воспользуемся ПФЭ 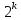 [80]. Для вычисления результатов по эксперименту и дальнейшего нахождения коэффициентов уравнений регрессии все факторы сводят к одному масштабу, путём кодирования. [80]. Для вычисления результатов по эксперименту и дальнейшего нахождения коэффициентов уравнений регрессии все факторы сводят к одному масштабу, путём кодирования.Покажем минимальный уровень 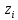 через через 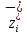 , максимальный уровень через , максимальный уровень через 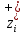 , тогда , тогда 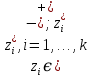 . Переменные . Переменные 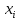 будут находиться через будут находиться через 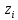 по формуле (54). Внесем факторы в таблицу 3.11. Согласно формуле (36) вычислим по формуле (54). Внесем факторы в таблицу 3.11. Согласно формуле (36) вычислим 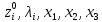 . После внесения факторов в таблицу 3.11 построим матрицу по планированию эксперимента для проведения эксперимента. . После внесения факторов в таблицу 3.11 построим матрицу по планированию эксперимента для проведения эксперимента.Таблица 3.11. Кодирование факторов
В качестве отклика взята концентрация нитратного азота в воде, которая была измерена при помощи рН-метр/иономер. Таблица 3.12. Матрица ПФЭ
Для вычисления коэффициента 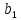 используется вектор-столбец используется вектор-столбец 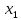 , а для , а для 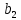 столбец столбец 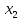 [64]. [64].
Используя формулу (37) произведём расчет коэффициентов 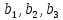
j – является номером фактора, где N – сумма (число) опытов, i = 1, 2, ..., k
С полученными коэффициентами составим уравнение
Запишем таблицу 3.13, в которую внесём найденные коэффициенты регрессии. Таблица 3.13 Вычисленные коэффициенты регрессии
Произведём расчет построчной дисперсии по формуле (41) 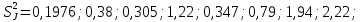 Осуществим вычисление дисперсии воспроизводимости:
Производится расчет среднего значения отклонения коэффициентов по таблице Стьюдента и числу степеней свобод, вычисляем 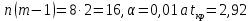 . . Отсюда 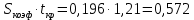 . Следует вывод, что коэффициенты . Следует вывод, что коэффициенты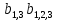 не значимы, запишем полученное уравнение не значимы, запишем полученное уравнение
Данное уравнение является математической моделью возникновения нитратного азота при ЭГ ударе. На концентрацию азота оказывают все факторы, такие как: напряжение, энергия и количество импульсов. Также влияют парные взаимодействия 1 и 2, 2 и 3 факторов. При проверке на адекватность, расчетные значения меньше табличных (при p=95%), что говорит об адекватности уравнения регрессии без парных взаимодействий. Для нахождения оптимума использовали метод крутого восхождения. Для описания заданного участка по поверхности отклика 3-х факторов был осуществлен ПФЭ с нулевым уровнем в точках 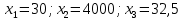 . Единицы варьирования . Единицы варьирования 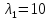 , , 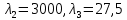 . Соответственно . Соответственно 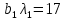 , , 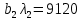 , , 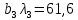 . Шаг варьирования возьмём значение 0,02от . Шаг варьирования возьмём значение 0,02от 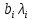 . План опыта по крутому восхождению представлен, указан в таблице 3.14. . План опыта по крутому восхождению представлен, указан в таблице 3.14.Таблица 3.14 План опыта крутого восхождения
Подменяя уровни факторов, находящиеся в кодированных переменных их реальными значениями, составим план опыта по крутому восхождению в реальных единицах, показанной в таблице 3.15. Таблица 3.15. Условия, найденные в реальных величинах
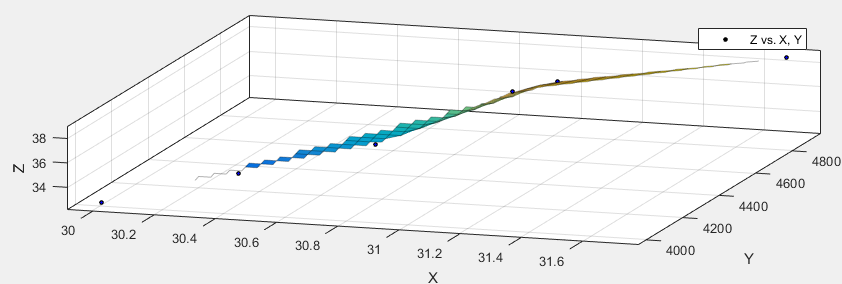 Рисунок 3.20 –Поверхность отклика Если проанализировать таблицу 3.15, то с 3 варианта изменений существенных не происходит. Можно считать, оптимумом является U=30,68 кВ, количество искровых разрядов 4364 шт, энергия импульса 34,96 Дж. Выводы по главе Для выполнения электрогидравлических технологий, при помощи программы Kompas-3D было смоделировано устройство, по которому изготовлен действующий образец. Новизна электрогидравлической установки состоит в электродах острие-полусфера. Отрицательный электрод выполнен в виде полусферы, в котором концентрируется электромагнитное поле. Созданная электрическая схема по управлению электрогидравлической установки поясняет состав элементов и последовательность подключения, это всё нужно для представления принципа работы установки. С помощью отсеивающего эксперимента по плану Плакетта-Бермана, были найдены значимые факторы, которые влияют на состав питательного раствора. К значимым факторам относится: напряжение, ёмкость, количество импульсов. В ходе проведения исследований было установлено, что микробиологическая загрязненность воды уменьшается, что подтверждено прибором люминометром EnSURE (Hygiena). Поэтому высоковольтная обработка может применяться в качестве водоподготовки при приготовлении питательного раствора. Во всех трёх образцах воды, было обнаружено увеличение электропроводности, которая была измерена с помощью прибора АТЛАНТ 1200. Увеличение электропроводности связано с образованием пузырьков и структурированием частиц. С целью энергоэффективности и безопасности рекомендуется использовать второй режим. Для измерения нитратного азота был построен градуировочный раствор, который подтверждает правильность измерений. Базируясь на зависимости 3.12-3.15 можно сделать вывод, что на количество выхода нитратного азота оказывает индуктивность. Уменьшая индуктивность можно варьировать нитратный азот в жидкостях. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||