Ферменты. Ферменты, их строение Классификация ферментов, их функция и применение Заключение
 Скачать 100.41 Kb. Скачать 100.41 Kb.
|
|
Содержаниие Введение…………………………………………………………………2 Ферменты, их строение……………………………………………….2-7 Классификация ферментов, их функция и применение………...7-10 Заключение……………………………………………………………...10 Список литературы…………………………………………………….11 Введение Как самостоятельная наука биохимия сформировалась примерно 100 лет назад, чему способствовало бурное развитие органической химии. Однако биохимические процессы люди использовали ещё в глубокой древности, не подозревая, разумеется, об их истинной сущности. В самые отдалённые времена уже была известна технология таких основанных на биохимических процессах производств, как хлебопечение, сыроварение, виноделие, выделка кож. Необходимость борьбы с болезнями заставляла задумываться о превращениях веществ в организме, искать объяснения целебным свойствам лекарственных растений. Использование растений в пищу, для изготовления красок и тканей также приводило к попыткам понять свойства веществ растительного происхождения. Древние мыслители рассуждали о том какую роль играют воздух и пища в жизнеобеспечении живых существ, о том что вызывает процесс брожения. Изучение химии жизни уже в 1827 г. привело к принятому до сих пор разделению биологических молекул на белки, жиры и углеводы. Автором этой классификации был английский химик и врач Уильям Праут. Новый толчок развитию биологической химии дали работы по изучению брожения, инициированные Луи Пастером. В 1897 г. Эдуард Бухнер доказал, что ферментация сахара может происходить в присутствии бесклеточного дрожжевого экстракта, и это процесс не столько биологический, сколько химический. На рубеже XIX и XX веков работал немецкий биохимик Э. Фишер. Он сформулировал основные положения пептидной теории строения белков, установил структуру и свойства почти всех входящих в их состав аминокислот. Но лишь в 1926 г. Джеймсу Самнеру удалось получить первый чистый фермент, уреазу, и доказать, что фермент — это белок. Целью данной работы является описать структуру и свойства ферментов как биологических полимеров, обозначить основные направления использования ферментов. Задачи данной работы: -Показать роль ферментов в жизни человека. -Определить сходства и различия ферментов с небелковыми катализаторами. Структура работы состоит из 2 глав, 5 рисунков, выводов и списка основной использованной литературы. Общий объем работы составляет 14 страниц. Ферменты, их строение Ферменты,илиэнзимы, – это биологические катализаторы, ускоряющие химические реакции. Общее число известных ферментов составляет несколько тысяч. Практически все химические реакции, протекающие в живых организмах, осуществляются при их участии. Ферменты ускоряют химические реакции в 108 – 1020 раз. Они играют решающую роль в важнейших биологических процессах: в обмене веществ, в мышечном сокращении, в обезвреживании чужеродных веществ, попавших в организм, в передаче сигнала, в транспорте веществ, свертывании крови и многих других. Для клетки ферменты абсолютно необходимы, без них клетка, а следовательно, и жизнь, не могли бы существовать. Слово фермент произошло от латинского fermentum – закваска, энзим в переводе с греческого означает «в дрожжах». Первые сведения о ферментах были получены еще в XIX веке, но только в начале XX века были сформулированы теории действия ферментов, и лишь в 1926 году Джеймс Самнер впервые получил очищенный фермент в кристаллическом виде – уреазу Уреаза катализирует гидролитическое расщепление мочевины: 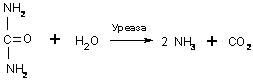 Рисунок 1. Гидролитическое расщепление мочевины Самнер обнаружил, что кристаллы уреазы состоят из белка. В 30-е гг. прошлого столетия Джон Нортон с коллегами получили в кристаллическом виде пищеварительные ферменты трипсин и пепсин, а также установили, что они, как и уреаза, по своей природе являются белками. В результате этих исследований сформировалась точка зрения о белковой природе ферментов, которая многократно впоследствии подтверждалась. И только значительно позже у некоторых РНК была обнаружена способность осуществлять катализ; такие РНК получили название рибозимов, или РНК-ферментов. Рибозимы составляют незначительную часть от всех ферментов, поэтому мы далее будем говорить о ферментах белках. Сходства и различия ферментов с небелковыми катализаторами Ферменты имеют ряд общих свойств с химическими небелковыми катализаторами: а) не расходуются в процессе катализа и не претерпевают необратимых изменений; b) ускоряют как прямую, так и обратную реакции, не смещая при этом химического равновесия; c) катализируют только те реакции, которые могут протекать и без них; d) повышают скорость химической реакции за счет снижения энергии активации (рис. 2). Химическая реакция протекает потому, что некоторая доля молекул исходных веществ обладает большей энергией по сравнению с другими молекулами, и этой энергии достаточно для достижения переходного состояния. Ферменты, как и химические катализаторы, снижают энергию активации, взаимодействуя с исходными молекулами, в связи с этим число молекул, способных достичь переходного состояния, возрастает, вследствие этого увеличивается и скорость ферментативной реакции. 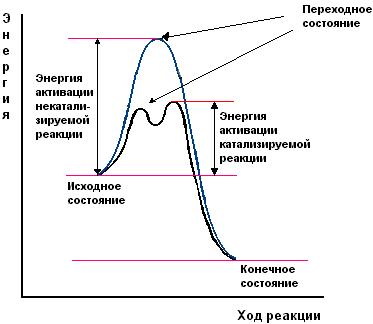 Рисунок 2. Влияние фермента на энергию активации Ферменты, несмотря на определенное сходство с небелковыми химическими катализаторами, отличаются от них по ряду параметров: a) ферменты обладают более высокой эффективностью действия, например, фермент каталаза, катализирующий реакцию: 2Н2О2 = 2Н2О + О2, ускоряет ее приблизительно в 1012 раз, эффективность же платины как катализатора этой реакции приблизительно в один миллион раз ниже; b) ферменты обладают более высокой специфичностью в сравнении с небелковыми катализаторами, они ускоряют более узкий круг химических реакций, например, уже упомянутый фермент уреаза катализирует только одну реакцию – гидролиз мочевины, протеазы способны расщеплять только белки, но не действуют на углеводы, липиды, нуклеиновые кислоты и другие вещества. С другой стороны, платина способна катализировать различные реакции (гидрирования, дегидрирования, окисления), она катализирует как реакцию получения аммиака из азота и водорода, так и гидрирование непредельных жирных кислот (эту реакцию используют для получения маргарина); c) ферменты эффективно действуют в мягких условиях: при температуре 0 – 40 оС, при атмосферном давлении, при значениях рН, близких к нейтральным, в более жестких условиях ферменты денатурируют и не проявляют своих каталитических качеств. Для эффективного химического катализа часто требуются жесткие условия – высокое давление, высокая температура и наличие кислот или щелочей. Например, синтез аммиака в присутствии катализаторов проводят при 500 – 550 оС и давлении 15 – 100 МПа; d) активность ферментов в сравнении с химическими катализаторами может более тонко регулироваться различными факторами. В клетке существует множество веществ как увеличивающих, так и снижающих скорости ферментативных реакций. Относительная молекулярная масса ферментов может колебаться от 104 до 106 и более. Ферменты – это, как правило, глобулярные белки. Одни ферменты являются простыми белками и состоят только из аминокислотных остатков (рибонуклеаза, пепсин, трипсин), активность других зависит от наличия в их составе дополнительных химических компонентов, так называемых кофакторов. В качестве кофакторов могут выступать ионы металлов Fe2+, Mn2+, Mg2+, Zn2+ или сложные органические вещества, которые называют также коферментами. В состав многих коферментов входят витамины. В качестве примера на рис. 3 приведена структура кофермента А (КоА). 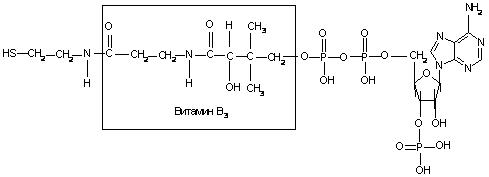 Рисунок 3. Структура кофермента А Если кофермент прочно связан с ферментом, то в этом случае он представляет простетическую группу сложного белка. Кофакторы могут выполнять следующие функции: a) участие в катализе; b) осуществление взаимодействия между субстратом и ферментом; c) стабилизация фермента. Каталитически активный комплекс фермент – кофактор называют холоферментом. Отделение кофактора от холофермента приводит к образованию неактивного апофермента: Холофермент В молекуле фермента присутствует активный центр. Активный центр – это область молекулы фермента, в которой происходит связывание субстрата и его превращение в продукт реакции. Размеры фермента, как правило, значительно превышают размеры их субстратов. Активный центр занимает лишь незначительную часть молекулы фермента (рис. 4). 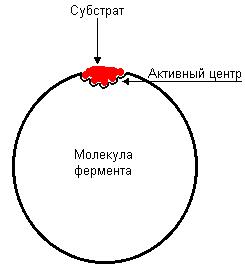 Рисунок 4. Относительные размеры молекулы фермента и субстрата Активный центр образуют аминокислотные остатки полипептидной цепи. В двухкомпонентных ферментах в состав активного центра может входить и небелковый компонент. В молекуле фермента присутствуют аминокислотные остатки, которые не участвуют в катализе и во взаимодействии с субстратом. Однако они весьма существенны, так как формируют определенную пространственную структуру фермента. Наиболее часто в составе активного центра содержатся полярные (серин, треонин, цистеин) и заряженные (лизин, гистидин, глутаминовая и аспарагиновая кислоты) аминокислотные остатки. Аминокислотные остатки, образующие активный центр, в полипептидной цепи находятся на значительном расстоянии и оказываются сближенными при формировании третичной структуры (рис. 5). 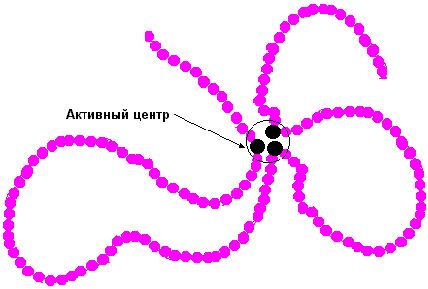 Рис. 5. Активный центр Например, в активный центр химотрипсина (пищеварительного фермента, расщепляющего белки) входят остатки гистидина – 57, аспарагиновой кислоты – 102, серина – 195 (цифрами указаны порядковые номера в полипептидной цепи). Несмотря на удаленность друг от друга этих аминокислотных остатков в полипептидной цепи, в пространстве они расположены рядом и формируют активный центр фермента. Некоторые ферменты синтезируются в неактивной форме в виде так называемых проферментов, которые затем под действием определенных факторов активируются. Например, пищеварительные ферменты химотрипсин и трипсин образуются в результате активации химотрипсиногена и трипсиногена. Классификация ферментов, их функция и применение 2.1 Классификация ферментов Часто названия ферментов образуются путем прибавления суффикса к названию субстрата, на который он воздействует. Например, названия фермента уреаза произошло от английского слова urea – мочевина, протеазы (ферменты, расщепляющие белки) – от слова протеин. Многие ферменты имеют тривиальные названия, не связанные с названием их субстратов, например, пепсин и трипсин. Существуют и систематические названия ферментов, включающие названия субстратов и отражающие характер катализируемой реакции. Общепринятая классификация делит все ферменты на шесть классов по типу катализируемой реакции: Оксидоредуктазы – участвуют в нескольких типах окислительно - восстановительных реакций, где переносят водород, электроны и катализируют биологическое окисление. (оксидаза, пероксидаза, дегидрогеназа). Трансферазы – переносят группы атомов, метильные, карбоксильные, амино, сульфо, формильные и фосфорильные группы. Гидролазы – участвуют в гидролитическом расщеплении. Представители этой группы носят названия в соответствии с типом разрываемой связи (пептидазы, гликозидазы, амилазы, эстеразы, липазы, фосфодиэстеразы, фосфатазы, уреаза). Лиазы – отщепляют группы (например: СО2, Н2О, NH3) от молекулы субстрата (катализируемое исходное вещество) не гидролитическим способом (декарбоксилаза, альдолаза, лиаза, дегидратаза, дезаминаза). Изомеразы – катализируют внутримолекулярное превращение изомеров (в том числе рацемилизацию, цистрансизомеризацию). Лигазы – участвуют в реакциях соединения: белковом синтезе, биосинтезе глутамина, активации аминокислот, синтезе жирных кислот. В свою очередь каждый класс подразделяют на подклассы, подклассы – на подподклассы. Ферментам, образующим подподклассы, присваивается порядковый номер. В итоге каждый фермент имеет свой четырехзначный номер. Например: фермент, катализирующий реакцию АТФ + D-глюкоза носит систематическое название АТФ: гексоза 6-фосфотрансфераза. 2.2 Функции ферментов В определенных частях каждой клетки находится около тысячи разных ферментов. Характерной особенностью всех ферментов является то, что каждый вид из них выполняет определенную функцию, которая присуща только ему одному. По выполняемым функциям ферменты в организме разделяют на группы: 1. Пищеварительные – расщепляют компоненты пищи на простые соединения, которые всасываются стенками кишечника, попадают в кровь и продолжают свой путь до клеток. Данные ферменты содержаться на всем протяжении пищеварительного тракта. Они обитают в слюне, кишечнике, секрете поджелудочной железы. 2. Метаболические – отвечают за обменные процессы, протекающие внутри клетки. Данные ферменты расположены внутри клетки упорядоченно. Они выполняют различные процессы, которые обеспечивают жизнедеятельность клетки. Такими процессами можно считать окислительно-восстановительные реакции, активизация аминокислот, перенос аминокислотных остатков и т.д. При разрушении клеточных мембран такие ферменты проникают в межклеточное пространство и кровь где продолжают развивать свою активность. Лабораторными методами при обнаружении их в анализах крови в зависимости от вида фермента можно установить диагноз, в каком органе происходят патологические изменения. 3. Защитные – ликвидируют воспалительные процессы подобно иммунным агентам. В организме человека каталитическая функция многих ферментов зависит от наличия определенных коферментов, витаминов, микроэлементов. Отсутствие данных веществ делает ферменты бессильными и в итоге постепенно может привести к патологическим изменениям. Большинство витаминов, а также микроэлементы и коферменты поступают в организм из вне (вместе с пищей). Хотя следует учесть и тот факт, что не вся еда может содержать в своем составе данные вещества. Чем выше температура приготовления пищи, тем сложнее организму использовать питательные вещества для синтеза ферментов, в такой еде также погибают витамины. По этой причине многие диетологи советуют не жарить, а варить или тушить продукты питания. 2.3 Области применения ферментов На сегодняшний день в различных отраслях хозяйства применение ферментов является передовым достижением. Особое значение ферменты нашли в пищевой промышленности. Ведь именно из-за наличия ферментов в тесте происходит его поднятие и разбухание. Как известно, разбухание теста происходит под действием углекислого газа CO2, который в свою очередь образуется в результате разложения крахмала под действием фермента амилазы, которая уже содержится в муке. Но в муке этого фермента не достаточно, его, обычно, добавляют. Ещё один фермент протеазы, придающий тесту клейковину, способствует удержанию углекислого газа в тесте. Изготовление алкогольных напитков также не обходится без участия ферментов. В этом случае широко применяются ферменты, которые находятся в дрожжах. Разнообразие сортов пива получают именно различными комбинациями комплексных соединений ферментов. Ферменты, также участвуют в растворении осадков в спиртных напитках, например, чтобы в пиве не появлялся осадок в него добавляют протеазы (папаин, пепсин), которые растворяют выпадающие в осадок белковые соединения. Производство кисломолочных продуктов, например, простокваши, основана на химическом превращении лактозы (то есть молочного сахара) в молочную кислоту. Кефир производят подобным образом, но производственной особенностью является то, что берут не только кисломолочные бактерии, но и дрожжи. В результате переработки лактозы образуется не только молочная кислоты, но ещё и этиловый спирт. При получении кефира происходит ещё одна достаточно полезная для организма человека реакция - это гидролиз белков, что в последствии употребления человеком кефира способствует его лучшему усвоению. Производство сыра тоже связано с ферментами. Молоко содержит белок - казеин, который в процессе химической реакции под действием протеаз изменяется, и в результате реакции выпадает в осадок. Протеазы широко используют для обработки кожевельного сырья. Его способность производить гидролиз белков (расщепление белков) широко применяют для выведения стойких пятен от шоколада, соусов, крови и т.д. Фермент целлюлаза - используется в стиральных порошках. Он способен удалять "катышки" с поверхности тканей. Важной особенностью стирки с порошками, содержащими целые комплексы ферментов, является то, что стирка в должна выполняться в тёплой, но не горячей воде, так как горячая вода для ферментов является губительной. Применение ферментов в медицине связано с их способностью заживлять раны, растворять образующиеся тромбы. Иногда ферменты умышленно вводят в организм для их активизации, а иногда из-за излишней активности ферментов, могут вводить вещества, которые действуют как ингибиторы (вещества, замедляющие протекание химических реакций). Например, под действием отдельных ингибиторов, бактерии теряют способность размножаться и расти. Применение ферментов в медицине также связано с проведением различных анализов по определению заболеваний. В этом случае ферменты играют роль веществ, вступающих в химическое взаимодействие или способствующие химическим превращениям в физиологических жидкостях организма. В результате получаются определённые продукты химических реакций, по которым в лабораториях распознают наличие того или иного возбудителя заболевания. Среди таких ферментов и их применения наиболее известен фермент глюкозооксидаза который позволяет определить наличие сахара в моче или крови человека. Кроме того, наравне с отмеченным, существуют ферменты, которые способны определять наличие алкоголя в крови. Этот фермент называется алкогольдегидрогеназа. Заключение Ферменты как биополимеры очень важны в жизни человека. Использование ферментов в медицине сводится к выпуску новых лекарственных средств, в составе которых вещества уже находятся в нужных количествах. Ученые еще не нашли способ стимулирования синтеза недостающих энзимов в организме, однако сегодня широко распространены препараты, которые могут на время восполнить их недостаток. Ферменты используются в виноделии, пивоварении, получении многих кисломолочных продуктов. Для получения спирта из глюкозы могут использоваться дрожжи, однако для удачного протекания этого процесса достаточно и экстракта из них. Спустя 100 лет после открытия этого класса веществ человечество узнало о ферментах очень много, но это не является точкой в исследованиях, т.к. технологии с каждым днём улучшаются, и, может быть, скоро мы узнаем что-то новое о ферментах. Список литературы Слесарев, В.И. Химия: Основы химии живого/ В.И. Слесарев.-СПб: Химиздат, 2007. – 784 с. Тюкавкина, Н.А. Биоорганическая химия/ Н.А Тюкавкина, Ю.И Бауков, С.Э. Зурабян.– М.: ДРОФА, 2014. Биохимия : учебник / под ред. Е. С. Северина. - 5-е изд., испр. и доп. - М. : ГЭОТАР-Медиа, 2014. - 768 с. : ил. http://www.studentlibrary.ru Интернет-ресурс http://ebooks.grsu.by - В.И. Резяпкин, В.Н. Бурдь «Основы биохимии» |
