Физическаяихимическая
 Скачать 39.54 Kb. Скачать 39.54 Kb.
|
6. АДСОРБЦИЯ Физическаяихимическаяадсорбция. Адсорбция – как явление сопровождает двухфазные многокомпонентные системы. Адсорбция – (ad – на, sorbeo – поглощаю, лат.). Абсорбция – (ab – в, " " " ). Адсорбция имеет место на границах раздела: газ – тв. тело, жидкость – тв. тело, жидкость – жидкость, газ – жидкость в отсутствии химического взаимодействия и растворения. Абсорбция наблюдается на границе раздела газ – жидкость и сопровождается растворением газа в объёме жидкости с или без химического взаимодействия. Теплота адсорбции G + TS всегда отрицательна, так как G и S отрицательны при самопроизвольной адсорбции. Все адсорбционные процессы экзотермичны. Адсорбция характеризуется величиной Гi = ni/S , т. е. числом частиц ,адсорбированных на единицу поверхности. Твёрдые адсорбенты обладают развитой поверхностью, величина которой составляет 1 – 2000 м2/г. Если поверхность адсорбента неизвестна, то количество поглощённого газа относят к 1 см3 или к 1гадсорбента. Зависимость Г = f(P) или Г = f(C) при постоянной температуре называется изотермой адсорбции. Различают два вида адсорбции – физическая и химическая адсорбция. Физическая адсорбция вызвана Ван – дер – ваальсовыми силами взаимодействия между молекулами адсорбата и адсорбента. Эти силы невелики и поэтому теплота физической адсорбции составляет 10 – 30 кДж/моль. Химическая адсорбция, или хемосорбция, обязана химической связи, возникающей между адсорбатом и адсорбентом. При этом образуются поверхностные соединения. Теплота хемосорбции составляет 100 – 400 кДж/моль, а сам процесс хемосорбции носит активационный характер. Молекулы адсорбата и адсорбента должны обладать энергией, которая превышает некоторое пороговое значение (энергия активации). Энергетические характеристики этих двух видов адсорбции и обуславливают их основные отличия(см таблицу 6.1.). Физическая адсорбция неспецифична и ряд по адсорбируемости сохраняется на любом адсорбенте. Он связан с силами взаимодействия. Чем выше взаимодействие молекул адсорбата друг с другом, тем выше их нормальная точка кипения Тнтк и тем больше величина Гi (см. таблицу 6.2).
Таблица 6.2. Объёмы газов, адсорбируемых на 1гактивированного угля при 15оС.
ИзотермаадсорбцииЛэнгмюра.Основной характеристикой адсорбции является зависимость равновесной Гi = f(P) при постоянной температуре. Рассмотрим систему газ – твёрдое тело при допущениях Лэнгмюра: Адсорбент – совокупность одинаковых адсорбционных центров, т. е. поверхность адсорбента однородна; Межмолекулярными взаимодействиями адсорбата на поверхности можно пренебречь; Каждый центр адсорбции взаимодействует только с одной молекулой адсорбата, причём молекулы адсорбата не перемещаются по поверхности. На поверхности может быть только один слой адсорбата с предельным заполнением Гм. Оценим его величину: 1см2=108108 (А0)2 = 1016(А0)2, Sмолек=110 (А0)2, тогда Гм=10151016частиц/см2. Для монослойной адсорбции удобно оперировать степенью заполнения θ, т.е. отношением адсорбции при данном Р к предельной адсорбции Гм: = Г/ГмЗапишем установление равновесия системы в виде следующего процесса: А(Г) + S AS.Условие равновесия для этой системы запишется в виде А + S = AS. (6.1) Выразим химические потенциалы компонентов: А А = 0 + RTlnP – для свободных молекул адсорбата; S S = 0 + RTln(1 ) – для свободных адсорбционных центров; AS AS = 0 + RTln для комплексов адсорбат – адсорбент. В этих уравнениях (1 ) выступает в качестве мольной доли свободных центров, а мольной доли занятых центров. Подставим значения химических потенциалов в (6.1) А S AS A адс 0 + RTlnP + 0 + RTln(1 ) = 0 + RTln, RTln Р(1) = 00 0 S + AS 0 = G адс = 0+ ТS0 адс, еР(1) S0 адс R H0 адс e RT в0 е Н0 адс RT в, где "в" – адсорбционный коэффициент, а по смыслу константа равновесия для процесса адсорбции Кадс. Поскольку давление Рможно измерить, а можно только вычислить, последнее уравнение разрешают относительно : =вР вР, откуда вР . (6.2) 1 вР Уравнение (6.2) носит название уравнения Лэнгмюра. Запишем уравнение (6.2) в другом виде, введя величину адсорбции. По определению = Г/Гми тогда Г Г вР . (6.3) м1 вР Из зависимости Г= f(Р) можно найти величины Гм и "в". Для этого перепишем (6.3) так: 1 1 Г ГмвР 1 , (6.3) Гм т. е. в координатах (1/Г– 1/Р) будет прямая линия, тангенс угла наклона которой равен 1/вГм, и отсекающая на оси ординат отрезок 1/Гм. Зависимость (6.3) изображена на рис. 6.1. Обработка экспериментальных результатов в этих координатах позволяет определить величину максимальной адсорбции Гми константу равновесия процесса адсорбции «в». С ростом температуры при постоянном Рвеличина "в" уменьшается, следовательно, и величина Гбудет уменьшаться. Изотерма Т2 Т1 пойдёт ниже, но будет стремиться к Гм, которое от Т не зависит (см. рис. 6.2). 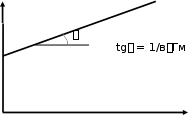 1 1Г 1 ГМ 1 P Рис. 6.1 Изотерма адсорбции.  Г ГГм Р Рис. 6.2. Влияние температуры на вид изотермы адсорбции. При малых давлениях Рвеличина вР 1, и (6.3) превращается в уравнение Г=ГмвР. (6.4) Уравнение (6.4) называется уравнением Генри. Величина К = вР – коэффициент Генри. Адсорбцияизсмесигазов.Над твёрдой поверхностью имеется смесь газов из i компонент. Обозначим iдолю поверхности S , занятой i – м компонентом, причём i=Гi/Гм. Согласно третьему предположению Лэнгмюра Гм одинаковы для всех газовых компонент, а "вi" – различны в основном за счёт различных теплот адсорбции. Для каждого компонента имеем i (1i)Pi вi Обозначим (1 – i) = 0 – доля свободной поверхности. Тогда i= 0Piвi, 0 = 1 – i= 1 – 0Piвi 0 = 1/1 + вiPi, и для доли поверхности, занятой i – м компонентом имеем i вiPi . 1 вiPi (6.5) Формула (6.5) описывает адсорбционную конкуренцию компонент за обладание центрами адсорбции. Величины вi могут отличаться в десятки и сотни тысяч раз. Предположим, что для двух газов адсорбционные коэффициенты отличаются в 105 раз. Тогда при равенстве в0 имеем На дс е RT Hадс e RT 105, H 2,3RT H 2,3RT 5, 2,38,313005 = 27 кДж/моль. Если теплоты адсорбции отличаются на 27 кДж/моль у двух газов, то их адсорбционные коэффициенты отличаются в 105 раз. На разнице адсорбционных коэффициентов и основана работа противогаза. Газов N2 и О2 в воздухе много, но их "вi" на угле мало, а СОCl2, Cl2 мало в воздухе, но их вi велико. Поэтому активный элемент противогаза адсорбирует хлорсодержащие газы. Если говорят, что газ адсорбируется слабо, это означает, что его адсорбционный коэффициент вi мал и величиной вiPi в знаменателе (6.5) можно пренебречь по сравнению с остальными членами. ПолимолекулярнаяадсорбцияУстановлено, что адсорбция паров вблизи линии насыщения не подчиняется закону Ленгмюра. При Т < Ткр с ростом давления (Р РS, где РS – давление насыщения) энергия межмолекулярного взаимодействия становится соизмеримой с теплотой адсорбции и процесс адсорбции газа может перейти в его конденсацию. В этом случае величина адсорбции Г (рис. 6.3). Изотермы адсорбции имеют такой вид в зависимости от энергии межмолекулярного взаимодействия М--М и энергии взаимодействия молекул пара с поверхностью адсорбента М--S:  Г ГР РS Рис. 6.3. Изотермы полимолекулярной адсорбции. 1 Полимолекулярная адсорбция при М—М < М—S; 2 Полимолекулярная адсорбция при М—М > М—S. В 1938 г. Брунауэр, Эмметт, Теллер опубликовали свою теорию, объясняющую такое поведение изотерм адсорбции. Основные допущения теории БЭТ сводятся к следующему: После установления равновесия при давлении Ри температуре Т доля поверхности адсорбента 0свободна, доля 1 занята мономолекулярным слоем, доля 2 покрыта бимолекулярным слоем и т. д. Равновесие между мономолекулярным слоем, а также верхними слоями полимолекулярных слоёв определяются уравнением Ленгмюра. Образование первого слоя сопровождается выделением теплоты адсорбции, а всех последующих – теплоты конденсации. С учётом этих предположений уравнение полимолекулярной адсорбции БЭТ запишется в таком виде: Г ГмвР . Р Р (6.6) 1Р1вР Р S S Величина Гм берётся для монослойной адсорбции. При Р РS величина Г . При малых давлениях, когда Р/РS 1 (6.6) переходит в изотерму Ленгмюра. Адсорбциянажидкихповерхностях.ИзотермаГиббса.Рассмотрим равновесие жидкой и газовой фаз двухкомпонентной системы при постоянных Р и Т. В растворителе содержится нелетучее вещество с объёмной концентрацией С. Раствор идеален. Предположим для определённости, что выход вещества на поверхность раздела фаз снижает свободную энергию системы. Тогда в равновесии концентрацию адсорбированного вещества на границе раздела фаз обозначим через Г [моль/м2]. Не нарушая равновесия, уменьшим концентрацию раствора на dC. Тогда химический потенциал данного вещества в растворе при расчёте на 1 моль уменьшится на величину RTdln CRTdC. CПоверхностная энергия увеличится на d,где - поверхностное натяжение в Дж/м2. Изменение поверхностной энергии в расчёте на 1 моль адсорбированного вещества составит d . ГУменьшение химического потенциала в объёме равно приросту поверхностной энергии, так как изменения в системе произошли в равновесных условиях при Р, Т = const. и S = const. Здесь S – величина поверхности границы раздела фаз. С учётом этого можно записать или (d )S,T Г RTdC, CГ C д (6.7) RT дС S,T Уравнение (6.7) называется уравнением изотермы адсорбции Гиббса. Оно позволяет определять адсорбцию Гна границе раздела жидкость – газ по зависимости (С). Для данного растворителя есть вещества, которые снижают поверхностное натяжение: д 0, дСтогда Г> 0. Граница раздела фаз обогащается растворённым веществом, и такие вещества называются поверхностно-активными(ПАВ). Вещества, для которых Г< 0, называются поверхностно-инактивными. д 0, и дСОтметим, что формула (6.7) справедлива только в той области концентраций растворённого вещества, когда можно принять коэффициент активности близким к единице. Для растворов не электролитов её можно применять до концентраций 0,1 моль/л, а для электролитов – до 0.01 моль/л. В области малых объёмных концентраций растворённого вещества, так же как и при малых давлениях газа, адсорбция идёт по закону Генри, т.е. Г= КС В этом случае уравнение адсорбции Гиббса примет вид KC C d , или RT dC C d K RTdC d K RT dC, 0 0 здесь 0 – значение при С= 0. Интегрируя, получим 0 KC RT Г RT. Обозначим понижение поверхностного натяжения 0 =,тогда ГRT. (6.8) Если вместо Гмоль/м2 ввести S– поверхность, приходящуюся на один моль адсорбированного вещества, т. е. вид S1 , Гто уравнение (6.8) примет S RT. (6.9) При малых концентрациях поведение адсорбированного слоя описывается уравнением, которое аналогично уравнению состояния идеального газа. |
