Шпоры по физике 1 курс. шпоры физика. Физика наука изучающая общие свойства и законы движения вещества и поля
 Скачать 381.57 Kb. Скачать 381.57 Kb.
|
Основной закон релятивистской динамики материальной точки:F=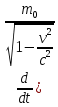 ) или F= ) или F= 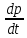 где p =mv = где p =mv = 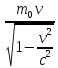 (релятивистский импульс мат.точки). (релятивистский импульс мат.точки). Пусть тело в системе отсчета K' обладает скоростью v', направленной по оси x' (и x): v= 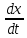 . В системе отсчета K скорость этого тела будет v= . В системе отсчета K скорость этого тела будет v=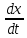 . Выясним каково соотношение между скоростями v' и v. Рассмотрим производную dt как отношение дифференциалов dx и dt , которые найдем, используя преобразования Лоренца: . Выясним каково соотношение между скоростями v' и v. Рассмотрим производную dt как отношение дифференциалов dx и dt , которые найдем, используя преобразования Лоренца:dx= 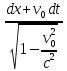 ; dt= ; dt=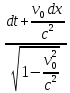 ; v = ; v =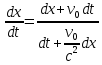 Разделим числитель и знаменатель правой части на dt' и получим: v = 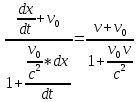 ; v= ; v=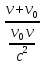 29 Релятивистская энергия-есть сумма собственной энергии частицы и релятивистской кинетической энергии . E= 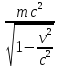 ; E = m ; E = m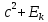 ; ;Энергия и масса- это две взаимосвязанные характеристики любого физического объекта. Энергия тела или системы равна массе, умноженной на квадрат скорости света: E= 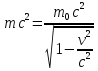 ; ;30 Молекулярная физика-это раздел физики изучающий макроскопические св-ва исходя из представлений об атомно-молекулярном строении в-ва и рассматривает теплоту как беспорядочное движение атомов и молекул. Термодинамика-раздел физики в котором изучаются общие св-ва макроскопических систем находящихся в состоянии термодинамического равновесия и процесса перехода между этими состояниями. Термодинамический метод- метод исследования систем, состоящих из большого числа частиц и оперирующий величинами, характеризующими всю систему в целом (например, объём, давление, температура), не рассматривая микроструктуры системы и проходящих в системе микропроцессов. Статистический метод - метод исследования систем из большого числа частиц, оперирующий статистическими закономерностями и средними значениями физических величин, характеризующих всю совокупность частиц, например, средние значения скоростей теплового движения молекул и их энергий. Термодинамические параметры, – это ряд физических величин, которые все вместе и каждая в отдельности могут дать характеристику наблюдаемой системе. К ним относятся такие понятия, как: температура и давление; концентрация, магнитная индукция; энтропия; энтальпия; энергии Гиббса и Гельмгольца и многие другие. 31 Идеа́льный газ — теоретическая модель, широко применяемая для описания свойств и поведения реальных газов при умеренных давлениях и температурах. Свойства: 1) собственный объем газа мал но сравнению с объемом сосуда. 2) между молекулами отсутствуют силы взаимодействия. 3) столкновения молекул происходит по закону абсолютной упругости. Уравнение состояния идеального газа: Закон Авогадро: В начале 19 века А. Авогадро предположил, что одинаковые объемы разных газов при одной температуре и давлении, содержат одинаковое число молекул. Закон Авогадро можно получить из молекулярно кинетической теории. Один моль любого газа при одинаковых условиях занимают одинаковые объемы. Для 1 моль: Закон Дальтона: полное давление газа равно сумме пропорциональных давлений: P=P1+P2=(m1/M1+m2/M2+…)*R*T/V 32 основное уравнение МКТ идеального газа. Выведено в предположении, что давление газа есть результат ударов его молекул о стенки сосуда. Давление идеального газа прямо пропорционально произведению массы молекулы, концентрации молекул и средней квадратичной скорости движения молекул. 33 Температура есть мера средней кинетической энергии молекул. В этом и состоит молекулярно-кинетический смысл температуры. В частности при температуре T=0К прекращается всякое тепловое движение молекул. Скорость хаотического (теплового) движения молекул характеризуется средней квадратичной скоростью: 34 Распределение Максвелла – в газе находящимся в состоянии теплового равновесия устанавливаются некоторые стационарные ( не изменяются со временем) распределения молекул по скоростям, которые вполне подчиняются определенному закону. Распределение Больцмана – исходя из основного уравнения молекулярно-кинетической теории P=nkT, заменим P и P0 в барометрической формуле на n и n0 и получим распределение молекул во внешнем потенциальном поле (распределение Больцмана): Барометрическая формула — зависимость давления или плотности газа от высоты в поле силы тяжести в стационарных условиях: 35 Внутренняя энергия идеального газа — в идеальных газах внутренняя энергия определяется как сумма кинетических энергий молекул. Между молекулами идеального газа отсутствуют силы притяжения и потенциальная энергия взаимодействия равна нулю. Это означает, что внутренняя энергия идеального газа рассматривается как сумма всех кинетических энергий молекул. Число степеней свободы: механической системы называется количество независимых величин, е помощью которых может быть задано положение системы. Одноатомный газ имеет три поступательные степени свободы і = 3, так как для описания положения такого газа в пространстве достаточно трёх координат (х, у, z). Л. Больцман установил закон равномерного распределения энергии молекул идеального газа по степеням свободы: на каждую степень свободы молекулы в среднем приходится одинаковая кинетическая энергия, равная kT/2. 36 Первое начало термодинамики. Количество теплоты, полученное системой, идет на изменение ее внутренней энергии и на совершение работы над внешними телами: Q=∆U+A В изобарном процессе A = pΔV = p (V2 – V1). В изотермическом процессе ΔU = 0, и A = Q; вся теплота, переданная телу, идет на работу над внешними телами. Графически работа равна площади под кривой процесса на плоскости p, V. 37 Теплоемкость тела — это физическая величина, определяемая отношением количества теплоты, поглощенной телом при нагревании, к изменению его температуры: Удельная теплоемкость — это способность разных веществ к поглощению теплоты при их нагревании. Молярная теплоемкость — это физическая величина, равная отношению количества теплоты, поглощенного веществом при нагревании или выделенного при охлаждении, к количеству молей нем и изменению температуры: Внутренняя энергия произвольного количества газа: Уравнение Майера: Ср = Сv + R Недостатки классической теории теплоёмкости. Не даёт объяснения зависимости С от Т. Непоследовательность: н-р двухатомная молекула и твёрдое тело (атом не точка!) i= 3+3 = 6, если атомы рассматривать как твёрдые тела, тоi= 12. Атомные системы представляются (моделируются) как макро системы с наложенными связями. Для металлов С = 3R, электронов газ. Его С не учитывается. Но по теории она должна была быть равной теплоёмкости решётки. Опыт –свободные электроны не вносят никакого вклада в теплоёмкость металлов. Опыт –эффективный вклад в теплоёмкость вносят не все, а только некоторые степени свободы. 38  39 1. Обратимым термодинамическим процессом называется термодинамический процесс, допускающий возможность возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Необходимым и достаточным условием обратимости термодинамического процесса является его равновесность. 2. Необратимым термодинамическим процессом называется термодинамический процесс, не допускающий возможности возвращения системы в первоначальное состояние без того, чтобы в окружающей среде остались какие-либо изменения. Все реальные процессы протекают с конечной скоростью. Они сопровождаются трением, диффузией и теплообменом при конечной разности между температурами системы и внешней среды. Следовательно, все они неравновесны и необратимы. 3. Всякий необратимый процесс в одном направлений (прямом) протекает самопроизвольно, а для осуществления его в обратном направлении так, чтобы система вернулась в первоначальное состояние, требуется компенсирующий процесс во внешних телах, в результате которого состояния этих тел .оказываются отличными от первоначальных Круговым процессом, или циклом, называется такой процесс, в результате которого термодинамическое тело возвращается в исходное состояние. Тепловой машиной называется периодический действующий двигатель, совершающий работу за счет получаемого извне тепла. Любая тепловая машина работает по принципу кругового (циклического) процесса, т.е. возвращается в исходное состояние (рис. 5.1). Но чтобы при этом была совершена полезная работа, возврат должен быть произведен с наименьшими затратами. Полезная работа равна разности работ расширения и сжатия, т.е. равна площади, ограниченной замкнутой кривой. Обязательными частями тепловой машины являются нагреватель (источник энергии), холодильник, рабочее тело (газ, пар). Схема теплового двигателя: От термостата с более высокой температурой Т1, называемого нагревателем, за цикл отнимается количество теплоты Q1, а термостату с более низкой температурой Т2, называемому холодильником, за цикл передается количество теплоты Q2 и совершается работа A: A=Q1-Q2 Обратный цикл используется в холодильных машинах – периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой. Системой за цикл поглощается при низкой температуре T2 количество теплоты Q2 и отдается при более высокой температуре Т1 количество теплоты Q1 за счет работы внешних сил А. Второе начало термодинамики: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает (закон возрастания энтропии). Второе начало термодинамики определяет направление протекания термодинамических процессов, указывая, какие процессы в природе возможны, а какие - нет. Существуют ещё две формулировки второго начала термодинамики: 1) по Кельвину: невозможен круговой процесс, единственным результатом которого является превращение теплоты, полученной от нагревателя, в эквивалентную ей работу; 2) по Клаузиусу: невозможен круговой процесс, единственным результатом которого является передача теплоты от менее нагретого тела к телу более нагретому. Третье начало термодинамики - теорема Нернста-Планка - постулирует поведение термодинамических систем при нуле Кельвина: энтропия всех тел в состоянии равновесия стремится к нулю по мере приближения температуры к нулю Кельвина: lim(T→0)S=0 Теплоемкости CV и Сp при Т= 0 К равны нулю, поскольку: dS=δQ/T; C=δQ/dT; S(p=const, T)=Cp(T)dT/T; S(V=const, T)=CV(T)dT/T. 40 Цикл Карно́ — идеальный термодинамический цикл. Тепловая машина Карно, работающая по этому циклу, обладает максимальным КПД из всех машин, у которых максимальная и минимальная температуры осуществляемого цикла совпадают соответственно с максимальной и минимальной температурами цикла Карно. Состоит из 2 адиабатических и 2 изотермических процессов. КПД тепловой машины Карно зависит только от температур нагревателя и холодильника. Кроме того, из него следует, что КПД может составлять 100 % только в том случае, если температура холодильника равна абсолютному нулю. Это невозможно, но не из-за недостижимости абсолютного нуля (этот вопрос решается только третьим началом термодинамики, учитывать которое здесь нет необходимости) , а из-за того, что такой цикл или нельзя замкнуть, или он вырождается в совокупность двух совпадающих адиабат и изотерм. Т. любая реальная тепловая машина, работающая с нагревателем температуры Т1 и холодильником температуры Т2, не может иметь коэффициент полезного действия, превышающий КПД идеальной тепловой машины. 41 Энтропия – специфическая физическая величина, которая определяет направление протекания физических процессов. Энтропия – функция состояния. По характеру изменения энтропии можно судить о том, в каком направлении происходит теплообмен. При нагревании тела(  > 0) его энтропия возрастает( > 0) его энтропия возрастает( ), если тело охлаждается, то наоборот. ), если тело охлаждается, то наоборот.Энтропия связана с термодинамической вероятностью соотношением 42 Таким образом, изменение энтропии ΔS1-2 идеального газа при переходе его из состояния 1 в состояние 2 не зависит от вида перехода 1 - 2. Каждый из изопроцессов идеального газа характеризуется своим изменением энтропии, а именно: изохорный: изобарный: изотермический: адиабатный: Отметим, что в последнем случае адиабатный процесс называют изоэнтропийным процессом, т.к. 43 Физическая кинетика — микроскопическая теория процессов в неравновесных средах. В кинетике методами квантовой или классической статистической физики изучают процессы переноса энергии, импульса, заряда и вещества в различных физических системах (газах, плазме, жидкостях, твёрдых телах) и влияние на них внешних полей. Расстояние, проходимое молекулой в среднем без столкновений, называется средней длиной свободного пробега. Средняя длина свободного пробега равна:
Среднее число столкновений за 1 с равно числу молекул в объеме «ломаного» цилиндра: Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d. 44 Диффу́зия — процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму 1 закон j = -D * (dc/dx) 2 закон (dC/dt)=(dj/dx)=-D(d2c/dx2) Теплопрово́дность — способность материальных тел проводить энергию (теплоту) от более нагретых частей тела к менее нагретым частям тела, осуществляемому хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.). Q=- ƛ*grad(T)*S Вя́зкость (вну́треннее тре́ние) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. Закон вязкости Ньютона — математическое выражение, связывающее касательное напряжение внутреннего трения 46 Электрическое поле — одна из двух компонент электромагнитного поля, представляющая собой векторное поле, существующее вокруг тел или частиц, обладающих электрическим зарядом, а также возникающее при изменении магнитного поля (например, в электромагнитных волнах). Электрическое поле непосредственно невидимо, но может быть обнаружено благодаря его силовому воздействию на заряженные тела Е- напряженность электрического поля в данной точке, есть вектор, равный по величине силе, действующей на положительный единичный заряд, помещенный в эту точку и совпадающей с ней по направлению. Принцип суперпозиции полей-напряженность поля в любой точке, равно геометрической сумме напряженностей полей, создаваемых отдельными зарядами. Электрическое поле изображают с помощью силовых линий. Силовые линии указывают направление силы, действующей на положительный заряд в данной точке поля. |
