газовые законы. Лекция. Газовые законы
 Скачать 0.69 Mb. Скачать 0.69 Mb.
|
|
Тема: Газовые законы. 1. Уравнение состояния идеального газа. Уравнение состояния. Получим уравнение, связывающее все три макроскопических параметра p, V и Т, характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального газа. Подставим в уравнение 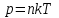 выражение для концентрации молекул газа. Концентрацию газа можно записать так: выражение для концентрации молекул газа. Концентрацию газа можно записать так: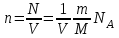 , (1) , (1)где  - постоянная Авогадро, - постоянная Авогадро, 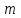 - масса газа, - масса газа, 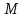 - его молярная масса. - его молярная масса.После подстановки будем иметь: 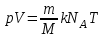 . (2) . (2)Произведение постоянной Больцмана  и постоянной Авогадро и постоянной Авогадро  называют универсальной (молярной) газовой постоянной и обозначают буквой R: называют универсальной (молярной) газовой постоянной и обозначают буквой R: (3) (3)  Подставляя в уравнение (2) вместо 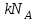 универсальную газовую постоянную R, получим уравнение состояния для произвольной массы идеального газа: универсальную газовую постоянную R, получим уравнение состояния для произвольной массы идеального газа:(4) Единственная величина в этом уравнении, зависящая от рода газа, - это его молярная масса. Из уравнения состояния вытекает связь между давлением, объемом и температурой идеального газа, который может находиться в двух любых состояниях. Уравнение состояния в форме (4) называют уравнением Менделеева - Клайперона. 2. Газовые законы. С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех параметров – давление, объем или температура – остаются постоянными. Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами. Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами. Изотермический процесс. Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим. Согласно уравнению состояния идеального газа (4) в любом состоянии с неизменной температурой произведение давления газа на его объем остается постоянным:  при при  (5) (5)Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. Э 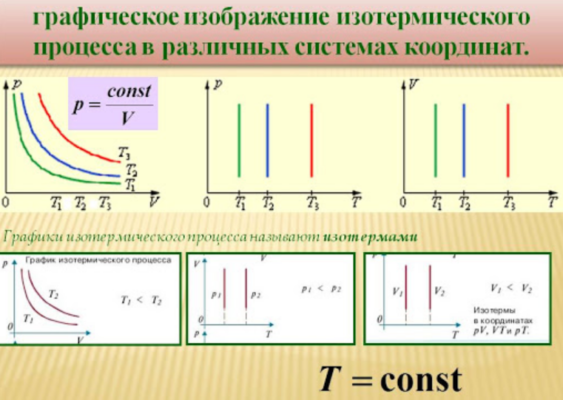 тот закон экспериментально был открыт английским ученым Р.Бойлем (1627-1691) и несколько позже французским ученым Э.Мариоттом (1620-1684). Поэтому он носит название закона Бойля – Мариотта. тот закон экспериментально был открыт английским ученым Р.Бойлем (1627-1691) и несколько позже французским ученым Э.Мариоттом (1620-1684). Поэтому он носит название закона Бойля – Мариотта.Зависимость давления газа от объема при постоянной температуре графически изображается кривой, которая называется изотермой. Изотерма газа изображает обратно пропорциональную зависимость между давлением и объемом. Кривую такого рода в математике называют гиперболой (рис. 1). Разным постоянным температурам соответствуют различные изотермы. При повышении температуры давление согласно уравнению состояния (4) увеличивается, если 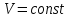 . Поэтому изотерма, соответствующая более высокой температуре Т2, лежит выше изотермы, соответствующей более низкой температуре Т1. . Поэтому изотерма, соответствующая более высокой температуре Т2, лежит выше изотермы, соответствующей более низкой температуре Т1.Изобарный процесс. Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным. Согласно уравнению (4) в любом состоянии газа с неизменным давлением отношение объема газа к его температуре остается постоянным:  при при 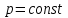 (6) (6)Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется. Этот закон был установлен экспериментально в 1802 г. французским ученым Ж. Гей-Люссаком (1778-1850) и носит название закона Гей-Люссака. Согласно уравнению (6) объем газа линейно зависит от температуры при постоянном давлении:  (7) (7) Эта зависимость графически изображается прямой, которая называется изобарой(рис.2). Эта зависимость графически изображается прямой, которая называется изобарой(рис.2). Различным давлениям соответствуют разные изобары. С ростом давления объем газа при постоянной температуре согласно закону Бойля-Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению р2, лежит ниже изобары, соответствующей более низкому давлению р1. Изохорный процесс. Процесс изменения состояния термодинамической системы при постоянном объеме называют изохорным. Из уравнения состояния (4) вытекает, что в любом состоянии газа с неизменным объемом отношение давления газа к его температуре остается постоянной:  при при 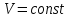 (8) (8)Для газа данной массы отношение давления к температуре постоянно, если объем не меняется. Этот газовый закон был установлен в 1787 г. французским физиком Ж. Шарлем (1746-1823) и носит название закона Шарля. Согласно уравнению (8) давление газа линейно зависит от температуры при постоянном объеме: 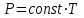 (9) (9)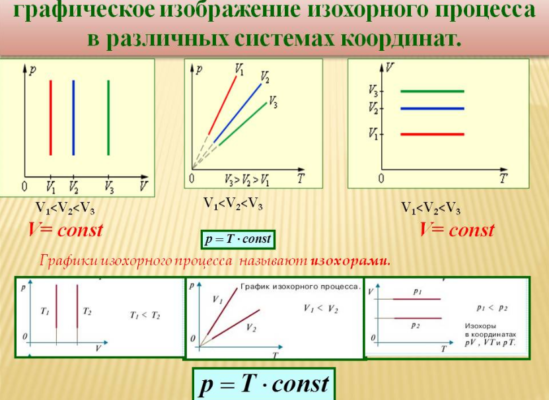 Эта зависимость изображается прямой, называемой изохорой (рис. 3). Разным объемам соответствуют разные изохоры. С ростом объема газа при постоянной температуре давление его согласно закону Бойля-Мариотта падает. Поэтому изохора, соответствующая большему объему V2, лежит ниже изохоры, соответствующей меньшему объему V1. Задание 1. Ответить на контрольные вопросы в тетради: Какое уравнение называют уравнением состояния идеального газа? Запишите формулу Менделеева-Клапейрона. Что называют изопроцессом? |
