|
|
Генетика. Гены представляют собой участки днк
ГЕНЫ ПРЕДСТАВЛЯЮТ СОБОЙ УЧАСТКИ ДНК
Состоит из экзонов и нитронов, начинается и заканчивается экзоном
ДНК — состоит из последовательно соединенных нуклеотидов. Каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибозы) и фосфатной группы.
Связи между нуклеотидами в цепи образуются за счёт дезоксирибозы и фосфатной группы (фосфодиэфирные связи)
Связи между сахаром и основанием гликозидная
Между двумя цепями — водородные
Водородные двойные — тиамин аденин
Водородные тройные — гуанин цитозин
Стекинг-взаимодействие — между плоскими азотистыми основаниями
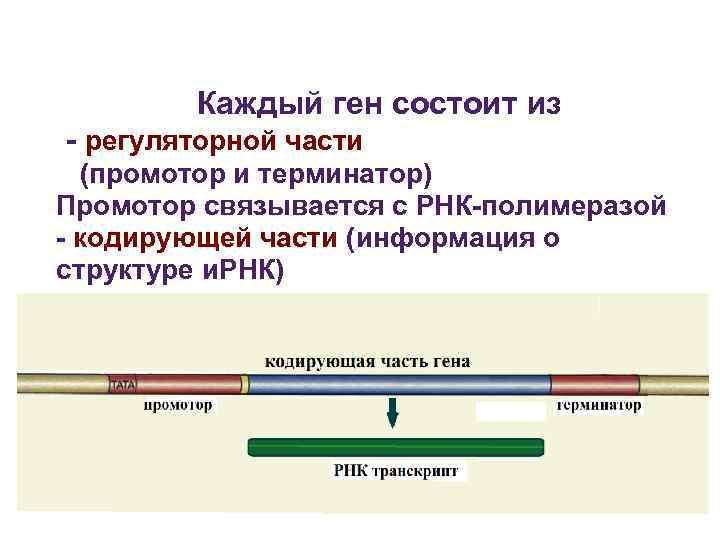
Начало и окончание экспрессии гена контролируются промотором и терминатором (80—100 н. п.). На промотор «садится» полимераза, и только после этого начинается экспрессия гена. Без промотора ген бездействует.
У многих генов эукариот есть участки, которые несут информацию о строении белка — экзоны, и участки, которые такой информации не несут — интроны
Последовательность комплементарная экзонам — зрелая РНК
Транзиция — замена пурина на пирин; пиримидина на пиримидин
Трансверсия — замена пиримидина на пурин и наоборот
Интроны — некодирующие последовательности
Рестриктаза — фермент который режет ДНК
Открытие ДНК
Открыли Уотсон и Крик в 1953 г
Розалинда Франклин
Морис Уилкинс
Мишер впервые обнаружил ДНК в 60-х годах 19в
Саузерн блот гибридизация
Эта технология используется для локализации отдельных последовательностей ДНК в рестрикционных фрагментах
Последовательность:
выделяется ДНК из любой ядросодержащей ткани (чаще кровь) у младенцев это ворсинки хориона
Тотальная ДНК обрабатывается одной ректриктазой. В результате разрезания образуется много фрагментов разной длины
Проводят электрофорез в геле. Упорядочивание фрагментов по ММ
ДНК всегда заряжена отрицательно (тяжёлые ближе к старту)
затем кладём нитроцеллюлярный или нейлоновый фильтр. ДНК осмотическим током жидкости переносится с вкладного геля на фильтр (образуется реплика днк-рестрикта). На фильтре будет реплика-днк-рестриктор.
Продолжительность от 12 до 24ч
При переносе в щелочной среде, ДНК денатурируют, и в этом состоянии ДНК способна гибридизироваться с одноцепочечным меченным ДНК-зондом на исследуемый фрагмент
ДНК-Зонд — короткий фрагмент одноцепочечной ДНК, искусственно синтезирующий комплементарный искомой последовательности и меченный радиоактивной меткой
для гибридизации кладут в раствор содержащий буфер для гибридизации и зонд инкубируют (12ч при 68’с)
Гибридизация — образование двуцепочечной структуры
Фильтр промывают а далее зависит от метки
Флюоресцент — в микроскоп специальный
Радиоактивный — в рентген (с рентгеновской пленкой)
Метод можно использовать для локализации специфичной последовательности геномной ДНК
Нозерн блот гибридизация — для белков
Вестерн блот гибридизация — для рнк
Истерн — для модификационных белков
Полимеразная цепная реакция (ПЦР)
ПЦР основан на многократном повторяющемся изменении температуры, что позволяет получить множество копий целевого фрагмента. Копировать можно любой интересующий нас фрагмент
ПЦР — это метод направленный на многократное копирование (амплификацию) определенных фрагментов ДНК в процессе повторяющихся температурных циклов при помощи ферментов в искусственных условиях (инвитро)
Метод хорош тем что позволяет обнаруживать единственную специфичную ДНК среди миллионов других. Очень маленькое количество ДНК (2 нанограмма)
Открытие Мюллис; предшественник Клепи
Виды пцр
Количественная / в режиме реального времени
Вложенная (гнездовая)
Алелльспецифическая
ПЦР с обратной транскрипцией (для ислед рнк)
Метеочувствительная ПЦР
ПЦР длинных фрагментов
Мультиплексная (несколько локусов)
Последовательность:
анализируемая ДНК
Фермент Taq- полимераза. Это обычная ДНК-полимериза. Получают из бактерий термус акватикус из гейзерных источников. Эта бактерия термостабильна до 100*С (денатурация происходит при 100*с)
Taq- полимераза (60 нуклеотидов в секунду)
для ПЦР требуется фермент ДНК-полимераза, который создает новые цепи ДНК, используя существующие цепи в качестве матриц. ДНК-полимераза, обычно используемая в ПЦР, называется Taq полимераза в честь термостабильной бактерии, из которой она была выделена (Thermus aquaticus).
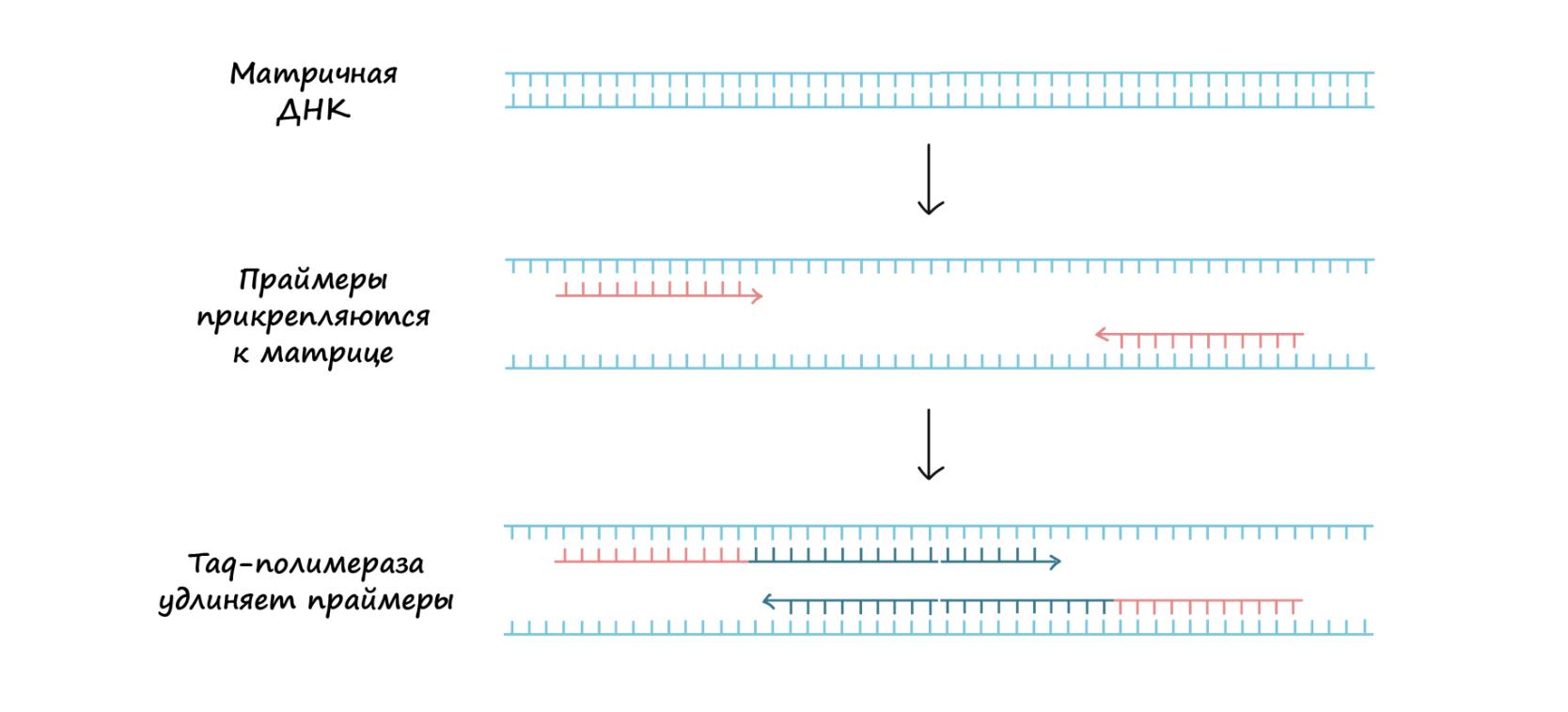
ДНК-полимераза. Фермент, строящий комплементарную матричной цепь ДНК. Он может начинать синтез только от 3ˊ-конца праймера.
Taq-полимераза может синтезировать ДНК только в том случае, если у нее есть праймер — короткая последовательность нуклеотидов, являющаяся отправной точкой для синтеза ДНК.
Праймер F и R (прямой и обратный)
Праймеры представляют собой последовательности, которые связываются с цепями матричной ДНК точно по краям копируемой области. Праймеры связываются с матрицей, образуя пары комплементарных оснований.
Когда праймеры окажутся связаны с матрицей, полимераза их удлинит, и область, ограниченная ими, начнёт копироваться.
dNTP: dATP dTTP dCTP dGTP — строительный материал (дезоксирибонуклеотид три фосфат)
Буфер (магний калий консольвенты) стабилизирует днк в одноцепочечном состоянии
Процесс ПЦР
Денатурация (96°C): Сильный нагрев реакционной смеси, чтобы разделить или подвергнуть денатурации цепи ДНК. Этот процесс приведет к образованию одноцепочечной матрицы для выполнения следующего этапа
Отжиг (52-55°C) Охлаждение реакционной смеси, чтобы праймеры могли связаться со своими комплементарными последовательностями на одноцепочечной ДНК-матрице. Гибридизация праймеров на комплементарные последовательности исследуемых ДНК.
Гибридизация — праймер соединяется с одноцепочечной ДНК, образование двуцепочечной ДНК
Синтез (Элонгация) 72°C
Повторное увеличение температуры реакционной смеси, чтобы Taq-полимераза достроила праймеры, синтезируя новые цепи ДНК.
вместо одной или нескольких копий фрагмента получаются несколько миллиардов.Так как каждый раз в качестве матрицы используется не только исходная ДНК. Новая ДНК, полученная в результате одного цикла, может служить матрицей в следующем цикле синтеза. В реакцию поступает много копий праймеров и множество молекул Taq-полимеразы, поэтому количество молекул ДНК в каждом цикле может удваиваться
Амплификация — увеличение числа копий ДНК
Праймер— это искусственно синтезированная короткая цепочка нуклеотидов (15–30 штук), комплементарная выбранному участку одной из цепей анализируемой ДНК. Один из праймеров обычно соответствует началу амплифицируемого отрезка, другой — его концу, но на противоположной цепи. У праймеров, как и у любого олиго- или полинуклеотида, есть 3ˊ- и 5ˊ-концы.
1 этап = шаг пцр
3 шага = цикл (денатурация, отжиг, синтез)
Повторение циклов (30) ведёт к амплификации днк. Специфичность пцр определяют праймеры
Правила:
длина праймера от 20-30 нуклеотидов (22 нуклеотида в среднем)
Содержание гуанина-цитозина должно быть более 65%
Прямой и обратный праймер не должны содержать длинных последовательностей комплементарных друг другу (не более 3-4 нуклеотидов чтобы не соединились)
Должны ориентироваться таким образом чтобы синтез протекал между ними
Для осуществления пцр используют термоциклеры или амплификаторы
1 —> 10*9 (за 90 мин) => увеличение фрагмента
Применение:
диагностика инфекционных заболеваний
Идентификация личности
Родство
Определение наследственных заболеваний
Онкология
Пищевая промышленность
Наука
Программа
Начальная денатурация 98*с 5’мин 1 цикл
Отжиг 56*с 1’
Синтез 72*с 1’
Денатурация 98*с 5 мин 28 циклов
Отжиг 56*с 1’ мин
Синтез 72*с 1’ мин
Денатурация 98*с 5’мин. 1 цикл
Отжиг 56*с 1’мин
Конечный синтез 72*с 7 мин
Электрофорез - метод используемый для разделения и идентификации фрагментов днк.
Существует 2 вида: горизонтальный и вертикальный.
Горизон. Электрофорез - агарозном геле
Вертик. Электрофорез- полиакриламидном геле
При разделение в геле можно следить за положением фрагментов в геле ДНК. Так как они окрашены флуорисцентом, под ультрафиолетом и интеркалирующим между основаниями днк, красителем -бромистым этидием.
Просматривая гель под ультрафиолетом можно заметить даже 1 нанограмм ДНК
Бромистый этидий сильный канцероген.
Благодаря отрицательно заряженному сахарофосфатному остову ДНК, фрагменты движутся в геле под действием электрического поля от отрицательного катода к положительному аноду. Более короткие молекулы делают это быстрее, чем длинные. Бромфеноловый синий нужен для того, чтобы следить за продвижением фронта проб в геле и не допустить их выхода за его пределы
Скорость миграции днк через агарозный гель зависит от:
от размера днк, молекулярной массы — молекулы линейной двуцепочечной ДНК перемещаются в геле одним концом вперед
От концентрации геля (агарозы), чем выше конц. тем ниже скорость.
Напряжённости эл поля (силы тока)
Напряжение низкое => если фрагменты близко => напряжённость тоже низкая
От конформации днк (одноцепочечной, двуцепочечной, линейной, кольцевой
Состава днк
В полиакриловом геле скорость зависит еще и от температуры.
Приспособления для проведения электрофореза
камера или кювета
Гель устанавливается в камере так, чтобы гель был на самом поверхности буфера. Гель готовят на том же самом буфете
Сопротивление геля проходящему току почти не отличается от сопротивления буфера в котором сам находится. По гелю проходит значительная доля тока
Буфер (рн = 7,5 — 7,8) есть трисбаратнвй и трисацетатный
Трисбаратный - более устойчив для вертик электрофореза
Трисацетатный - для горизонт. электрофореза
полимер в котором будет гель
Горизон. Электрофорез - агарозном геле (порошок из бурых водорослей, натуральный полимер)
Вертик. Электрофорез- полиакриламидном геле
Способ применения
Берут нарезку агарозы и заливают раствором буфера такой же концентр. как и в камере -> плавят до полного растворения (в микроволновке или водяной бане больше 100*с. Оставляют остыть ->добавляют бромистый этидий (до концентрации 0,5 мкг/ мл) -> агарозу выливают в подложку и вставляют туда пластиковую гребенку, удаляют ее и на ее месте образуются лунки. В которые наносят пробы днк.
Приготовление пробы днк
Нужное кол-во днк и добавляют 1/10 объема бромфенолого синего. Чтобы увидела как двигаются фр ДНК при свете
конц полиакриламида - 3,5-20%
Пробы днк вносят в лунки и подключают напряжение и через 30-40 мин гель просматривают под уф
Пробы генотипируют (по расположению определенных генотипов и размера)
Вертикальный электрофорез
проводится в полиакриламидном геле (кону 3,5-20%)
Более чувствительный гель, можно разглядеть фрагменты отличающиеся на 1нк
Полиакриламид заливают между двумя стеклянными пластинками разделёнными спейсерами затем вставляют гребенку
Фактор полимеризации для паа —> свет
Смотрят под уф
Красят гель в отличие от агарозы после электрофореза.
Секвенирование ДНК по Сэнгеру: метод «терминаторов»
Суть метода в том, что в реакционную смесь добавляются аналоги привычных нуклеотидов (дидезоксинуклеозидтрифосфаты), включение которых в синтезируемую цепь приводит к невозможности ее дальнейшего синтеза (терминации), а по образовавшемуся “обломку” можно установить последнюю букву секвенируемого фрагмента ДНК
Метод. Используется ДНК-полимераза, олигонуклеотидные праймеры и смесь четырех дезоксинуклеотидов (dNTPs) (А, Т, G и C). В каждую из четырех реакций добавляется по одному дидезоксинуклеозидтрифосфату (ddATP, ddTTP, ddCTP или ddGTP), которые останавливают дальнейшую реакцию
(синтез комплементарной молекулы ДНК с матрицы) — таким образом, в каждой пробирке образуется набор фрагментов ДНК разной длины, которые заканчиваются одним и тем же нуклеотидом. У дидезоксирибонуклеотидов (ddATP, ddGTP, ddCTP, or ddTTP) отсутствует 3'-гидроксильная группа, поэтому после их включения в цепь дальнейший синтез обрывается. Затем полученные фрагменты визуализируют с помощью электрофореза и, сравнивая длины фрагментов из четырех реакций с ddATP, ddTTP, ddCTP или ddGTP, восстанавливают последовательность ДНК.
Компоненты
1) одноцепочечная матрица ДНК
2) короткая затравочная молекула одноцепоч. ДНК, которая комплиментарна опр. Участка матрицы
3)ДНТПдезоксирибонуклеотид смесь 4х нуклеотидов
4) ферменты ДНК - полимераза из E. coli
5) буфер ионы Mg
6)ДДНТП - Дидизоксинуклеотидтрифосфаты.
праймер — небольшую одноцепочечную молекулу ДНК, комплементарную началу участка, который нужно отсеквенировать. Праймер необходим потому, что ДНК-полимеразы не могут начинать синтез цепи «с пустого места», они только присоединяют следующий нуклеотид к уже имеющейся 3'-гидроксильной (OH) группе предыдущего. Праймер, таким образом, представляет собой «затравку» при синтезе ДНК
Секвенирование по Максаму Гильберту
Альтернатива Сенгеру
В основе лежит: 1)химическая деградация ДНК
2)ограниченное расщипление меченного фрагмента ДНК под действием хим реагентов.
Важное условие - фрагмент ДНК метится по одному концу.
Для каждого типа нуклеотидов или их комбинаций проводят реакцию в отдельных пробирках
Этапы:
рестрикция фрагмента днк
Нуклеотиды модифицируют хим реагентом. Концентрация реагента и продолжительность действия подбирается так, чтоб в каждой молекул произошла модификация только одного нуклеотид. Поскольку в реакционной смеси присутствует огромное количество таких молекул, то, по теории вероятности, все основания данного типа в секвенируемом фрагменте ДНК окажутся модифицированными
4) количественное расщепление — удаление модифицированных оснований, происходит разрыв цепи. Разрыв цепи происходит количественно.
Для каждого типа нуклеотидов и их комбинаций проводят отдельно реакции огранич. модификации и колич. Расщепления.
В результате 4х реакций образуется смесь молекул различных по размеру по 1му нуклеотид несущих метку, обычно радиоактивную.
После разделения продуктов реакции на соседних дорожках будет видна лестница из полос ДНК на соседних дорожках чтение которой позволит восстановить последовательность нуклеотидов в секв. Фрагмент ДНК |
|
|
 Скачать 96.49 Kb.
Скачать 96.49 Kb.