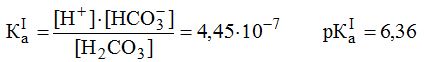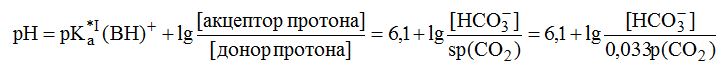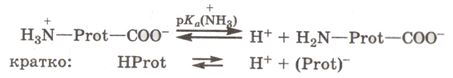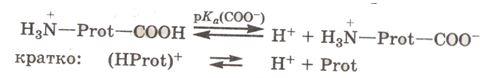гидрокарбонатная буферная система. Гидрокарбонатная буферная система. Гидрокарбонатная буферная система Гидрокарбонатная буферная система
 Скачать 275.5 Kb. Скачать 275.5 Kb.
|
|
| Буферные системы плазмы крови | Относительный вклад, % | Буферные системы плазмы крови | Относительный вклад, % |
| Гидрокарбонатная НСО3-, Н2СО3 | 35 | Гемоглобиновая Hb-; HHb; HbO2-; HHbO2 | 35 |
| Белковая (Prot)-; HProt | 7 | Гидрокарбонатная НСО3-, Н2СО3 | 18 |
| Гидрофосфатная НРО42-, Н2РО4- | 1 | Гидрофосфатная НРО42-, Н2РО4- | 4 |
| Общий | 43 | Общий | 57 |
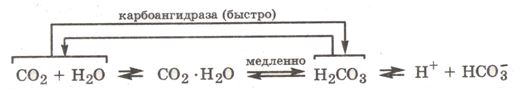
Когда кровь попадает в легкие, где давление кислорода при вдохе достаточно велико, она обогащается кислородом за счет связывания его в эритроцитах гемоглобином ННb с образованием оксигемоглобина ННbО2. (Строение гемоглобина и его производных рассмотрено в разд. 10.4.) Оксигемоглобин, как кислота, диссоциирует легче, чем гемоглобин, анион которого, связывая катион Н+, поддерживает рН в эритроците. Поскольку ННbO2 в крови легких много и по силе эта кислота (рKа(ННb2) = 6,95) сопоставима с угольной кислотой (pKa(H2CO3) = 6,1), то за счет ННbО2 и при участии фермента карбоангидразы в легких параллельно происходит процесс очищения крови от летучей кислоты СО2, которая в эритроцитах находится в виде НСО3 и аниона карба-миногемоглобина (Нb·CO2)-, а в плазме — в виде НСО3- и в растворенном состоянии (СО2 · Н2О). Процессы, происходящие в эритроцитах легочной крови, можно отразить следующими реакциями:
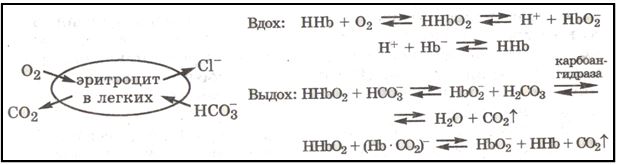
Уменьшение концентрации НСО3 в эритроцитах легочной кропи приводит к диффузии НСО3 из плазмы в эритроцит. Вследствие этого плазма очищается от гидрокарбонат-аниона и растворенного СО2 (СО2·Н2О), так как переход НСО3- в эритроцит способствует следующим превращениям в плазме:
СО2 · Н2О ↔ Н2СО3 ↔ Н+ + HCO3- → в эритроцит
Поступление НСО3- в эритроциты приводит к удалению из них хлорид-анионов (для соблюдения электронейтральности этих клеток). Следует подчеркнуть, что протеканию всех приведенных реакций способствуют два физиологических процесса: вдох — поступление кислорода в кровь — и выдох — выделение из крови "летучей кислоты" СО2.
Обогащенная кислородом артериальная кровь, содержащая оксигемоглобин на 65 % в ионизированном состоянии (НbО2-), а гемоглобин — на 10 % (Нb-), поступает в ткани, которые стремятся получить кислород и отдать в кровь продукты метаболизма: СО2 и избыток катионов Н+. Это приводит к протеканию следующих процессов: поступающий в кровь СО2 растворяется в плазме и эритроцитах и, реагируя с водой, образует угольную кислоту. В плазме эта реакция идет медленно, а в эритроцитах быстро, за счет участия фермента карбоангидразы. Поэтому СО2 интенсивно диффундирует в эритроциты, где происходит его связывание с образованием Н2СО3, а также карбаминогемоглобина (Нb·СО2)- в результате взаимодействия с буферным основанием эритроцитов Нb, при котором СО2связывается с аминогруппами белка (глобина). Образовавшаяся в эритроцитах Н2СО3, как более сильная кислота, реагирует с другим буферным основанием – НbО2-, переводя его в неионизированное состояние ННb2, а сама превращается в НСО3-, который диффундирует в плазму. Неионизированный оксигемоглобин легко отдает тканям необходимый кислород. Эти процессы в эритроцитах описываются следующими реакциями:
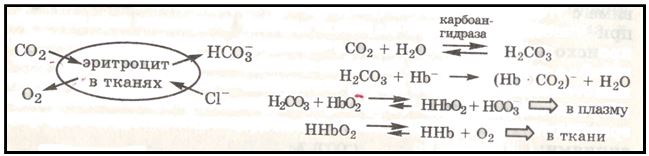
Таким образом, в тканях из эритроцитов в плазму постоянно поступает HCO3-, а из плазмы в эритроциты для соблюдения их электронейтральности диффундируют протолитически неактивные хлорид-анионы. В результате встречной диффузии этих ионов в эритроците среда менее щелочная (рН = 7,25), чем в плазме (рН = 7,40).
В плазму крови из тканей поступают метаболический Н+ и СО2, а из эритроцитов – НСО3-Буферные основания плазмы – гидрокарбонат-анионНСО3-, анион белка (Prot)- и гидрофосфат-анион НРО4-, реагируя с поступающими кислотными субстратами Н+, СО2·Н2О и Н2СО3, нейтрализуют их благодаря следующим реакциям:
ПЛАЗМА КРОВИ В ТКАНЯХ

В легких кровь очищается от НСО3- за счет превращения его в СО2 и удаления из организма. Нейтрализация кислых продуктов HProt и Н2РО4- в соответствующие им буферные основания (Prot)- и НРО42- происходит при очищении крови в почках, при этом часть фосфатов удаляется с мочой.
Совокупность рассмотренных процессов, происходящих в эритроцитах и плазме крови, обеспечивает протекание двух важнейших физиологических процессов — поддержания рН крови на уровне рН = 7,35 — 7,45, несмотря на постоянное поступление в нее из тканей СО2 и катионов Н+, и дыхания — поступления в кровь и транспорта ею кислорода и СО2. Транспорт кислорода из легких в ткани в основном осуществляется за счет образования в эритроцитах оксигемоглобина (ННbО2), при этом 100 мл крови транспортируют 21 мл газообразного кислорода. Углекислый газ транспортируется кровью из тканей в легкие в следующих формах: НСО3- — 80 %, (Нb·СO2)- — 15 % и (CO2·H2O), т. е. в растворенном виде, — 5 %. При этом около двух третей общего количества СО2 находится в плазме, а одна треть — в эритроцитах. Однако в процессе переноса СО2 от тканей к легким почти весь СО2 крови должен пройти через эритроциты, т. е. войти в эритроциты и выйти из них.
Все буферные системы организма характеризуются отношением [акцептор протона]/[донор протона] 4 : 20, т. е. их буферная емкость по кислоте больше, чем буферная емкость по основанию. Это отношение находится в соответствии с особенностями метаболизма человеческого организма, образующего больше кислотных продуктов, чем основных. Поэтому очень важным показателем для физиологических сред является кислотная буферная емкость Вa. При заболевании органов дыхания, кровообращения, печени, желудка, почек, при отравлениях, голодании, диабете, ожоговой болезни и т. п. может наблюдаться уменьшение или увеличение Ва по сравнению с нормой, т. е. патологические явления: ацидоз и алкалоз.
Ацидоз — это уменьшение кислотной буферной емкости физиологической системы по сравнению с нормой.
Алкалоз — это увеличение кислотной буферной емкости физиологической системы по сравнению с нормой.
Причинами ацидоза и алкалоза могут быть или увеличение содержания кислот, или уменьшение содержания буферных оснований в системе по сравнению с нормой.
Ацидоз или алкалоз могут быть экзогенного и эндогенного характера. Экзогенный ацидоз возникает при употреблении пищи с избыточным содержанием кислот (лимонной, бензойной, уксусной), а также лекарственных средств, трансформация которых в организме способствует понижению рН среды. Экзогенный алкалоз в основном возникает при поступлении в организм лекарств или других веществ, способствующих повышению рН среды, например соды, ацетата калия. Эндогенный ацидоз или алкалоз возникает при нарушении протолитического баланса в организме вследствие нарушения соотношений скоростей синтеза и выведения тех или иных кислот или оснований.
В зависимости от глубины патологических изменений различают компенсированный и некомпенсированный ацидоз (алкалоз). При компенсированном ацидозе (алкалозе), несмотря на отклонения от нормы кислотной буферной емкости, рН крови сохраняет значение в пределах 7,35 < рН < 7,45. Некомпенсированный ацидоз сопровождается уменьшением кислотной буферной емкости и снижением рН крови (6,8 < рН < 7,35), а некомпенсированный алкалоз — увеличением кислотной буферной емкости и повышением рН крови (7,45 < рН < 7,9). Снижение рН крови по сравнению с нормой называется ацидемией, а повышение рН крови — алкалемией. Изменение значения рН крови на 0,6 единицы в любую сторону приводит к летальному исходу.
Для характеристики кислотно-основного состояния крови в физиологии и медицине используются следующие метаболические показатели: величина рН плазмы и цельной крови, парциальное напряжение (давление) углекислоты /^(СОг), содержание гидрокарбоната в плазме крови, содержание буферных оснований в плазме крови ВВ, избыток или дефицит буферных оснований в крови BE.
Величина рН плазмы крови — фактическая величина водородного показателя плазмы артериальной крови при 37 °С. Физиологические пределы 7,35 < рН < 7,45.
Парциальное напряжение углекислоты р(C2) — парциальное давление СО2 над кровью, находящейся в равновесии с растворенным в плазме СО2 при 37 °С. В физиологических условиях р(C2) = (40 ± 5) мм рт. ст. (5,3 кПа). Предельные значения парциального давления СО2 составляют при алкалозе 10 мм рт. ст., а при ацидозе 130 мм рт. ст.
Содержание гидрокарбоната в плазме крови в норме с(НСО3-) = (24,4 ± 3) ммоль/л.
Содержание буферных оснований в плазме крови (ВВ) — нормальное значение для плазмы ВВ = (42 ± 3) ммоль/л.
Избыток или дефицит буферных оснований в крови BEхарактеризует разницу между фактическим содержанием буферных оснований в крови у исследуемого человека и значением ВВ в норме, равным 42 ммоль/л. В норме BEравен ±3 ммоль/л. При патологии интервал значений показателя BEзначительно шире: ±30 ммоль/л.
В клинической практике с помощью указанных метаболических показателей крови определяют наличие нарушений протолитического гомеостаза. Различают четыре вида первичных нарушений кислотно-основного баланса в организме, которые относятся к патологическим физиологическим процессам.
Метаболический ацидоз характеризуется избытком нелетучей кислоты или дефицитом гидрокарбонат-аниона в межклеточной жидкости.
Показатели: Ва < норма; [донор протона] > норма; рН ≤ норма;
с(НСО3-) < норма; BE < норма; р(С02) < норма.
Причины: нарушение кровообращения, кислородное голодание тканей, диарея (понос), нарушение выделительной функции почек, диабет.
Метаболический алкалоз характеризуется удалением молекул кислот или накоплением буферных оснований, включая содержание гидрокарбонат-аниона в межклеточной жидкости.
Показатели: Ва > норма; [акцептор протона] > норма; рН ≥ норма;
с(НСО3-) > норма; BE > норма; р(СО2) > норма.
Причины: неукротимая рвота, удаление кислых продуктов из желудка, запор (накопление щелочных продуктов в кишечнике), длительный прием щелочной пищи и минеральной воды.
Респираторный (газовый) ацидоз характеризуется пониженной скоростью вентиляции легких по сравнению со скоростью образования метаболического СО2.
Показатели: Ва < норма; [донор протона] > норма; рН ≤ норма;
с(НСО3-) > норма; BE > норма; р(С02) > норма.
Причины: заболевания органов дыхания, гиповентиляция легких, угнетение дыхательного центра некоторыми препаратами, например, барбитуратами.
Респираторный (газовый) алкалоз характеризуется повышенной скоростью вентиляции легких по сравнению со скоростью образования метаболического СО2.
Показатели: Ва > норма; [донор протона] < норма; рН ≥ норма;
с(НСО3-) < норма; BE < норма; р(С02) < норма.
Причины: вдыхание разреженного воздуха, чрезмерное возбуждение дыхательного центра вследствие поражения мозга, гипервентиляция легких, развитие тепловой одышки.
Идентифицировать характер патологии можно с помощью трехкоординатной диаграммы, представляющей собой равнобедренный треугольник, на сторонах которого отложены в масштабе величины метаболических показателей: рН; с(НСО3-) и р(С02), причем так, чтобы их значения, соответствующие норме, находились на середине стороны треугольника (табл. 8.4). На диаграмме отмечены области, соответствующие различным видам ацидоза и алкалоза (метаболическим — М, респираторным — Р).
Для проведения коррекции нарушений кислотно-основного состояния организма необходимо прежде всего выяснить причины их возникновения: нарушение процессов дыхания (респираторный ацидоз или алкалоз) или процессов пищеварения и выделения (метаболический ацидоз или алкалоз). Лечение респираторных нарушений требует всего нескольких дней, а для устранения метаболических нарушений обычно необходимы недели.
При ацидозе в качестве экстренной меры используют внутривенное вливание растворов гидрокарбоната натрия (по 100-200 мл 4,5 % раствора, в острых случаях до 100 мл 8,4 % раствора), но лучше вводить 3,66 % водный раствор трисамина Н2NC(CH2H)3 или 11 % раствор лактата натрия. Последние средства, нейтрализуя кислоты, не выделяют СО2, что повышает их эффективность.
Для устранения алкалоза иногда используют 5 % раствор аскорбиновой кислоты, частично нейтрализованный гидрокарбонатом натрия до рН = 6,0-7,0.
В заключение следует отметить, что в организме человека вследствие процессов дыхания и пищеварения происходит постоянное образование двух противоположностей: кислот и оснований, причем преимущественно слабых, что обеспечивает равновесный характер протолитическим процессам, протекающим в организме. В то же время из организма постоянно выводятся кислотно-основные продукты, в основном через легкие и почки. За счет сбалансированности процессов поступления и выведения кислот и оснований, а также за счет равновесного характера протолитических процессов, определяющих взаимодействие этих двух противоположностей, в организме поддерживается состояние протолитического (кислотно-основного) гомеостаза.