Координационная химия. задача 3. Группе симметрии (образуют правильный октаэдр). Таблица характеров O
 Скачать 33.46 Kb. Скачать 33.46 Kb.
|
|
Комплексы [Mo(H2O)6]3+ и [Cr(H2O)6]3+ относятся к Oh – группе симметрии (образуют правильный октаэдр). Таблица характеров Oh группы симметрии:
Электронная конфигурация для Cr: [Ar] 3d54s1, для Cr3+: [Ar] 3d3 для Mo: [Kr] 4d54s1, для Mo3+: [Kr] 4d3. Найдем терм основного состояния для d3 – конфигурации:
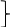 L=3 L=3S=3* 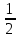 = =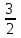 ⇒ 2S+1=4 ⇒ 4F – терм основного состояния. ⇒ 2S+1=4 ⇒ 4F – терм основного состояния.Расщепление терма 4F d3 – иона кристаллическим полем Oh   4A2g 4A2g  4T2g 4T2g  4F 4F 4T1g 4T1gПо спину разрешены только переходы с сохранением мультиплетности. Оба перехода: 4T2g ← 4A2g и 4T1g ← 4A2g разрешены по спину. Им и соответствуют две полосы в спектре. Интенсивность и положение полосы в спектре (длина волны, а следовательно и волновое число) зависят от энергии перехода. Энергия перехода зависит от разности энергетических уровней (энергия расщепления). На расщепление влияют природа иона металла, его степень окисления, расположение и сила лигандов. Mo3+ притягивает лиганды ближе, чем Cr3+. Лиганды, находящиеся ближе к иону металла, вызывают большее расщепление. Повышаются энергии переходов – уменьшаются длины волн, следовательно волновые числа возрастают. Энергия расщепления в комплексах 4d – элементов приблизительно на 50% выше, чем в соответствующих комплексах металлов 3d – ряда. Это объясняется различной протяженностью орбиталей в пространстве. |
