КОМПЛ ДЛЯ ЛЕКЦИИ. Хелатные комплексные соединения (хкс)
 Скачать 64.24 Kb. Скачать 64.24 Kb.
|
|
Хелатные комплексные соединения (ХКС) — комплексы, образованные с участием полидентатных лигандов, имеющих в своей структуре циклы; их называют хелатами, или клешневидными комплексами (chele — по-гречески «клешня»). Характерной особенностью хелатных соединений является образование циклических группировок атомов (хелатных циклов), включающих атом металла. Хелатообразующие лиганды уже имеют или приобретают в процессе образования комплексного соединения удобную для координации геометрическую форму — конформацию. Например, оксалат-ион сохраняет присущую ему плоскую геометрию и занимает своими донорными атомами О две позиции в октаэдрической координационной сфере катиона Ме,1+. При этом образуется один пятичленный хелатный цикл. Хелаты могут быть комплексами катионного и анионного типов и комплексами-неэлектролитами. Среди хелатных комплексов выделяют подкласс внутрикомплексных соединений (ВКС), которые отличаются тем, что не содержат внешнесферных ионов и являются комплексами-неэлектролитами. Внутрикомплексные хелатные соединения могут образовываться с полидентатными лигандами, содержащими кислотные функциональные группы. При этом замыкание цикла сопровождается вытеснением из кислотных функциональных групп одного или нескольких протонов ионом металла. Примером является образование глицината меди (II), представляющего собой комплекс меди (II) с анионами а-аминоуксусной кислоты — глицина. 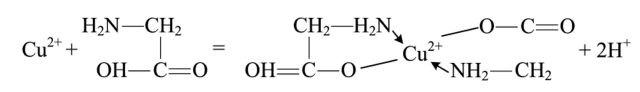 К ВКС относятся хлорофилл, гемоглобин, витамин В12, инсулин и многие другие вещества, имеющие важное биологическое значение. Примером ХКС являются комплексонаты металлов, используемые в количественном анализе для определения катионов различных металлов. Комплексонаты — координационные соединения металлов с анионами комплексонов — полиосновных аминокарбоновых или аминофосфорных кислот. Анионы комплексонов обычно выступают в роли полидентатных лигандов. Примеры комплексонов: 1) комплексон I, или нитрилотриуксусная кислота 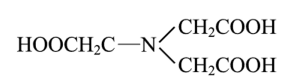 2) комплексон II, или этилендиаминтетрауксусная кислота (ЭДТУК), — четырехосновная органическая кислота 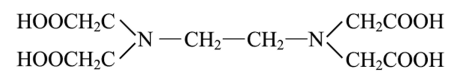 Обычное сокращенное обозначение этой кислоты — H4Y; 3) комплекты III, или «трилон Б», — двузамещенная натриевая соль ЭДТУК (Na2H2Y). В индивидуальном кристаллическом состоянии существует в форме дигидрата Na2H2Y-2H20. Распространенное сокращенное обозначение этого комплектна — ЭДТА (этилендиаминтетраацетат) 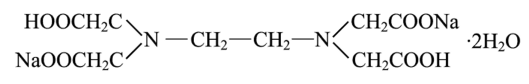 Свойства комплексных соединений (устойчивость, яркая окраска, малая растворимость в воде, регулируемая направленным синтезом и др.) широко используют в качественном и количественном анализе. Комплексы ионов металлов с полидентатными лигандами Роль полидентатных лигандов при образовании координационных соединений с ионами металлов обычно играют органические соединения, называемые в химической литературе органи - ческими реагентам и. Такие лиганды должны содержать не менее двух неподеленных пар электронов, которые будут обеспечивать возможность образования хелатов с ионами металлов. Поэтому большинство органических реагентов являются хелатообразующими. Понятие «хелат» было введено в 1920 г. Г. Морганом и И. Дрю. Оно происходит от греческого слова chele (коготь, клешня краба) и первоначально должно было обозначать, что лиганд охватывает центральный атом двумя или несколькими «зубцами» (донорными атомами), как клешней. Одним из давно известных органических хелатообразующих реагентов является 8-оксихинолин. В зависимости от соотношения заряда иона металла и координируемого им лиганда хелаты можно разделить на три группы: катионные, анионные и нейтральные. Катионные хелаты Наиболее распространенными хелатами этой группы являются комплексы полиаминов с ионами металлов. Рассмотрим простейший из них — этилендиамин (en). С ионами меди (II) он образует комплекс следующего состава: 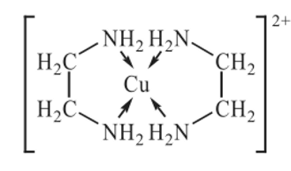 Поскольку лиганды в этом случае являются нейтральными частицами, то общий заряд комплексной частицы определяется зарядом иона металла (центрального иона). Анионные хелаты Типичными анионными хелатами являются комплексы ионов металлов с этилендиаминотетрауксусной кислотой (ЭДТА). В водных растворах ЭДТА существует в виде двойного цвиттер-иона (бетаиновая структура): 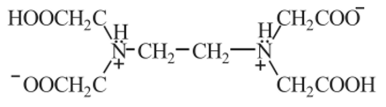 ля простоты обсуждения некоторых вопросов анион ЭДТА обозначают Y4−. В зависимости от кислотности среды степень его протонирования может быть разной. Если при рН 8–10 реагент присутствует в растворе в форме иона H2 Y2− , то реакцию образования комплекса с двухзарядным ионом металла можно записать следующим образом: H2 Y2− + M2+ ↔ MY2− + 2H+ Из этого уравнения ясен анионный характер образующегося комплекса Нейтральные хелаты (внутрикомплексные соединения) Понятие «внутрикомплексная соль» введено В. Леем в 1904 г. В современной трактовке оно означает, что при образовании хелата положительный заряд центрального атома нейтрализуется присоединением равного числа отрицательно заряженных лигандов с образованием «внутренней соли». В качестве примера можно привести описанный Леем гликолят меди: 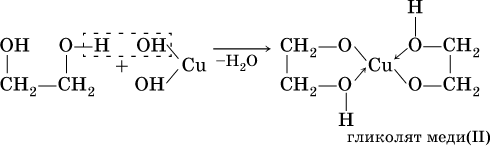 При образовании этого комплекса положительный заряд меди нейтрализуется ацетатными группами хелатообразующего реагента, в то время как незаряженные аминогруппы координационно связаны с медью. В целом частица координационного соединения электронейтральна |
