Химическая очистка сточных вод от меди. Химические методы очистки сточных вод от соединений меди
 Скачать 155.55 Kb. Скачать 155.55 Kb.
|
|
Российский химико-технологический университет им. Д. И. Менделеева Кафедра промышленной экологии РЕФЕРАТ на тему «Химические методы очистки сточных вод от соединений меди» Выполнила: студентка группы Э-41 Эм. В. Д. Проверил: доцент кафедры промышленной экологии Нистратов А. В. Москва 2018 СодержаниеВведение 3 Химические методы очистки сточных вод 4 Очистка от соединений меди 5 Методы очистки сточных вод от ионов меди (II) 6 Химическое осаждение (реагентный метод) 6 Ионный обмен 10 Мембранная фильтрация 11 Флотация 12 Электрохимические методы 13 Заключение 16 Список литературы 17 ВведениеВозрастающее антропогенное воздействие на водные объекты с каждым годом все больше обостряет экологическую ситуацию. В России около 60 % всей потребляемой воды приходится на промышленность, при этом очистка сточных вод проходит недостаточно полно и часть токсических соединений, включая тяжелые металлы, в том числе медь, принадлежащие к числу наиболее опасных загрязнителей, попадает в окружающую среду. Наибольший интерес вызывает очистка сточных вод от ионов меди (II). Это связано не только с высокой токсичностью данного элемента, но и с тем, что во многих областях Российской Федерации установлены жесткие нормативы по составу сточных вод, отводимых в централизованную систему водоотведения, которые во много раз ниже, чем предельно-допустимая концентрация (ПДК) ионов Cu2+ в питьевой воде. В данном реферате освещается тема химической очистки сточных вод от ионов тяжелых металлов, таких как медь. Химические методы очистки сточных водНейтрализация является важным химическим способом общего процесса регуляции величин рН, доведения реакции сточной жидкости до нейтральной (рН 7). Для нейтрализации кислых вод используют как растворимые, так и слабо растворимые в воде реагенты. К первым относятся: известь, едкий натр, сода; ко вторым - оксид и гидроксид магния, карбонаты кальция и магния. Осаждение ионов металлов. Как правило, кислые СВ, образовавшиеся в процессах обработки металлов, содержат ионы железа и ИТМ. В этих случаях нейтрализация сопровождается реакциями химического осаждения металлов в виде труднорастворимых гидроксидов. При нейтрализации кислых СВ реагенты расходуются как на снижение концентрации в них Н+- ионов, так и на образование гидроксидов тяжелых металлов. Значения рН, соответствующих началу и окончанию осаждения гидроксидов тяжелых металлов в водных растворах приведены в табл. Таблица 1 Величины рН осаждения гидроксидов металлов
Электрохимический метод извлечения растворенных электролитов (примесей 4-Б группы по классификации Кульского) основан на использовании электродиализа и электроосмоса. Упрощенная схема установки для электрохимической очистки сточных вод представляет собой емкость, разделенную мембранными перегородками на три камеры (катодную, рабочую и анодную) с погруженными в крайние камеры электродами 1 и 2 (рис.1). 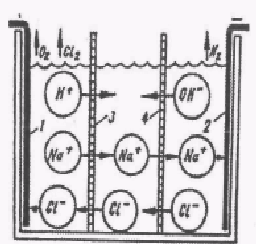 Рис. 1. Схема электрохимического извлечения растворенных электролитов После заполнения ванны водой и включения постоянного тока наблюдается перенос ионов в крайние камеры (катионов – к катоду, а анионов - к аноду) и опреснения воды в средней камере. При этом на катоде образуется свободный водород, на аноде - кислород, т.е. подкисление анодной жидкости и подщелачивание катодной. Камеры являются проточными и соединяются последовательно. Для мембран используются химически и механически стойкие материалы: перхлорвиниловая ткань, микропористый винипласт. Материалом для катода служит нержавеющая сталь, для анода - магнетит. [1] Очистка от соединений медиК подгруппе меди относятся такие ионы: Hg2+, Cu2+, Bi3+, Cd2+, Pd2+. Сульфиды этих катионов осаждаются не только в соляной, но и нейтральной и в щелочной средах при действии H2S, (NH4)2S или (NH4)2S2.[2] Все соединения Cu+ или трудно растворимы или образуют устойчивые комплексы.[3] В отличие от других катионов этой подгруппы гидроксиды меди и кадмия легко растворяются в аммиаке. Все соединения меди можно разделить на следующие группы [4]: 1.Трудно растворимые в воде, но более или менее легко в кислотах (HCl, HNO3): a) Гидроксид меди; b) Углекислотные и фосфорнокислые; c) Основные соли. 2. Трудно растворимые в воде и в кислотах (HCl, HNO3): а) Сернистые соединения (растворимые в азотной кислоте); b) СuX (CuCl легко растворима в соляной кислоте). Очистка сточных вод от меди связана с осаждением ее в виде гидроксида или гидроксид - карбоната: Cu2+ +2ОH > Cu(ОH)2, 2Cu2- + 2OH- + CO32- > Cu(OH)2CО3- Осаждение гидроксида меди происходит при рН = 5,3. [4] Растворимость гидроксид-карбонат меди ничтожно мала, поэтому наиболее выгодно осаждать медь в виде основного карбоната. Для этого в растворе нейтрализующего реагента необходимо иметь одно временно как гидроксидные, так и карбонатные ионы. Следовательно, применение для осаждения меди только щелочей или извести высшего сорта, дающих гидроксид-ионы нецелесообразно. Лучшим реагентом для очистки сточных вод от катионов меди является известь III сорта, содержащая ''недожог'' (CaCO3). Возможен процесс извлечения меди из сточных вод осаждением ферроцианидом калия. Этот реагент может быть использован и для осаждения других ионов тяжелых металлов. Для удаления из сточных вод меди и кадмия разработан процесс контактирования их с диоксидом серы или сульфитами и порошкообразным металлом, например, цинком или железом. При этом металл восстанавливает сульфиты до сульфидов, которые с тяжелыми металлами образуют труднорастворимые сульфиды. При рН = 2 и температуре сточных вод 50°С, прикоторых проводится процесс, достигается высокая степень очистки. Методы очистки сточных вод от ионов меди (II)В настоящее время существует большое количество методов и технологий очистки сточных вод от ионов Cu2+, условная классификация которых представлена на рисунке 2. [6] Химическое осаждение (реагентный метод)Реагентный метод получил самое широкое распространение в промышленности как наиболее универсальный, простой в эксплуатации и дешёвый. Основан на связывании катионов меди (II) в малорастворимые соединения. В качестве осадителей используют щелочи (гашеная известь, едкий натр), карбонаты (сода, поташ), сульфид (бисульфид) натрия и ортофосфат натрия. На большинстве предприятий в основу обезвреживания сточных вод от катионов меди (II) положена идея осаждения гидроксида металла. Основными недостатками данного метода являются сравнительно низкий экономический эффект очистки по ионам тяжелых металлов (так остаточная концентрация для ионов меди в очищенных стоках достигает 0,1-0,15 мг/л), большой расход реагентов и, как следствие, значительное увеличение общего солесодержания [7]. Сравнительный анализ эффективности реагентных методов очистки сточных вод гальванических производств [8], показывает, что наименьшую остаточную концентрацию меди в растворе дает сульфидный метод (табл. 1). 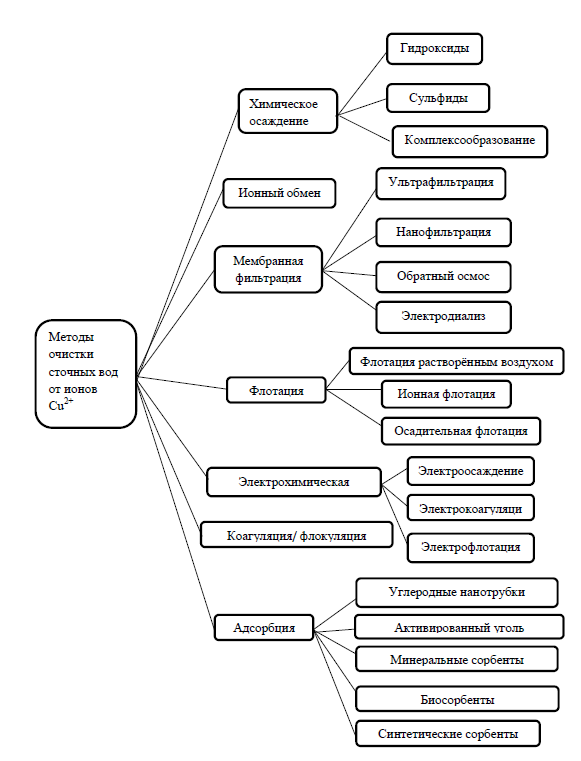 Рис. 2. Доступные технологии очистки сточных вод от ионов меди (II) [9] Таблица 3 Растворимость соединений меди
Наиболее эффективным признается сульфидный метод очистки воды. Он позволяет достичь допустимых концентраций по Cu2+ для воды, сбрасываемой в городскую канализацию. Вместе с тем использование сульфида натрия для осаждения ионов меди имеет свои отрицательные стороны: 1. Даже при подщелачивании не удается полностью подавить гидролиз сульфида и предупредить выделение сероводорода. 2. Отстаивание сульфида меди – очень длительная операция, осадок аморфный, склонен к пептизации, быстрого, полного и надежного осаждения достичь трудно из-за образования устойчивых коллоидных систем в равновесии с тведрой фазой сульфида. При использовании реагентного метода возникает ещё одна важная экологическая и экономическая проблема – утилизация отходов, содержащих большое количество цветных металлов. Сейчас эта проблема «решается» захоронением гальваношламов на специальных полигонах. В настоящее время для очистки сточных вод предлагают использовать химические осадители. Данный класс реагентов представляет собой соединения с привитыми комплексообразующими группами, которые образуют с растворёнными в воде ионами металлов прочные связи. Комплексообразователь с захваченными ионами металлов выпадает в осадок, образуя достаточно крупные хлопья, удаляемые в процессе отстаивания или фильтрации. В качестве осадителя меди предлагают использовать натриевую соль меркапто-S-триазина, диметилдитиокарбамат натрия и политиокарбамат натрия/калия. Однако показано, что ни один из данных реагентов не позволяет достичь допустимых для сброса в городскую канализацию концентраций Сu2+. Наибольшая степень извлечения меди (76-85%) наблюдается при использовании в качестве осадителя диметилдитиокарбамата натрия. Кроме того, применение органических осадителей для очистки вызывает вторичное загрязнение, т.к. данные реагенты в воде разлагаются с образованием ряда токсичных побочных продуктов. [6] Ионный обменИонообменный метод очистки сточных вод основан на замене ионов-поллютантов, которые необходимо извлечь, на нейтральные. Для очистки применяют ионообменные смолы (иониты), получаемые методами сополимеризации и сополиконденсации органических мономеров ионного типа. Иониты представляют собой пористые гранулы величиной 0,2-2 мм, практически нерастворимые в воде, в которых содержатся функциональные группы для извлечения ионов. Эти группы могут быть катионообменные или анионоообменные для извлечения катионов и анионов соответственно. Ионообменные методы регенерации позволяют не только достигать допустимых концентраций, но также получать продукты регенерации в виде чистых солей металлов, пригодных для повторного использования в производстве. Кроме того, очищенная вода в большинстве случаев без дополнительной обработки может быть снова использована в замкнутых системах водооборота предприятий. [6] С экономической точки зрения наиболее целесообразна ионообменная очистка не общего стока гальванического производства, а промывных вод, образующихся в отдельных технологических процессах. Даже при такой организации системы очистки большинство используемых на практике катионитов характеризуются недостаточной селективностью по отношению к меди. Так ёмкость наиболее распространенного катионита КУ−2-8 по меди при извлечении её из шахтных вод в сотни раз уступает сорбируемости из них щелочноземельных элементов − кальция и магния. Статическая обменная ёмкость по меди составляет 0,063 ммоль∙экв/г, а по кальцию и магнию − 2,05 и 1,45 ммоль∙экв/г соответственно. В связи с этим метод ионного обмена не нашёл широкого практического применения для очистки сточных вод с высоким солевым фоном. Повысить селективность извлечения можно с помощью композиционных сорбентов катионит-гидроксид железа. Так, например, статическая обменная ёмкость композиционного сорбента на основе катионита КУ-2-8 и гидроксида железа (III) составляет 1,85 ммоль∙экв/г. Однако в настоящее время отсутствует широкое промышленное производство данных материалов, что ограничивает их использование в очистке сточных вод. Кроме того, метод ионного обмена имеет ещё ряд недостатков: необходимость предварительной очистки сточных вод от масел, растворителей и других органических веществ, высокая стоимость смол, громоздкость оборудования и сложность его эксплуатации. [6] Мембранная фильтрацияПреимуществами мембранных технологий являются возможности очистки до допустимых концентраций и утилизации ценных компонентов. Тем не менее данная группа методов не находит широкого промышленного применения для очистки сточных вод. К недостаткам следует отнести необходимость предварительной очистки воды от грубодисперсных примесей, дефицитность и дороговизна мембран, сложность эксплуатации, чувствительность мембран к изменению параметров очищаемых стоков. Среди мембранных методов наиболее востребованными являются баромембранные процессы, в которых перенос вещества происходит под действием разности давлений. В их число, прежде всего, входят ультрафильтрация, обратный осмос. Сравнительно недавно арсенал баромембранных методов пополнила промежуточная между ультрафильтрацией и обратным осмосом нанофильтрация. Обратноосмотические мембраны содержат самые узкие поры (менее 10-10м), потому задерживают 97-99 % всех растворенных веществ, пропуская лишь молекулы воды, растворенных газов и легких минеральных солей. Особое место среди методов мембранного разделения занимает электродиализ – разновидность электролиза, основанная на избирательном переносе ионов через мембраны под действием постоянного электрического тока. Показана возможность практического применения мембранного электролиза (электродиализа) для очистки сточных вод и регенерации отработанных растворов. Обратный осмос и электродиализ являются наиболее перспективными методами для создания замкнутых водооборотных циклов. ФлотацияМетод основан на в образовании флотокомплексов «частица – пузырек воздуха», всплывании – «флотации» таких комплексов на поверхность жидкости и удалении с поверхности жидкости образовавшегося пенного слоя. Показана возможность использования флотации растворённым воздухом для извлечения ионов меди (II). При этом степень извлечения довольно высока (около 85%). При прохождении пузырьков воздуха через раствор образуются агломераты более низкой плотности по сравнению с водной средой, которые могут быть легко удалены. Для флотационной очистки сточных вод гальванических производств от Cu2+ в качестве осадителя и флотационного собирателя ионов тяжелых металлов может использоваться водный раствор 60%-ного хозяйственного мыла. Концентрация тяжелых металлов снижается до норм, установленных ГОСТом к технической воде второй категории (0,3 мг/дм3). Недостатками этого способа является большой расход реагента, недостаточная очистка, большие энергозатраты. Авторы предлагают использовать в качестве флотореагента техническую смесь гидразидов высших карбоновых кислот (ГКК) общей формулы CnH2n+1CONHNH2, где n = 6-8, которую вводят в сточные воды в виде 0,5%-ной водной эмульсии, приготовленной с добавлением соляной кислоты в эквимолярном соотношении. Данный способ также обеспечивает степень очистки воды от тяжелых металлов до норм, отвечающих требованиям, предъявляемым ГОСТом 9.314-90 к технической воде второй категории, что позволяет ее повторно использовать в процессах промывки гальванопроизводства. Распространен метод удаления ионов тяжелых металлов из сточных вод сульфигидрильными собирателями, такими, как ксантогенаты, дитиофосфаты, тиокарбаматы, диалкилдитиофосфаты, первичные алифатические амины, алкиларилсульфокислоты, додецилбензосульфонат натрия. Эффективность очистки с применением данных реагентов достаточно высока, средняя остаточная концентрация ионов меди (II) составляет 0,1 мг/дм3. Осадительная флотация ионов металлов из водных растворов обычно осуществляется путем добавления гидроксида натрия, в результате чего происходит осаждение металлов в виде гидроксидов с последующей их флотацией. Установлено, что гидроксид меди (II) может быть сфлотирован как анионными, так и катионными собирателями. Наиболее эффективными оказались жирные кислоты, алифатические первичные амины и диамины, содержащие 12–14 атомов углерода в углеводородной цепи. Во всех случаях оптимальным для флотации гидроксида меди (II) является интервал рН 7 ÷ 8. Таким образом, флотация – как метод очистки сточных вод – характеризуется высокой эффективностью, простотой, хорошей сочетаемостью с другими методами очистки. Однако широкое распространение данного метода тормозится тем, что ассортимент реагентов ограничен солями высших жирных кислот, сульфгидрильными и азотсодержащими соединениями, которые являются дорогостоящими и токсичными веществами. Методы регенерации этих реагентов практически не разработаны. [6] Электрохимические методыПреимуществами электрохимических методов очистки являются упрощенная технологическая схема при эксплуатации установок; легкая автоматизация их работы; меньшие производственные площади, необходимые для размещения очистных сооружений; возможность обработки сточных вод без их предварительного разбавления, отсутствие вторичного загрязнения воды. К недостаткам следует отнести существенные затраты электроэнергии и необходимость предварительной очистки от грубодисперсных примесей. Очистка сточных вод электрокоагуляцией основана на их электролизе с использованием металлических (стальных, алюминиевых) анодов, подвергающихся электролитическому растворению. Вследствие растворения анодов вода обогащается соответствующими ионами, образующими затем в нейтральной и слабокислой средах гидроксид железа (II), переходящих под воздействием кислорода в гидроксид железа (III), действующий в качестве коагулянта. Данный способ обеспечивает высокую степень очистки 90-95%. Недостатками являются большие затраты электроэнергии и металлов (алюминия, железа), высокие выходы по току, необходимость дополнительных устройств для преобразования переменного тока в постоянный. Известен способ очистки воды от ионов металлов путем электролиза с использованием нерастворимых электродов при наложении переменного синусоидального напряжения. Главный недостаток данного способа - невысокая степень очистки (извлечение ионов Cu2+ составляет 34%) и значительные энергозатраты (1,5-2 (кВт·ч)/м3). При электрофлотации очистка воды происходит с помощью пузырьков газа, образующихся при электролизе воды. На аноде возникают пузырьки кислорода, а на катоде – водорода. Процесс очистки осуществляется введением в сточные воды щелочного реагента до рН 9,5-10,0. В результате образуются труднорастворимые в воде соединения металлов, которые удаляются путём последовательного осуществления процессов электрофлотации и фильтрования. Остаточное содержание ионов меди в растворе составляет 0,11 мг/дм3, степень очистки – 73,2%. Электроосаждение является эффективным методом очистки сточных вод, дающим возможность выделения металла из раствора на электроде. Электролитическое извлечение меди из низкоконцентрированных растворов затруднено диффузными ограничениями тока. В настоящее время эта проблема решается применением объемно-пористых электродов, таким образом, достигается практически 100% извлечение меди. Однако широкого практического применения методы электрооосаждения пока не находят, в частности из-за дороговизны и дефицитности анодов. [6] ЗаключениеНаиболее важной проблемой, которая требует неотложного решения, является защита водных ресурсов от истощения и загрязнения. В России широко осуществляются мероприятия, направленные на очистку производственных сточных вод. К сожалению, универсального метода очистки вод предприятий не существует. Чаще всего приходится подбирать для каждого свою технологию и оборудование. В химической промышленности большое внимание уделяется эффективности очистки сточных вод, поэтому намечено направление широкого внедрения малоотходных и безотходных технологических процессов. Важной экологической проблемой является загрязнение поверхностных вод ионами тяжелых металлов, токсическое воздействие которых на живые организмы приводит к нарушению протекания ферментативных реакций. Сточные воды электрохимических производств, имеющихся практически на каждом предприятии машино- и приборостроения, – основной источник поступления тяжелых металлов в водоёмы. Реагентные технологии, несмотря на появление альтернатив, модернизируют и продолжают применять в современных схемах очистки как первую ступень. В создании новых, более эффективных и дешевых реагентных методов заинтересованы, в первую очередь, предприятия со средними финансовыми возможностями. Поэтому исследования в этой области направлены на повышение качества очистки путем вовлечения в процесс отходов других производств и на получение осадков в виде конечных продуктов с известной сферой применения, то есть на создание замкнутых технологических циклов. Список литературы
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
