ЛР1 дор. Химические свойства кислот, оснований, солей
 Скачать 176.66 Kb. Скачать 176.66 Kb.
|
|
МИНОБРНАУКИ РОССИИ Санкт-Петербургский государственный электротехнический университет «ЛЭТИ» им. В.И. Ульянова (Ленина) Кафедра физической химии отчет по лабораторной работе №_1 по дисциплине «Химия» Тема: Химические свойства кислот, оснований, солей
Санкт-Петербург 2018 1. ХИМИЧЕСКИЕ СВОЙСТВА ОКСИДОВ И ОСНОВАНИЙ Цель работы. Цели работы: ознакомление с методами получения оснований и изучение их химических свойств. Основные теоретические положения. Оксиды – химические соединения, состоящие из двух элементов, один из которых кислород в степени окисления «-2». Оксиды делятся на солеобразующие и несолеобразующие. Последних довольно мало (СО, NO, N2O), они не образуют солей ни с кислотами, ни со щелочами. Солеобразующие оксиды делятся на основные, кислотные и амфотерные. 2. ПОЛУЧЕНИЕ КИСЛОТ, СОЛЕЙ И ИЗУЧЕНИЕ ИХ ХИМИЧЕСКИХ СВОЙСТВ Цель работы: ознакомление с некоторыми способами получения кислот, солей и с их химическими свойствами. Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются ионы водорода (Н+ ) и анионы кислотных остатков 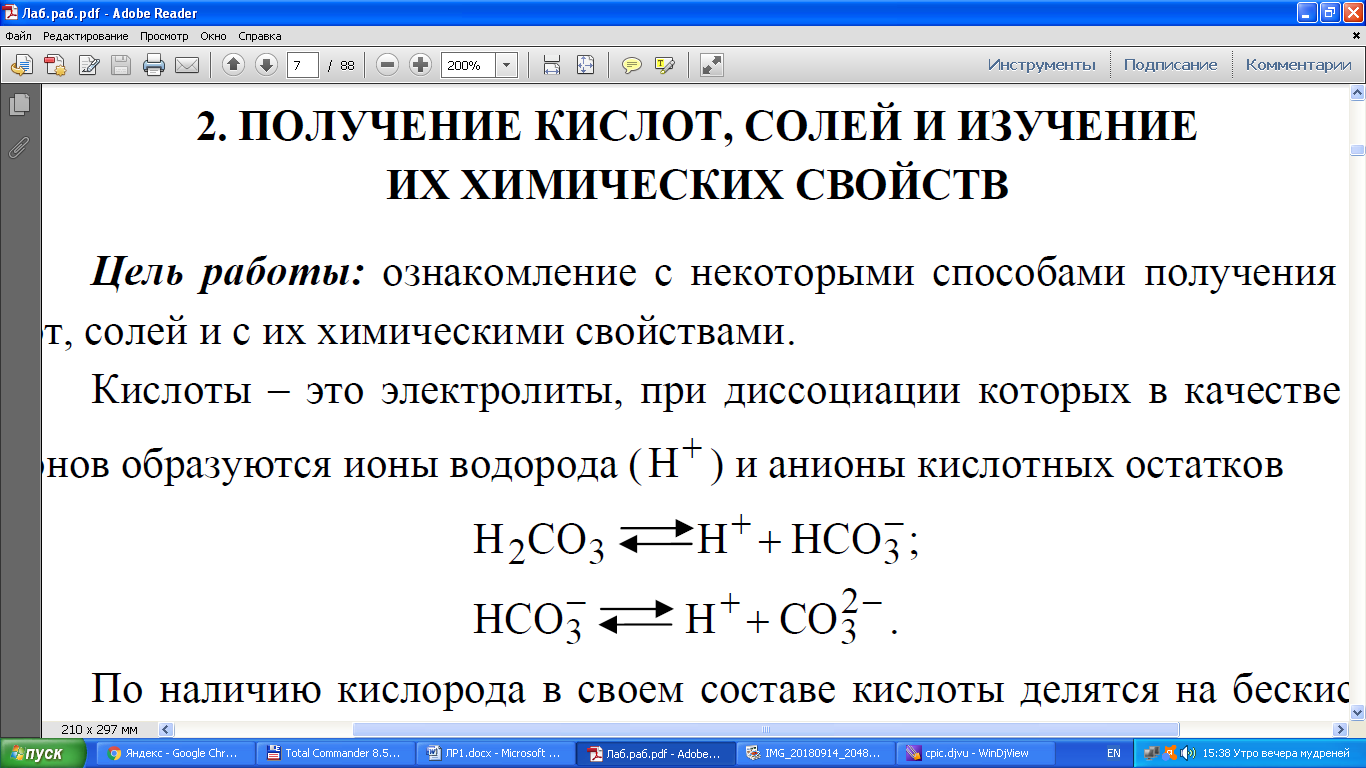 По наличию кислорода в своем составе кислоты делятся на бескислородные (например, HCl, HBr, H2S) и кислородосодержащие (например,HNO3, H2SO4, H3PO4 ). В растворах кислот индикаторы меняют свою окраску: лакмус становится красным. Кислоты взаимодействуют с металлами, стоящими левее водорода в электрохимическом ряду напряжений (ряд активностей металлов), образуют соли и выделяют водород: 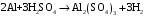 Водород не выделяется при взаимодействии металлов с азотной и кон-центрированной серной кислотами. Кислоты реагируют с основными оксидами и основаниями, образуя соль и воду. Соли – электролиты, при диссоциации которых образуются катионы основных остатков и анионы кислотных остатков. Соли делятся на средние, кислые и основные. Средние соли, например Na2CO3, K2SO4, Ca3(PO4)2 ,можно рассматривать как продукты полного замещения катионов водорода в кислоте катионами металла или как продукты полного замещения гидроксо- групп основания кислотными остатками. Протокол наблюдений 1.12 Пробирку с раствором сульфата меди(II) добавили избыток гидроксида натрия. Получили, студенистый осадок голубого цвета. Аналогичные опыты с растворами солей железа(III) Получили выпадение густого оранжевого осадка. Аналогичные опыты с растворами марганца(II). Выпал студенистый белый осадок. 1.14 В пробирку с 6-8 каплями раствора щелочи прибавить 2-3 капли фенолфталеина. Раствор стал красно-фиолетового цвета. Добавили по каплям раствор кислоты до исчезновения окраски индикатора. Цвет раствора стал молочным. 1.16 Получили осадок гидроксида никеля(II), прибавляя к 2-3 каплям раствора соли никеля(II) избыток раствора щелочи. Испытали действие кислоты на полученный осадок. Получили студенистый осадок бирюзового цвета. После добавления кислоты осадок растворился и обесцветился. Стал светло зелёного цвета. 1.18 В две пробирки поместил по 5 капель раствора соли цинка. Добавляя по каплям раствор NaOH до образования осадка. К полученному в первой пробирке осадку прибавили раствор кислоты, к осадку во второй пробирке– избыток раствора щелочи. Выпал осадок белого цвета. После добавления кислот осадок обесцветился и растворился. После добавления щёлочи осадок обесцветился и растворился. 1.9 Повторили опыт 1.18, используя в качестве реактива растворы солей алюминия и хрома(III). При смешении даёт мутный осадок зелёного цвета. После добавления кислот, в обоих случаях осадок исчез. 2.5 Испытать действие соляной или серной кислоты на осадки гидроксидов меди(II) и марганца(II), предварительно получив их в двух пробирках реакцией обмена между растворами солей меди(II), марганца(II) и Na(OH). В первом случае голубой осадок обесцветился и исчез. Во втором случае Белый осадок обесцветился и исчез. 2.8 В двух пробирках испытали действие растворов: сульфата натрия на хлорид бария, хлорида кальция на карбонат натрия. В первом случае получили осадок молочного цвета. Во втором случае получили белый мутный осадок. 2.12 К раствору хлорида кобальта(II) добавили по каплям раствор гидроксида натрия до образования синего осадка, который является густым и скапливается на стенках пробирки. 2.13 Осадок, полученный в опыте 2.12, разделили на две порции, и поместили в пробирки. К одной порции добавили раствор щелочи до изменения цвета осадка, к другой - раствор хлористоводородной кислоты до его растворения. В первом раствор стал прозрачным, а осадок растворился. Во втором случае раствор приобрёл розовый оттенок. Обработка результатов Опыт № 1.12 CuSO4+2NaOH→Cu(OH)2+Na2SO4 Cu2+ + SO42-+ 2Na+ +2OH-→Cu(OH)2↓+2Na++SO42- Cu2++2OH-→Cu(OH)2↓ Fe2(SO4)3 + 6NaOH→2Fe(OH)3↓+3Na2SO4 2Fe3+ + 3SO42-+ 6Na+ + 6OH- →2Fe(OH)3↓+3Na+ + 3SO42- 2Fe3+ +6OH-→2Fe(OH)3↓ MnSO4+2NaOH→Mn(OH)2↓+Na2SO4 Mn2+ + SO42-+ 2Na+ + 2OH- → Mn(OH)2↓+2Na+ + SO42- Mn2+ + 2OH- → Mn(OH)2↓ Опыт № 1.14 NaOH + ФЕНОЛФТАЛЕИН → становится малиновым Раствор фенолфталеина и NaOH + HCL → NaOH+HCl→NaCl+H2O Опыт № 1.16 NiSO4+2NaOH→Ni(OH)2↓+Na2SO4 Ni2+ + SO42- + 2Na++ 2OH-→Ni(OH)2↓+2Na+ + SO42- Ni2+ + 2OH-→Ni(OH)2↓ Ni(OH)2 + 2HCl→NiCl2+2H2O Ni2++2(OH)- + 2H+ + 2Cl- → Ni2++2Cl-+ 2H2O 2(OH)- +2H+→ 2H2O Опыт № 1.18 ZnSO4+2NaOH→Zn(OH)2↓+Na2SO4 Zn2+ + SO42-+2Na++ 2OH- →Zn(OH)2↓+2Na+ + SO42- Zn2++ 2OH- →Zn(OH)2↓ Zn(OH)2↓+2HCl→ZnCl2+2H2O Zn+2+2(OH)- + 2H+ + 2Cl- →Zn2++2Cl-+ 2H2O 2H++ 2OH- →2H2O Zn(OH)2↓+2NaOH→Na2[Zn(OH)4] Zn+2+2(OH)- +2Na+ + 2OH-→ 2Na++[Zn(OH)4]2- ↓ Zn2++2OH-+2OH-→[Zn(OH)4] ↓ Опыт № 1.19 Cr2(SO4)3 + 6NaOH →2Cr(OH)3 + 3Na2SO4 2Cr3+ + 3SO2-4 + 6Na+ +6OH- → 2Cr(OH)3↓+6Na+ + 3SO42- 2Cr3++6OH- → 2Cr(OH)3 Cr(OH)3↓+3HCl→Cr(Cl)3+3H2O Cr3++3(OH)-+3H+ + 3Cl- →Cr3+ +3Cl- + 3H+2O2- 3H++3(OH)- → 3H2O Cr(OH)3↓+3NaOH→Na3[Cr(OH)6] Cr3++3(OH)-+3Na+ + 3(OH)-→3Na+ +[Cr(OH)6]3- Cr3++3(OH)- + 3(OH)-→ [Cr(OH)6] Опыт №2.5 CuSO4+ 2NaOH→ Cu(OH)2↓+Na2SO4 Cu2++SO42-+2Na++2OH-→Cu(OH) 2↓+2Na++SO42- Cu2++2OH-→ Cu(OH) 2↓ Cu(OH)2↓+2HCl→CuCl2+2H2O Cu2++2(OH)-+2H++2Cl-→Cu2++2Cl-+2H2O 2(OH)-+2H+→2H2O MnSO4+2NaOH→Mn(OH)2↓+Na2SO4 Mn2++SO42-+2Na++2OH-→Mn(OH)2↓+2Na++SO42- Mn2++ 2OH-→ Mn(OH)2↓ Mn(OH)2↓+2HCl→MnCl2+2H2O Mn2++2(OH)-+2H++2Cl-→Mn2++2Cl-+2H2O 2OH-+2H+→ 2H2O Опыт №2.8 Na2SO4+BaCl2→2NaCl+BaSO4↓ 2Na+ + SO42- + Ba2+ + 2Cl- →2Na+ + 2Cl- + BaSO4↓ SO42- + Ba2+→ BaSO4↓ CaCl2+Na2CO3→2NaCl + CaCO3↓ Ca2+ + 2Cl- + 2Na+ + Co32- →2Na+ + 2Cl- + CaCO3↓ Ca2++ Co32-→ CaCO3↓ Опыт № 2.12 CoCl2+NaOH→NaCl+Co(OH)Cl Co2+ + 2Cl- + Na+ + OH- →Na+ + Cl- + Co(OH)Cl Co2++ Cl-+ OH- → Co(OH)Cl Опыт №2.13 Co(OH)Cl+ NaOH→Co(OH)2↓+NaCl Co2++OH- + Cl- +Na+ + OH-→Co(OH)2↓+Na++Cl- Co2+ + 2OH-→Co(OH)2↓ Co(OH)Cl+HCl→CoCl2+H2O Co2++OH- + Cl- +H+ + Cl- →Co2+ + 2Cl- + H2O OH-+H+ →H2O Вывод В ходе лабораторной работы были проведены опыты с основными видами веществ: -основания -кислоты В результате был получен опыт при получении тех или иных веществ, изучены их основные свойства, а также изучены и закреплены основные методы тестирования веществ, на предмет идентификации. Также в работе были проведены опыты по нейтрализации кислот основаниями. |
