сессия. 1 курс. Химия наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях. Задачи
 Скачать 257.43 Kb. Скачать 257.43 Kb.
|
|
1 Химия— наука о строении, свойствах веществ, их превращениях и сопровождающих явлениях. Задачи: • изучение веществ, их свойств и прогнозирование использования веществ в народном хозяйстве; • получение различных веществ, необходимых в народном хозяйстве; • разработка и использование новых источников энергии; • охрана окружающей среды; • освоение органических и неорганических источников сырья. Причины многообразия органических и неорганических в-в: Аллотропия-явление существования химического элемента в виде нескольких простых веществ Различное строение углеродного скелета Различные функциональные группы Различные виды изомерии Способность атомов углерода соединяться в цепи различной длины. Изотопия элементов и их соединений Применение: В сельском хозяйстве — производство минеральных удобрений, пищевых добавок к кормам, защита от вредителей и т.д. В легкой промышленности — получение новых материалов, лаки, краски и т.д. В тяжёлой промышленности — получение металлов из руд и их использование. В пищевой промышленности — получение пищевых добавок, красителей, консервантов, ароматических добавок и т.д. Продукты, используемые в повседневной жизни: а) краски — лаки, клей, чистящие и моющие средства... б) синтетические и искусственные материалы: капрон, лавсан, пластмассы... в) сахара-заменители (в жвачках без сахара); вкусовые, ароматические, красящие добавки (сухие соки и лимонады, колбасы, конфеты) ... г) лекарства. 2 Полимеризация-химический процесс образования высокомолекулярных соединений (полимеров) из низкомолекулярных (мономеров), причем образующиеся полимеры имеют тот же элементарный состав, что и исходные мономеры. Полимерами называют вещества, молекулы которых состоят из множества повторяющихся структурных звеньев, соединенных между собой химическими связями. Мономер - низкомолекулярное вещество, используемое для получения полимера. Структурное звено - многократно повторяющаяся в макромолекуле группа атомов. Степень полимеризации - число структурных звеньев в макромолекуле. 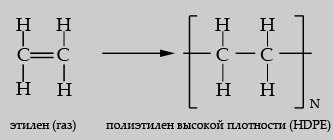 Рисунок 1. Уравнение получения полиэтилена Классификация полимеров В зависимости от молекулярной массы (ММ), полимеры делятся на: — мономеры (с небольшой ММ); — олигомеры (с ММ менее 540); — полимеры (высокомолекулярные, с ММ от пяти тысяч до пятисот тысяч); — сверхвысокомолекулярные полимеры с ММ более полумиллиона. По степени разветвленности молекул: — линейные (молекула состоит из цепочки мономеров), к ним относится натуральный каучук, эластомеры и другие полимеры высокой эластичности; — разветвленные (цепочка из звеньев имеет боковые ответвления), например, амилопектин; — сетчатые или сшитые (между соседними макромолекулами существуют поперечные связи), нерастворимые и неэластичные полимеры, например, эпоксидные смолы в стадии отверждения. По составу мономеров: — гомополимеры, состоящие из одного вида звеньев, например, ПВХ, целлюлоза; — сополимеры, состоящие из звеньев разного строения (многие полимеры с улучшенными свойствами). В зависимости от того, как полимеры реагирует на нагревание, их разделяют на: — термопласты, после охлаждения возвращающиеся в исходное состояние без потери физических свойств (этими качествами обладают линейные и разветвленные полимеры); — реактопласты, после нагревания частично и необратимо разрушаются и не восстанавливают исходных свойств (сетчатые пространственные полимеры). По структуре полимеры разделяют на: — кристаллические, содержащие более 2/3 кристаллических структур (полиэтилен низкого давления, полипропилен, тефлон); — аморфные, содержащие не более нескольких процентов кристаллических структур (акриловое стекло, полистирол и все сетчатые полимеры); — аморфно-кристаллические, содержащие от 25 до 70% кристаллических структур (полиэтилен высокого давления). По происхождению: — природные (белки, коллоидная сера, натуральный каучук, целлюлоза, крахмал); — синтетические (фенолформальдегидные смолы, полистирол). По химическому составу: — органические; — неорганические, не содержащие органических звеньев ни в главной цепи, ни в ответвлениях макромолекулы (пластическая сера, кристаллы кварца); — элементоорганические, макромолекулы которых состоят из углеводородных групп и неорганических звеньев (кремний-, боро-, фосфорорганические полимеры и др.). 3 Атом — мельчайшая, химически неделимая, электронейтральная частица вещества. Состоит из ядра и электронной оболочки. Молекула — наименьшая частица вещества, сохраняющая его химические свойства. Состоит из атомов. Ионы (от греч. ion – идущий), одноатомные или многоатомные частицы, несущие электрический заряд. Химический элемент - определённый вид атома, имеющий название, порядковый номер, и положение в таблице Менделеева называют химическим элементом. Аллотропия - это способность некоторых химических элементов существовать в виде двух или нескольких простых веществ, различных по строению и свойствам. Простое вещество - вещество, состоящее из атомов одного химического элемента: водород, кислород и т.д. Сложное вещество - вещество, состоящее из атомов разных химических элементов: кислоты, вода и др. Смесь — физико-химическая система, состоящая из нескольких химических соединений. Способы разделения смесей
Физические явления - новые вещество не образуется. Химические явления - новые вещество образуется. Относительная атомная масса. Относительной атомной массой элемента называют отношение абсолютной массы атома к 1/12 части абсолютной массы атома изотопа углерода 12С. Обозначают относительную атомную массу элемента символом Аr, где r - начальная буква английского слова relative (относительный). Относительная молекулярная масса. Относительной молекулярной массой Мr называют отношение абсолютной массы молекулы к 1/12 массы атома изотопа углерода 12С. Молярная масса M вещества представляет собой отношение его массы к количеству вещества: где г - масса в граммах, n - количество вещества в молях, М - молярная масса в г/моль - постоянная величина для каждого данного вещества. Массовая доля элемента в данном веществе (w) – отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле к относительной молекулярной массе вещества. 4 Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп COOH. 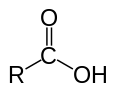 Общая формула одноосновных карбоновых кислот R—COOH. Общая формула одноосновных карбоновых кислот R—COOH.Карбоновые кислоты классифицируют по двум структурным признакам. По числу карбоксильных групп карбоновые кислоты делятся на одноосновные, двухосновные и т.д. По типу радикала карбоновые кислоты делятся на предельные (например, уксусная кислота CH3COOH), непредельные [например, акриловая кислота CH2=CH—COOH, олеиновая CH3—(CH2)7—CH=CH—(CH2)7—COOH] и ароматические (например, бензойная C6H5—COOH). Физические свойства Низшие кислоты с числом атомов углерода до 3 — легкоподвижные бесцветные жидкости с характерным резким запахом, смешиваются с водой в любых соотношениях. Большинство кислот с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом. Кислоты с большим количеством атомов углерода — твёрдые вещества, нерастворимые в воде. Номенклатура. В основе названий карбоновых кислот лежат названия соответствующих углеводородов. Наличие карбоксильной группы отражается окончанием -овая кислота. Низшие карбоновые кислоты часто имеют тривиальные названия: муравьиная, уксусная, масляная и др. Углеводородную цепь нумеруют, начиная с атома углерода карбоксильной группы, например: 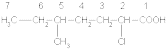 2-хлор-5-метилгептановая кислота 5 Типы химических реакций
Любая химическая реакция заключается в разрыве старых и образовании новых химических связей. Вероятность протекания того или иного процесса определяется законами термодинамики, а скорость реакции – законами химической кинетики. Важным при изучении химических реакций является и обратимость процесса. Закон Гесса Формулировка закона Тепловой эффект реакции не зависит от промежуточных стадий и определяется только начальным и конечным состоянием системы. Следствия закона Гесса Следствие 1. Тепловой эффект разложения какого-либо соединения равен, но противоположен по знаку тепловому эффекту образования этого соединения.  Нразложения = - Нразложения = - Нобразования НобразованияСледствие 2. Если две реакции имеют одинаковое начальное состояние и разные конечные, то разность их тепловых эффектов равна тепловому эффекту перехода из одного конечного состояния в другое. 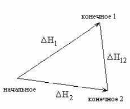  Н12 = Н12 =  Н2- Н2- Н1 Н1Следствие 3. Если две реакции из различных начальных состояний приходят к одному конечному, то разность их тепловых эффектов равна тепловому эффекту перехода из одного начальное состояние в другое. 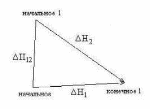  Н12 = Н12 =  Н1- Н1- Н2 Н2Следствие 4. Тепловой эффект реакции равен алгебраической сумме теплот образования продуктов реакции минус алгебраическая сумма теплот образования исходных веществ.  6 Этилен (этен) – первый представитель гомологического ряда алкенов (непредельные углеводороды с одной двойной связью). 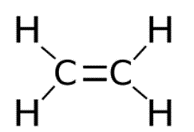 Физические свойства этилена.
Химические свойства. Галогенирование: 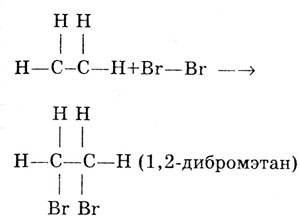 Происходит обесцвечивание бромной воды. Это качественная реакция на непредельные соединения. Гидрирование: 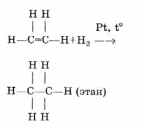 Гидрогалогенирование: 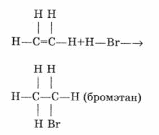 Гидратация: 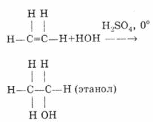 Эту реакцию открыл A.M. Бутлеров, и она используется для промышленного получения этилового спирта. Окисление: Этилен легко окисляется. Если этилен пропускать через раствор перманганата калия, то он обесцветится. Эта реакция используется для отличия предельных и непредельных соединений. 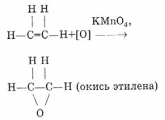 Окись этилена — непрочное вещество, кислородный мостик разрывается и присоединяется вода, в результате образуется этилен-гликоль: 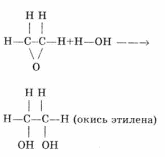 Горение 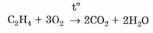 Получение этиленаСпособы получения этилена можно разделить на промышленные и лабораторные. В первом случае этен – это продукт дегидрирования этана, полученного при крекинге нефти. В лабораторных условиях этилен можно получить при помощи дегидратации этанола (1), дегалогенированиямоно- и дигалогенпроизводных этана (2, 3) или при неполном гидрировании ацетилена: CH3-CH2-OH→CH2=CH2 + H2O (H2SO4 (conc), to = 170) (1); CH3-CH2-Br + NaOHalcohol→CH2=CH2 + NaBr + H2O (to) (2); Cl-CH2-CH2-Cl + Zn(Mg) →CH2=CH2 + ZnCl2(MgCl2) (3); CH≡CH + H2→CH2=CH2 (Pd, to) (4). Применение этиленаОсновное направление использование этилена — промышленный органический синтез таких соединений как галогенопроизводные, спирты (этанол, этиленгликоль), уксусный альдегид, уксусная кислота и др. Кроме этого данное соединение в производстве полимеров. 7 Оксиды – сложные вещества, состоящие из атомов двух химических элементов, одним из которых является кислород в степени окисления -2. Общая формула оксидов: ЭхОу Классификация оксидовВсе оксиды, по способности образовать соли, можно разделить на две группы: Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.) Несолеобразующие оксиды (CO, N2O,SiO, NO и т. д.) В свою очередь, солеобразующие оксиды подразделяют на 3 группы: Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д) Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д) Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV, а так же ZnO, BeO, SnO, PbO) Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам: 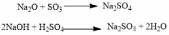 Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства: 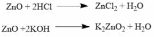 Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность. CO2 – оксид углерода (IV) N2O3 – оксид азота (III) Получение оксидовБольшинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом: 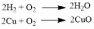 При обжиге или горении различных бинарных соединений: 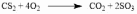 Термическое разложение солей, кислот и оснований : 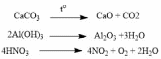 Взаимодействие некоторых металлов с водой: 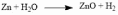 8 Бензол – это бесцветная жидкость с характерным запахом; температура кипения 80,1oС, температура плавления 5,5oС. Не растворим в воде, токсичен. 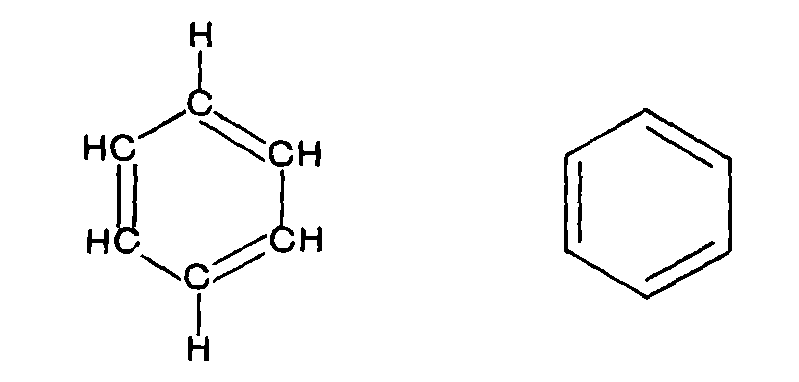 Физические свойства бензола. Бензол – бесцветная, летучая, огнеопасная жидкость с неприятным запахом. Он легче воды ( =0,88 г/см3) и с ней не смешивается, но растворим в органических растворителях, и сам хорошо растворяет многие вещества. Бензол кипит при 80,1 С, при охлаждении легко застывает в белую кристаллическую массу. Бензол и его пары ядовиты. Систематическое вдыхание его паров вызывает анемию и лейкемию. Химические свойства бензола Для бензола характерны реакции замещения, протекающие по электрофильному механизму: -галогенирование (бензол взаимодействует с хлором и бромом в присутствии катализаторов – безводных AlCl3, FeCl3, AlBr3) C6H6 + Cl2 = C6H5-Cl + HCl; — нитрование (бензол легко реагирует с нитрующей смесью – смесь концентрированных азотной и серной кислот) 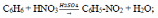 — алкилирование по Фридею-Крафтсу 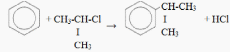 — алкилирование алкенами C6H6 + CH2=CH-CH3 → C6H5-CH(CH3)2 Реакции присоединения к бензолу приводят к разрушению ароматической системы и протекают только в жестких условиях: — гидрирование (продукт реакции — циклогексан) C6H6 + 3H2→ С6H12 (toC, kat = Pt); — присоединение хлора (протекает под действием УФ-излучения с образованием твердого продукта – гексахлорциклогексана (гексахлорана) – C6H6Cl6) C6H6+ 6Cl2→C6H6Cl6. Получение бензола К основным способам получения бензола относятся: — дегидроциклизация гексана (катализаторы – Pt, Cr3O2) CH3 –(CH2)4-CH3 → C6H6 + 4H2↑ (toC, p, kat = Cr2O3); — дегидрированиециклогексана C6H12 → C6H6 + 3H2↑ (toC, kat = Pt, Ni); — тримеризация ацетилена (реакция протекает при нагревании до 600oС, катализатор – активированный уголь) 3HC≡CH → C6H6 (t = 600oC, kat = Сactiv). Применение бензола Бензол широко используется в промышленной органической химии. Практически все соединения, имеющие в своем составе бензольные кольца, получаются из бензола, например, стирол, фенол, анилин, галогензамещенные арены. Бензол используется для синтеза красителей, поверхностно-активных веществ, фармацевтических препаратов. Воздействие на организм человека Бензол высокотоксичен. При отравлении его парами обычно наблюдаются учащенное сердцебиение, сонливость, головокружение, головные боли, тремор и прочие симптомы отравления. 9 Основание (химия) Основание — сложное вещество, которое состоит из атома металла или иона аммония и гидроксогруппы (−OH). Общая формула оснований – Ме(ОН)х Получение Основания получают различными способами. Самый простой – взаимодействие металла с водой: Ba + 2H2O → Ba(OH)2 + H2. Щёлочи получают в результате взаимодействия оксида с водой: Na2O + H2O → 2NaOH. Нерастворимые основания получаются в результате взаимодействия щелочей с солями: CuSO4 + 2NaOH → Cu(OH)2↓+ Na2SO4. Классификация В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают: основные гидроксиды (основания) — только гидроксиды металлов со степенью окисления +1, +2, проявляющие основные свойства (например, гидроксид кальция {\displaystyle {\ce {Ca(OH)2}}}, гидроксид калия {\displaystyle {\ce {KOH}}}, гидроксид натрия {\displaystyle {\ce {NaOH}}}и др.) При реакциях и диссоциации отщепляется группа {\displaystyle {\ce {-OH}}}. кислотные гидроксиды (кислородсодержащие кислоты) — гидроксиды неметаллов и металлов со степенью окисления +5, +6, +7, проявляющие кислотные свойства (например, азотная кислота {\displaystyle {\ce {HNO3}}}, серная кислота {\displaystyle {\ce {H2SO4}}}, сернистая кислота {\displaystyle {\ce {H2SO3}}}, марганцевая кислота {\displaystyle {\ce {HMnO4}}} и др.) При реакциях и диссоциации отщепляется протон. амфотерные гидроксиды, гидроксиды металлов со степенью окисления +3, +4 и нескольких металлов со степенью окисления +2, которые проявляют амфотерные свойства. Амфотерные гидроксиды проявляют в зависимости от условий либо основные, либо кислотные свойства (например, гидроксид алюминия {\displaystyle {\ce {Al(OH)3}}}, гидроксид цинка {\displaystyle {\ce {Zn(OH)2}}}). По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Химические свойства оснований Основания способны реагировать с кислотами и кислотными оксидами. В ходе взаимодействия происходит образование солей и воды: Ва(ОН)2 + СО2 → ВаСО3 + Н2О; КОН + HCl → KCl + Н2О. Щелочи, гидроксид аммония всегда реагируют с растворами солей, только в случае образования нерастворимых оснований: 2КОН + FeCl2 → 2КCl + Fe(ОН)2; 6NH4OH + Al2(SO4)3 → 2Al(OH)3 + 3(NH4)2SO4. Реакция кислоты с основанием именуется нейтрализацией. В ходе данной реакции, катионы кислот Н+ и анионы оснований ОН- образуют молекулы воды. После чего, среда раствора становится нейтральной. В результате начинается выделение тепла. В растворах, это ведет к постепенному нагреву жидкости. В случае крепких растворов, тепла более чем достаточно, чтобы жидкость начала кипеть. Необходимо помнить, что реакция нейтрализации происходит достаточно быстро. Химические свойства амфотерных гидроксидов Амфотерные основания реагируют и с кислотами и со щелочами. В ходе взаимодействия происходит образование соли и воды. При прохождении какой - либо реакции с кислотами, амфотерные основания всегда проявляют свойства типичных оснований: Cr(OH)3 + 3HCl → CrCl3 + 3H2O. В ходе реакции со щелочами, амфотерные основания способны проявлять свойства кислот. В процессе сплавления со щелочами, образуется соль и вода: Zn(OH)2 + 2NaOHрасплав → Na2ZnO2 + 2H2O. При взаимодействии с растворами щелочей, всегда будут образовываться комплексные соли: Zn(OH)2 + 2NaOHраствор → Na2[Zn(OН)4] или Zn(OH)2 + 2NaOH + H2O→ Na2[Zn(OН)4] + H2. 10 Особенности природного газа. 1. Основная составная часть природного газа – метан. 2. Кроме метана, в природном газе присутствуют этан, пропан, бутан. 3. Обычно чем выше молекулярная масса углеводорода, тем меньше его содержится в природном газе. 4. Состав природного газа различных месторождений неодинаков. Средний состав его (в процентах по объему) следующий: а) СН4 – 80–97; б) С2Н6 – 0,5–4,0; в) С3Н8 – 0,2–1,5. 5. В качестве горючего природный газ имеет большие преимущества перед твердым и жидким топливом. 6. Теплота сгорания его значительно выше, при сжигании он не оставляет золы. 7. Продукты сгорания значительно более чистые в экологическом отношении. 8. Природный газ широко используется на тепловых электростанциях, в заводских котельных установках, различных промышленных печах. Способы применения природного газа 1. Сжигание природного газа в доменных печах позволяет сократить расход кокса, снизить содержание серы в чугуне и значительно повысить производительность печи. 2. Использование природного газа в домашнем хозяйстве. 3. В настоящее время он начинает применяться в автотранспорте (в баллонах под высоким давлением), что позволяет экономить бензин, снижать износ двигателя и благодаря более полному сгоранию топлива сохранять чистоту воздушного бассейна. 4. Природный газ – важный источник сырья для химической промышленности, и роль его в этом отношении будет возрастать. 5. Из метана получают водород, ацетилен, сажу. Попутный нефтяной газ (особенности): 1) попутный нефтяной газ по своему происхождению тоже является природным газом; 2) особое название он получил потому, что находится в залежах вместе с нефтью – он растворен в ней и находится над нефтью, образуя газовую «шапку»; 3) при извлечении нефти на поверхность он вследствие резкого падения давления отделяется от нее. Способы применения попутного нефтяного газа. 1. Прежде попутный газ не находил применения и тут же на промысле сжигался. 2. В настоящее время его все в большей степени улавливают, так как он, как и природный газ, представляет собой хорошее топливо и ценное химическое сырье. 3. Возможности использования попутного газа даже значительно шире, чем природного; наряду с метаном в нем содержатся значительные количества других углеводородов: этана, пропана, бутана, пентана. Уголь – одна из аллотропных модификаций химического элемента углерода. Коксование, промышленный метод переработки природных топлив (главным образом каменного угля) путём нагревания до 950—1050 °С без доступа воздуха. Основной продукт К. — кокс. Кокс каменноугольный - твёрдый пористый продукт серого цвета, получаемый путём коксования каменного угля при температурах 950-1100°С без доступа кислорода. Кокс каменноугольный применяют для выплавки чугуна (доменный кокс) как высококачественное бездымное топливо, восстановитель железной руды, разрыхлитель шихтовых материалов. Кокс каменноугольный используют так же, как ваграночное топливо в литейном производстве (литейный кокс), для бытовых целей (бытовой кокс), в химической и ферросплавной отраслях промышленности (специальные виды кокса). |
