ХИТИН И ХИТОЗАН. Хитин распространение в природе Хитин
 Скачать 3 Mb. Скачать 3 Mb.
|
|
ХИТИН Распространение в природе Хитин – природный аминополисахарид. По распространенности в живой природе занимает второе место после целлюлозы. В организмах членистоногих (крабов, омаров, раков, криля и т.п.), насекомых (пчел, жуков и т.п.), клетках грибов и дрожжей, диатомовых водорослях хитин в комплексе с минеральными веществами, белками и меланинами образует внешний скелет и внутренние опорные структуры. Биосинтез хитина происходит в особых клеточных органеллах (хитосомах) с участием фермента хитинсинтетазы путем последовательного переноса остатков N-ацетил-D-глюкозамина из уридинфосфат-N-ацетил-D-глюкозамина на растущую полимерную цепь. Получение Наиболее доступным для промышленного освоения и масштабным источником получения хитина являются панцири промысловых ракообразных. Поскольку хитин не растворим в воде, то не поддается выделению из панциря напрямую. Для его получения необходимо последовательно отделить белковую и минеральную составляющие панциря, т.е. перевести их в растворимое состояние и удалить. Обобщенная схема получения хитина приведена на рис.1. 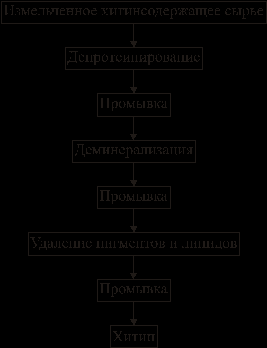 Рис.1. Этапы процесса получения хитина. Существует несколько способов извлечения хитина из хитинсодержащего сырья: химический, биотехнологический, электрохимический. Химический способ выделения хитина из панцирьсодержащего сырья заключается в проведении стадий депротеинирования, деминерализации и депигментации с помощью химических реагентов – кислот, щелочей, перекисей, поверхностно-активных веществ и т.д. Достоинства химического способа получения хитина: высокая степень депротеинирования и деминерализации полисахарида; относительная доступность недорогих реагентов; сравнительно небольшое время получения готового продукта. Недостатки: экологическая опасность из-за использования концентрированных реагентов и образования больших объемов кислотно-щелочных, солевых и органических стоков; необходимость использования достаточно концентрированных растворов химических реагентов, вызывающих ухудшение качества целевых продуктов, что обусловлено процессами деструкции хитина, гидролиза и химической модификации белка и липидов; использование коррозионно-стойкого оборудования; большой расход воды на технологические нужды и многократные промывки. Биотехнологический способ заключается в использовании ферментов для удаления остаточного белка и минеральных веществ. Используются ферменты и ферментные препараты микробиологического и животного происхождения. Достоинства биотехнологических способов депротеинирования и деминерализации хитина: используются "щадящие" условия, что позволяет сохранить в наибольшей степени нативные свойства хитина и белка, получаемые при этом белковые продукты практически не содержат хлорида натрия, присутствие которого неизбежно в случае применения кислотно-щелочных растворов; использование ряда ферментных препаратов делает возможным совмещение нескольких операций, что упрощает процесс; уменьшение, по сравнению с кислотно-щелочным способом, агрессивности реакционной среды, что, в свою очередь, снижает затраты на оборудование и увеличивает срок его службы; возможность осуществления производства хитина в судовых условиях непосредственно вместе вылова сырья. Однако биометоды не лишены существенных недостатков. Это невысокая степень депротеинирования хитина даже при применении нескольких последовательных обработок в свежеинокулированных ферментах, что связано с присутствием части белка в недоступной для протеолитических ферментов форме. Многостадийность и длительность обработки. Использование дорогостоящих ферментов или штаммов бактерий. Наконец, необходимость обеспечения стерильности производства. Электрохимический способ является альтернативой химическому и биотехнологическому способам, и позволяет в одном технологическом процессе получать хитин достаточно высокой степени очистки и ценные в пищевом отношении белок и липиды. Сущность технологии получения хитина заключается в проведении стадий депротеинирования, деминерализации и обесцвечивания панцирьсодержащего сырья в виде водно-солевой суспензии в электролизерах оригинальной конструкции под действием электромагнитного поля, направленного потока ионов и образующихся в результате электролиза воды Н+- и ОН-- ионов и ряда низкомолекулярных продуктов, обусловливающих кислую и щелочную реакцию среды и ее окислительно-восстановительный потенциал соответственно. К преимуществам электрохимической технологии получения хитина относятся: возможность получения в одном технологическом цикле всех ценных компонентов сырья с максимальным выходом при сохранении их биологических и функциональных свойств за счет щадящих условий обработки; исключение необходимости использования кислот, щелочей и ферментов, и, соответственно, снижение экологических нагрузок на окружающую среду; сокращение расхода пресной воды на промывки; интенсификация процесса; повышение износостойкости оборудования из-за отсутствия агрессивных сред; возможность оперативного изменения производительности и технологической схемы процесса; возможность получения широкого спектра производных хитина. Химическое строение и молекулярная структура Хитин представляет собой линейный гомополисахарид, неразветвленные цепи которого состоят из элементарных звеньев остатков 2-ацетамидо-2-дезокси-β-D-глюкопиранозы (N-ацетил-β-D-глюкозы), соединенных β-(1→4)-гликозидной связью (рис.2). 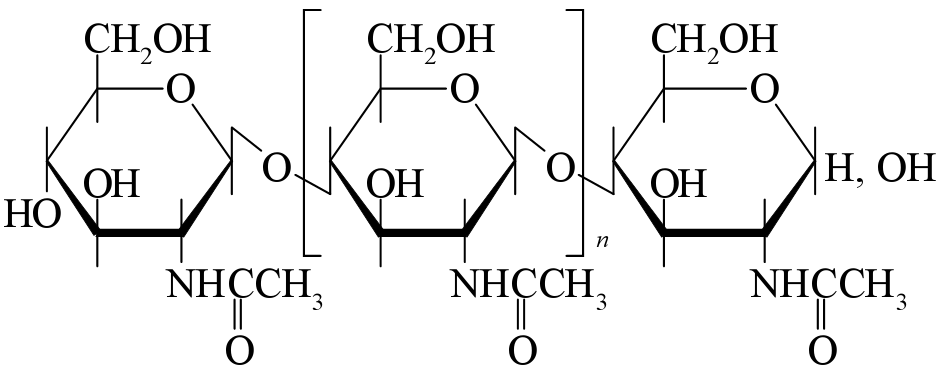 Рис.2. Структурная формула макромолекулы хитина. Имеется, таким образом, аналогия между строением хитина и целлюлозы (см. раздел «Целлюлоза»), однако в отличие от целлюлозы в качестве заместителя у второго углеродного атома элементарного звена имеется не гидроксильная, а ацетамидная группа. При этом макромолекулы нативного (природного) хитина обычно содержат небольшое количество звеньев со свободными первичными аминогруппами. Энергетически выгодной конформацией элементарного звена макромолекулы хитина является конформация кресла С1: 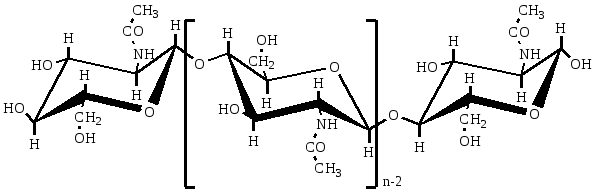 Хитин, выделенный из биомассы животного происхождения, в силу специфики получения не является однородным по химическому составу и строению. Поскольку хитин не встречается в природе в свободном состоянии, а находится в виде комплекса с различными соединениями (белками, минеральными составляющими и др.), то выделенный из сырья хитин содержит примесные количества этих веществ. Наиболее трудно удаляемым компонентом являются фрагменты белка, ковалентно связанного с хитином. Поэтому полученный в промышленных условиях хитин является, по существу, гликопротеином. Физические свойства Большая длина и ограниченная гибкость макромолекулы хитина являются предпосылками для образования сложных надмолекулярных структур в тканях живых организмов. Основным элементом такой структуры являются фибриллы – высокоориентированные агрегаты макромолекул диаметром 25-50 нм, в свою очередь состоящие из микрофибрилл диаметром 2.5-2.8 нм. Такая структура обеспечивает выполнение важной биологической функции армирования (повышения механической прочности) содержащих хитин тканей. Благодаря регулярности строения полимерной цепи хитина формируется высокоупорядоченная структура, обладающая признаками, характерными для кристаллического фазового состояния полимеров. При этом кристаллические области структуры хитина могут существовать в трех кристаллографических (структурных) модификациях, отличающихся расположением молекулярных цепей в элементарной ячейке кристаллита (полиморфные модификации). Наиболее распространенная модификация (присущая в основном хитину членистоногих, а также некоторых грибов) – α-хитин. Плотная упаковка макромолекул, характерная для элементарной ячейки α-хитина (рис.3), обеспечивается так называемым антипараллельным их расположением (противоположное направление атомов в расположенных рядом цепях). 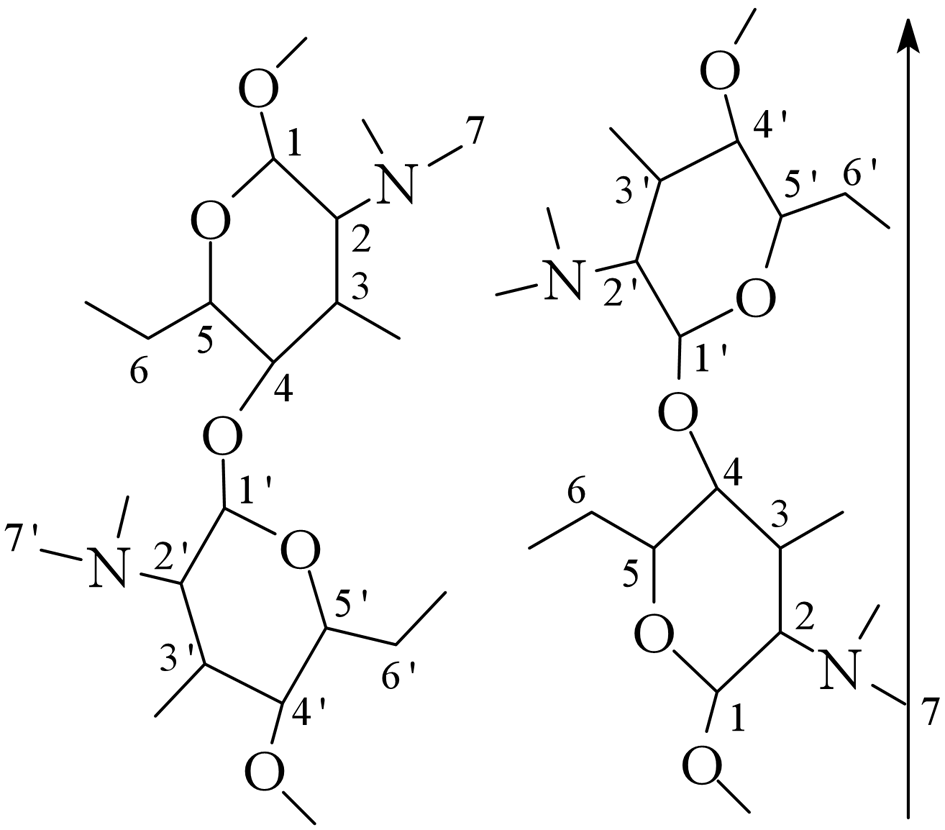 Рис.3. Взаимное расположение макромолекул в структурной модификации α-хитина β-Хитин существует в виде относительно неустойчивых кристаллогидратов с параллельным расположением цепей в элементарной ячейке. Наконец, в ячейке γ-хитина имеются две цепи, расположенные параллельно, и одна – антипараллельно по отношению к ним. При этом все три модификации могут существовать в одном организме, что указывает на различие в выполняемых ими биологических функциях. Специфика полимерного состояния хитина, как и других высокомолекулярных соединений, обусловливает невозможность существования этого полимера как однофазной системы (полная кристалличность). Однако содержание кристаллических областей в хитине достаточно велико и составляет в зависимости от происхождения и способа выделения 60-85%. При этом фиксация взаимного расположения макромолекул хитина обеспечивается системой внутри- и межмолекулярных водородных связей: ОН-группа у С3 элементарного звена включена в водородную связь с атомом кислорода в цикле соседнего элементарного звена; ОН-группа у С6 может быть связана водородными связями как внутримолекулярно – с атомом кислорода гликозидной связи и (или) атомом азота ацетамидной группы, так и межмолекулярно - с ОН-группой у С6 соседней макромолекулы (см. рис.3). При этом последняя может образовывать водородные связи с молекулами кристаллизационной воды. Благодаря сравнительно высокой жесткости полимерной цепи и значительной интенсивности межмолекулярного взаимодействия хитин растворяется в сравнительно ограниченном количестве растворителей – концентрированных минеральных кислотах (соляной, серной, азотной, фосфорной), безводной муравьиной кислоте, гексафторизопропаноле и гексафторацетоне, растворах диметилацетамида и диметилсульфоксида в присутствии Li+ (5-10%). В большинстве этих растворителей происходит деструкция полимера, что затрудняет определение истинного значения молекулярной массы и характера молекулярно-массового распределения. Имеющиеся данные свидетельствуют о том, что выделенный, в частности, из панцирей ракообразных хитин представляет собой высокомолекулярный полимер с молекулярной массой Химические свойства Деструкция. Хитин подвергается кислотному и ферментативному гидролизу. Этот процесс (гидролитическая деструкция) используют для снижения молекулярной массы хитина при использовании его в медицине и фармакологии. Схема гидролиза хитина в кислой среде приведена на рис.4: 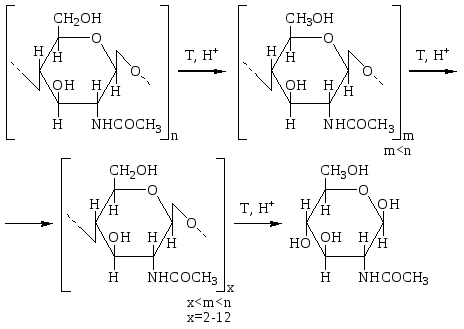 Рис.4. Схема кислотного гидролиза хитина. В зависимости от pH среды, длительности и интенсивности нагревания могут образовываться как высокомолекулярные, так и олигомерные продукты. Конечным продуктом полного кислотного гидролиза является N-ацетилглюкозамин. Ферментативная деструкция (биодеградация). В природе существует два пути катаболизма хитина. Первый путь (рис.5 а) хорошо изучен изаключается в деструкции хитина под действием хитиназ сначало до хитоолигосахаридов и далее до хитобиозы, с последующим превращением ее в N-ацетилглюкозоамин в присутствии N-ацетил-β-глюкозоаминидазы и в глюкозоамин при действии N-ацетилглюкозоамино-дезацетилазы. Второй путь, так называемый, "хитозановый" постулирован по аналогии с деградацией других природных полимеров (рис.5 б). Ключевым ферментом в этом случае служит хитиндеацетилаза (КФ 3.5.1.41), отвечающая за превращение хитина в хитозан. Образующийся хитозан под действием хитозаназы деградирует до димеров глюкозоамина, а последний, в свою очередь, до мономеров в присутствии фермента – глюкозоаминидазы.  Рис. 5. Установленный (а) и постулированный (б) пути деградации хитина в природе. Ферментативный гидролиз гликозидной связи происходит по типу кислотно-основного катализа, для которого необходимо наличие двух составляющих: донора протонов и нуклеофильного основания. Гидролиз может протекать либо с сохранением, либо с обращением конфигурации при асимметрическом атоме углерода. Существует два варианта механизма катализа, являющиеся общими для гликозилгидролаз (рис.6). 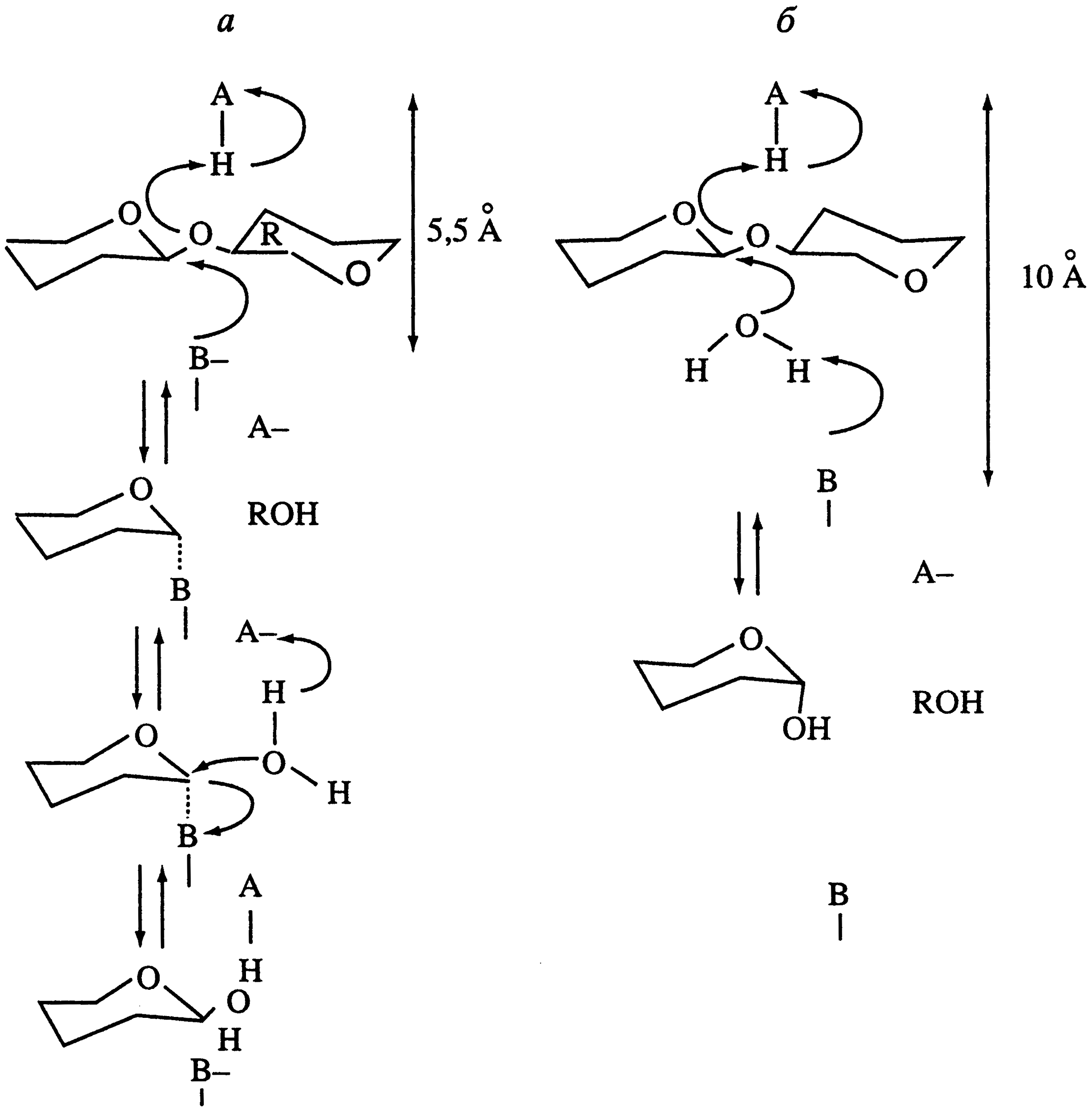 Рис.6. Схема механизма катализа гидролиза β-гликозидной связи с сохранением (а) и обращением конфигурации (б) заместителя у С1-атома. Первый вариант подразумевает наличие протонированного кислотного остатка как донора протонов (обычно карбоксильная группа глутаминовой кислоты) и отрицательно заряженной аминокислоты, которая электростатически стабилизирует положительный заряд при углеродном атоме (С1), образующийся в процессе катализа (рис.6 а). При реализации катализа по второму варианту, основание (отрицательно заряженный остаток аминокислоты) располагается далеко от углеродного атома С1, чтобы стабилизировать промежуточный положительно заряженный карбоион (рис.6 б). Сульфирование хитина проводят концентрированной серной кислотой, сульфированию подвергаются гидроксильные группы у С6: 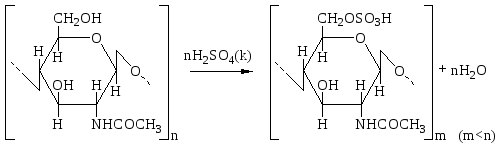 Нитрование хитина производят дымящей азотной кислотой. Нитрованию подвергаются гидроксильные группы у С6: 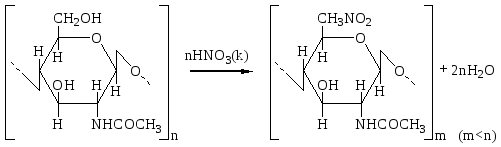 Образующийся в реакции нитрохитин растворяется в муравьиной, серной и соляной кислотах. Карбоксиметилирование хитина проводят под действием NaOH и монохлоруксусной кислоты. Реакция идет по С6. Однако в таких условиях 50% ацетамидных групп гидролизуется до аминных:  Деацетилирование хитина проводят под действием 45-50% раствора NaOH при температуре 110-140 ºС в течение 4-6 часов, при этом образуется одно из важных производных хитина – хитозан:  Транс-расположение заместителей (ацетамидной и гидроксильной групп) у С2 и С3 в элементарном звене макромолекулы хитина обусловливает значительную гидролитическую устойчивость ацетамидных групп, в том числе и в условиях щелочного гидролиза. Поэтому отщепление ацетамидных групп удается осуществить лишь в сравнительно жестких условиях – при обработке концентрированным водным раствором NaOН при повышенной температуре. Однако и в этих условиях степень дезацетилирования (доля отщепившихся ацетамидных групп в расчете на одно элементарное звено) не достигает единицы (то есть не обеспечивается количественное удаление этих групп), составляя обычно 0.8-0.9. ХИТОЗАН Химическое строение и молекулярная структура Хитозан – линейный гетерополисахарид, построенный главным образом из звеньев остатков 2-амино-2-дезокси-β-D-глюкопиранозы, соединенных β-(1→4)-гликозидной связью. Некоторые звенья состоят из остатков 2-ацетамидо-2-дезокси-β-D-глюкопиранозы. 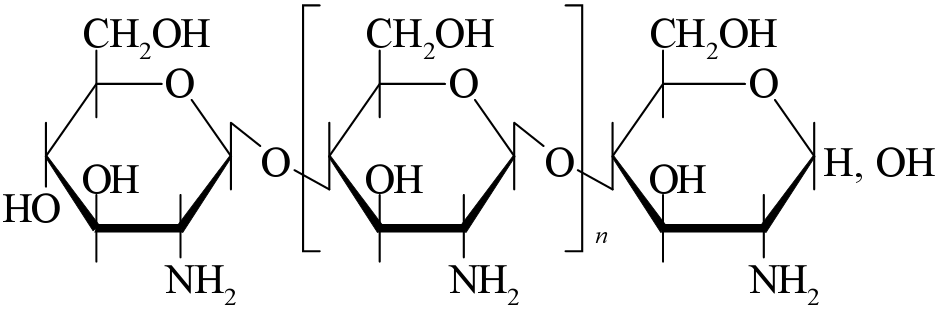 Рис.7. Структурная формула макромолекулы хитозана. Композиционная неоднородность, присущая хитину, сохраняется и в хитозане. В хитозане, как правило, присутствуют остатки белка, которые существенно влияют на его физико-химические свойства. Кроме того, хитозану свойственна и структурная неоднородность, обусловленная неполной завершенностью реакции деацетилирования хитина, в результате этого содержание остаточных ацетильных групп в хитозане может достигать 30%, и характер распределения этих групп по цепи полимера может заметно влиять на некоторые физико-химические свойства хитозана. Энергетически выгодной конформацией элементарного звена макромолекулы хитозана является конформация кресла С1:  Физические свойства Как и хитин, хитозан представляет собой аморфно-кристаллический полимер, для которого также характерно явление полиморфизма, причем количество структурных модификаций при переходе от хитина к хитозану увеличивается до 6. Сохранение при этом размеров элементарной ячейки кристаллита вдоль оси макромолекулы на уровне соответствующей характеристики для хитина (103 нм) свидетельствует о том, что конформация макромолекул при переходе от хитина к хитозану существенно не изменяется. В то же время в процессе дезацетилирования хитина заметно уменьшается общая упорядоченность структуры (степень кристалличности снижается до 40-50%). Снижение степени кристалличности может быть обусловлено как аморфизацией структуры вследствие внутрикристаллитного набухания при дезацетилировании, так и нарушением регулярности строения полимерной цепи в случае неполного отщепления N-ацетильных групп. На рис.8. представлены химическая структура и пространственное строение фрагмента цепи хитозана. Двугранные углы φ и ψ определяют конформацию главной цепи, угол χ определяет ориентацию атома O6 гидроксиметильной группы. 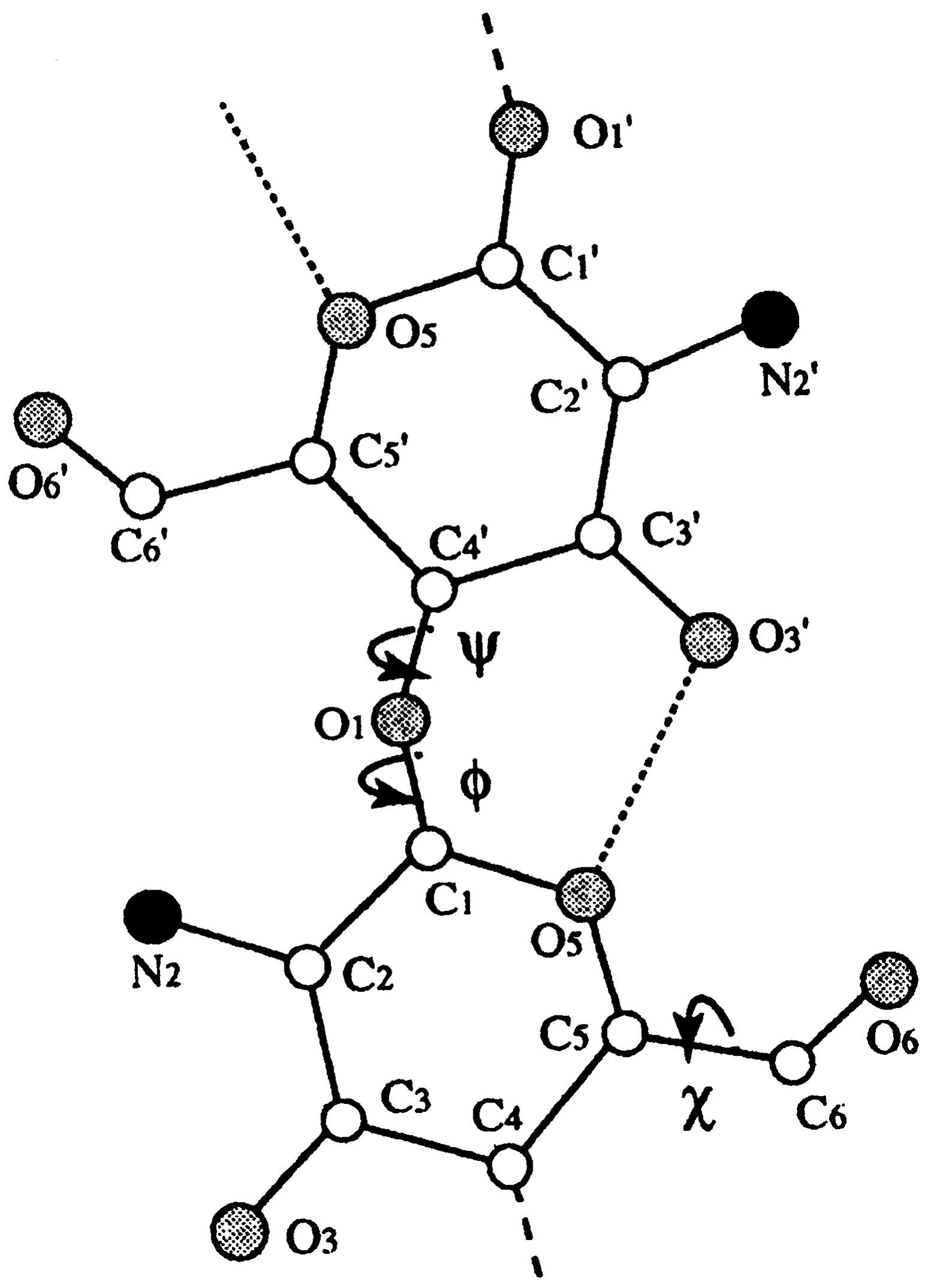 Рис.8. Химическая структура и пространственное строение фрагмента цепи хитозана. Пунктиром показаны внутримолекулярные водородные связи. Модель элементарной ячейки структуры гидратированного хитозана приведена на рис.9. Согласно теоретическому расчету, молекулы хитозана в гидратированной форме, содержащей две молекулы воды в одной асимметричной единице (на рис.9 выделено прямоугольником), имеют спиральную симметрию с двумя звеньями на виток, стабилизированную O3–O5 водородными связями, с периодом повторения 10.34 Å. Такая структура типична для β-(1→4) связанных полисахаридов типа целлюлозы, маннана и хитина. Торсионные углы равновесной конформации главной цепи (С2–С1–О1–С4′) и φ (С1–O1–С4′–С3′) равны 145.9º и 94.1º соответственно. Ориентация атома O6 гидроксиметильной группы имеет gt конформацию (χ (O5–C5–С6–O6) = 68.6º). 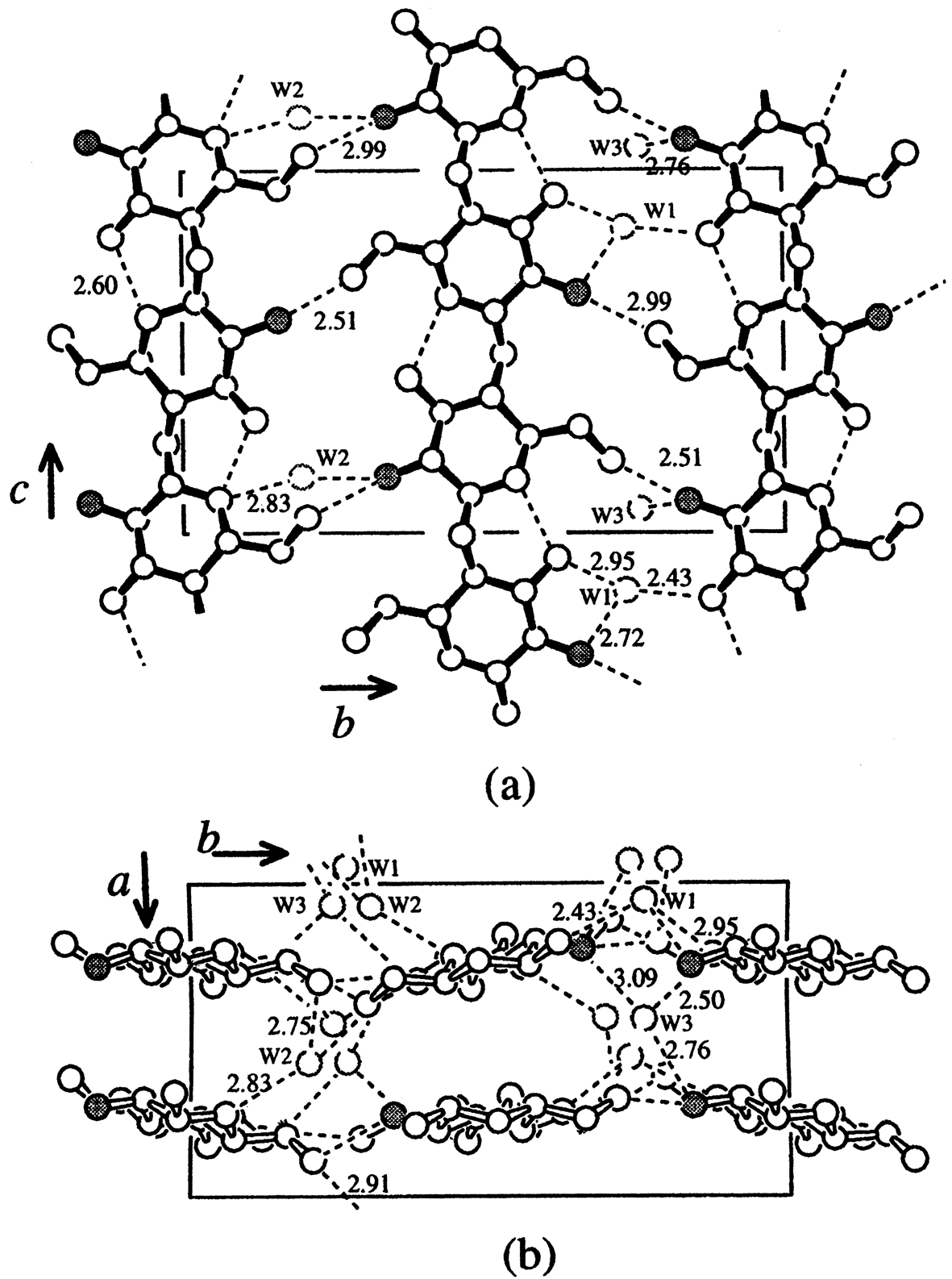 Рис.9. Упаковка структуры гидратированного хитозана, спроецированная вдоль оси a (a) и вдоль оси b (b). Темные кружки обозначают атомы азота. Две смежных цепи полимера, расположенные вдоль оси b, кристаллографически независимы (рис.9). Эти две цепи расположены антипараллельно и связаны друг с другом двумя N2–O6 водородными связями (2.51 и 2.99 Å) вдоль оси b, что образует слоистую плоскую структуру, параллельную плоскости bc (рис.9 a). Слои сложены вдоль направления a (рис.9 b). Соседние слои связаны кристаллографической 21 симметрией вдоль направления b. В результате, две независимые цепи полимера с одинаковым направлением образуют повторяющуюся единицу вдоль оси a. Две эти цепи сдвинуты вдоль оси с приблизительно на одну четверть повторяющейся единицы. Такая структура стабилизирована следующими водородными связями (рис.9): W2---О5 (2.83 Å), W2---О6 (2.75 и 2.91 Å), W3---О3 (2.5 Å) и W3---N2 (3.09 и 2.76 Å). В то же время, соседние макромолекулы соединены в том же самом слое водородными связями типа W1---О3 (2.95 и 2.43 Å) и W1---N2 (2.72 Å). В отличие от хитина, хитозан растворяется даже в разбавленных органических и минеральных кислотах, например в водном растворе уксусной, янтарной, соляной, муравьиной и др. кислот. Появление в каждом элементарном звене макромолекулы свободной аминогруппы придает хитозану свойства полиэлектролита, одним из которых является характерный для растворов полиэлектролитов эффект полиэлектролитного набухания – аномального повышения вязкости разбавленных растворов (с концентрацией ниже 1 г/л) при уменьшении концентрации полимера. Этот эффект является следствием увеличения эффективного объема и асимметрии макромолекул в растворе в результате отталкивания одноименных зарядов, возникающих при протонировании аминогрупп макромолекулярной цепи: 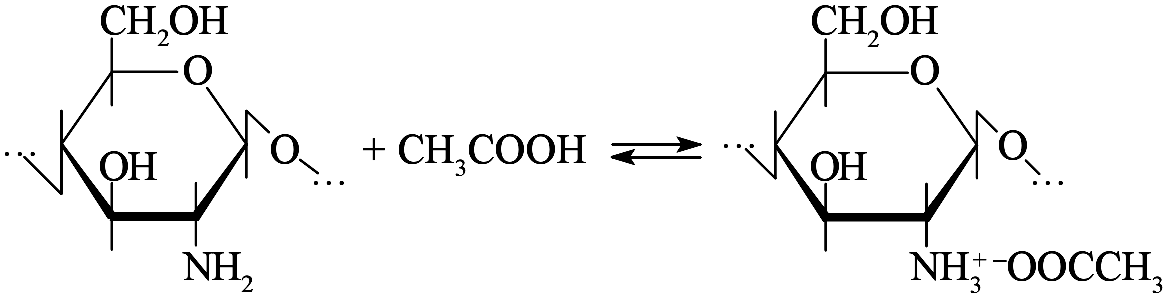 Хитозан обладает пленкообразующими свойствами. При формовании хитозановых пленок в качестве растворителя используют водные растворы летучих одноосновных кислот: уксусной, муравьиной и др., образующих с хитозаном соответствующие соли. Диаграмма состояния системы хитозан (Х) – уксусная кислота (УК) – вода представлена на рис.10. 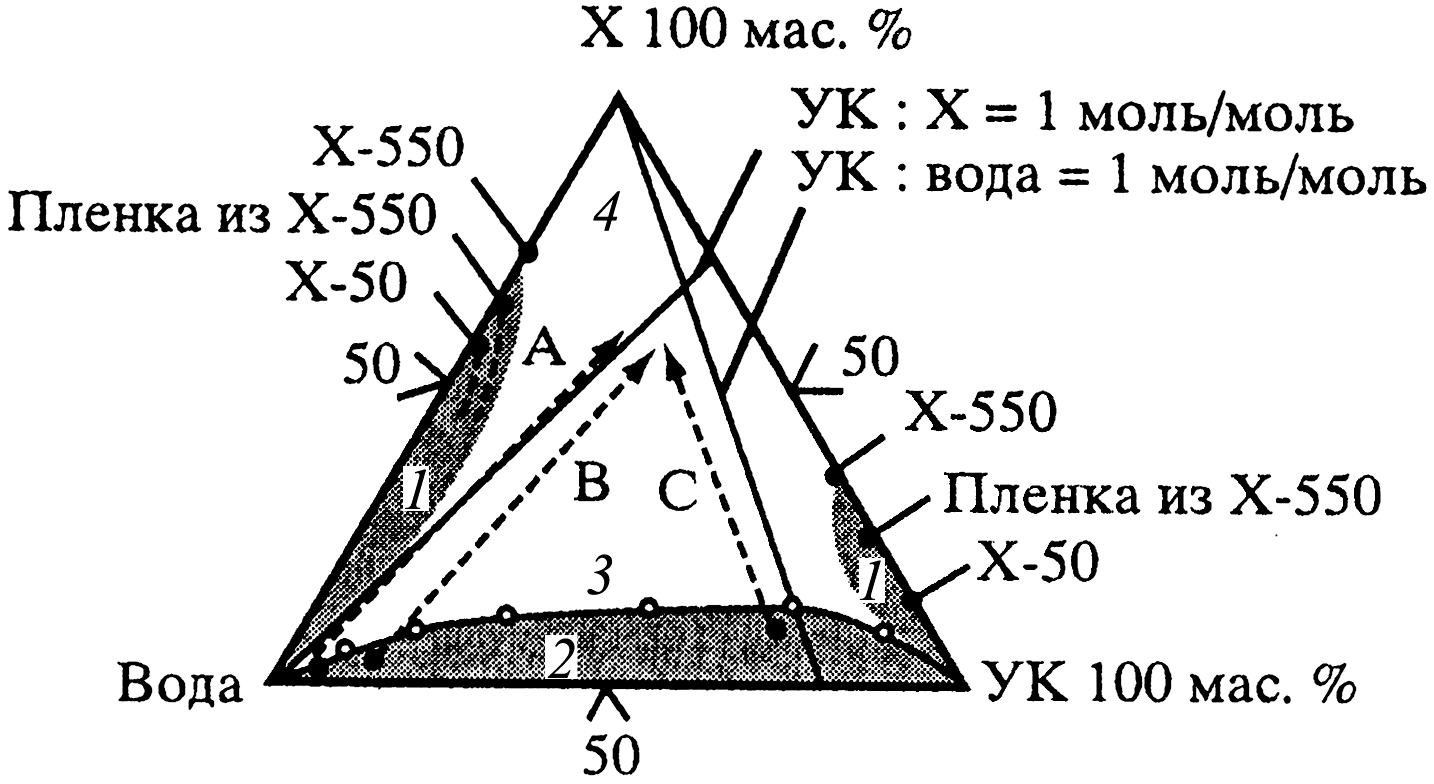 Рис.10. Диаграмма состояния системы хитозан – УК – вода (T = 20°C, число в обозначении хитозана указывает на В воде, уксусной кислоте и их смесях с небольшим содержанием второго компонента хитозан лишь ограниченно набухает, но не растворяется (точки на сторонах треугольника и области 1), а в других смесях происходит неограниченное набухание и растворение полимера с образованием тем более концентрированных растворов, чем ближе состав растворителя приближается к эквимольному, т.е. к содержанию в нем 77 мас.% уксусной кислоты. Состав пленок, полученных высушиванием растворов полимера с разным содержанием уксусной кислоты (на рис.10 стрелки А, В и С), близок к эквимольному содержанию хитозана, кислоты и воды, что также подтверждает наибольшее сродство хитозана к эквимольной смеси уксусной кислоты и воды. На рис.10 кривая 3 является границей между растворами (область 2) и нетекучими физическими гелями, при высушивании которых происходит формирование пленок из уксусно-кислой соли хитозана (область 4). Нейтрализация последних приводит к получению пленок из хитозана в форме полиоснования. Из представленной диаграммы видно, что при формовании пленок высушиванием растворов полимера в 1 - 2%-ной уксусной кислоте (путь А) существует вероятность фазового разделения системы и получения структурно неоднородной пленки, тогда как в случаях В и С система и получаемая пленка должны быть более однородными. Определение значений молекулярной массы хитозана (как по данным светорассеяния, так и вискозиметрии) дает в зависимости от источника и способа выделения величины 0.5 - 8∙105 Да. Существенное различие молекулярных масс хитина и хитозана свидетельствует о протекании на стадии дезацетилирования заметной деструкции полимерной цепи. Хитозан является оптически активным полисахаридом. Водно-кислотные растворы хитозана и растворы в буферных средах характеризуются отрицательной величиной удельного оптического вращения 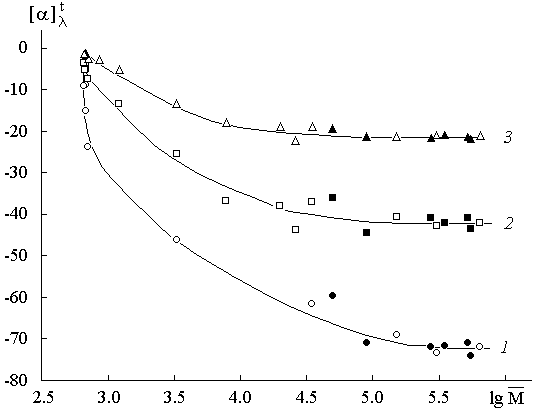 Рис.11. Зависимость удельного оптического вращения растворов хитозана в ацетатном буфере от молекулярной массы при : 313 (1), 405 (2) и 578 нм (3). Химические свойства Деструкция хитозана происходит под действием перекисей, кислот, щелочей и ферментных препаратов. Механизм деструкции аналогичен таковому для хитина. Получаемые при этом низкомолекулярные хитозаны ( Карбоксиметилирование хитозана проводят монохлоруксусной кислотой в присутствии NaOH: 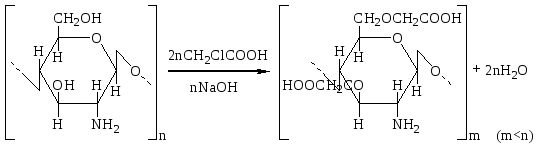 Дикарбоксиметил хитозан растворяется в кислой и щелочной средах, но выпадает в осадок в области рН = 3 - 7. Карбоксилирование хитозана. Обработка ацетата хитозана хлорной кислотой с последующим окислением продукта оксидом хрома получают водорастворимую соль 6-O-карбоксиметилированного хитозана.  Сульфирование хитозана проводят концентрированной серной кислотой, олеумом, а так же хлорсульфоновой кислотой. Реакция идее по С3 и С6:  Ацетилирование хитозана проводят смесью уксусного ангидрида и хлорной кислоты, либо ангидридами алкил- и арилдикарбоновых кислот. Реакция идет по С6 и аминогруппе: 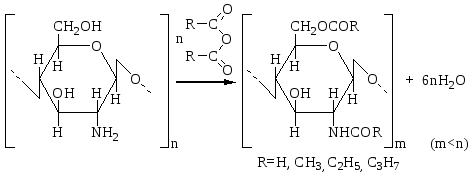 N-алкилирование хитозана проводят алкилированием хитозана галоидными алкилами в присутствии органических оснований, которые связывают образующуюся в результате реакции йодистоводородную кислоту. Реакция идет по аминогруппе: 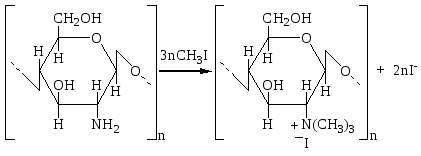 N-триметилхитозан является полиэлектролитом. Физико-химические свойства хитозана Для увеличения растворимости хитина и хитозана в водных средах используют N- и О-карбоксиметилирование, и сульфатирование, что значительно расширяет области практического применения производных хитозана. Гидрофобное модифицирование водорастворимых производных хитина и хитозана путем ковалентного присоединения алкильных или других гидрофобных функциональных групп (рис.12), придает этим полиэлектролитам амфифильные свойства, т.е. делает их поверхностно-активными. 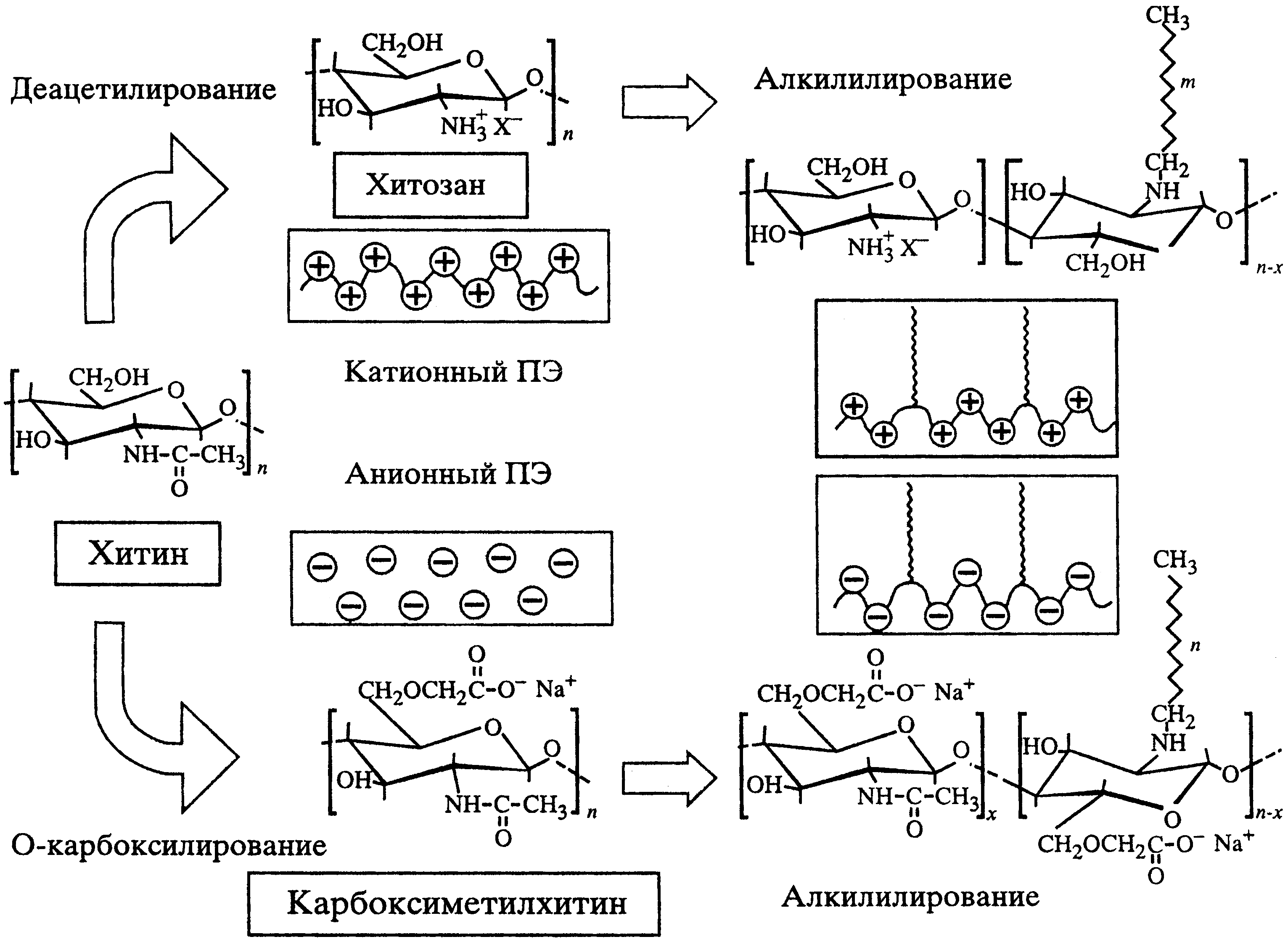 Рис.12. Водорастворимые продукты химической модификации хитина. Особый интерес для практических приложений имеет свойство водорастворимых анионных и катионных производных хитина и хитозана образовывать динамические ассоциаты с противоположно заряженными молекулами ПАВ в смешанных водных растворах. Такие ассоциаты – ПАВ-полиэлектролитные комплексы (ПАВ-ПЭК), характеризуются аномально высокой (по сравнению с образующими их компонентами) межфазной активностью и стабилизирующей способностью по отношению к эмульсиям и пенам.  Рис.13. Механизм ингибирования жира хитозаном в желудочно-кишечном тракте. Образование ПАВ-ПЭК между производными хитина и ПАВ в смешанных водных растворах имеет большое значение для различных практических приложений. Например, свойство хитозана связывать свободные жирные кислоты при низких рН с образованием нерастворимых комплексов (рис.13) позволяет применять его в качестве "поглотителя жира" в пищевых добавках, для рафинирования пищевых жидкостей, чистки сточных вод пищевых производств и др. Большой интерес для микрокапсулирования биологически активных веществ представляет способность гидрофобно-модифицированных производных хитина и хитозана образовывать физические гели с высокоупорядоченной внутренней наноструктурой мицеллярного типа. Физические гели ПАВ-ПЭК на основе хитозана с высокоупорядоченной мицеллярной структурой получаются при фронтальной диффузии ПАВ и ПЭ на границе раздела их индивидуальных растворов (рис.14). 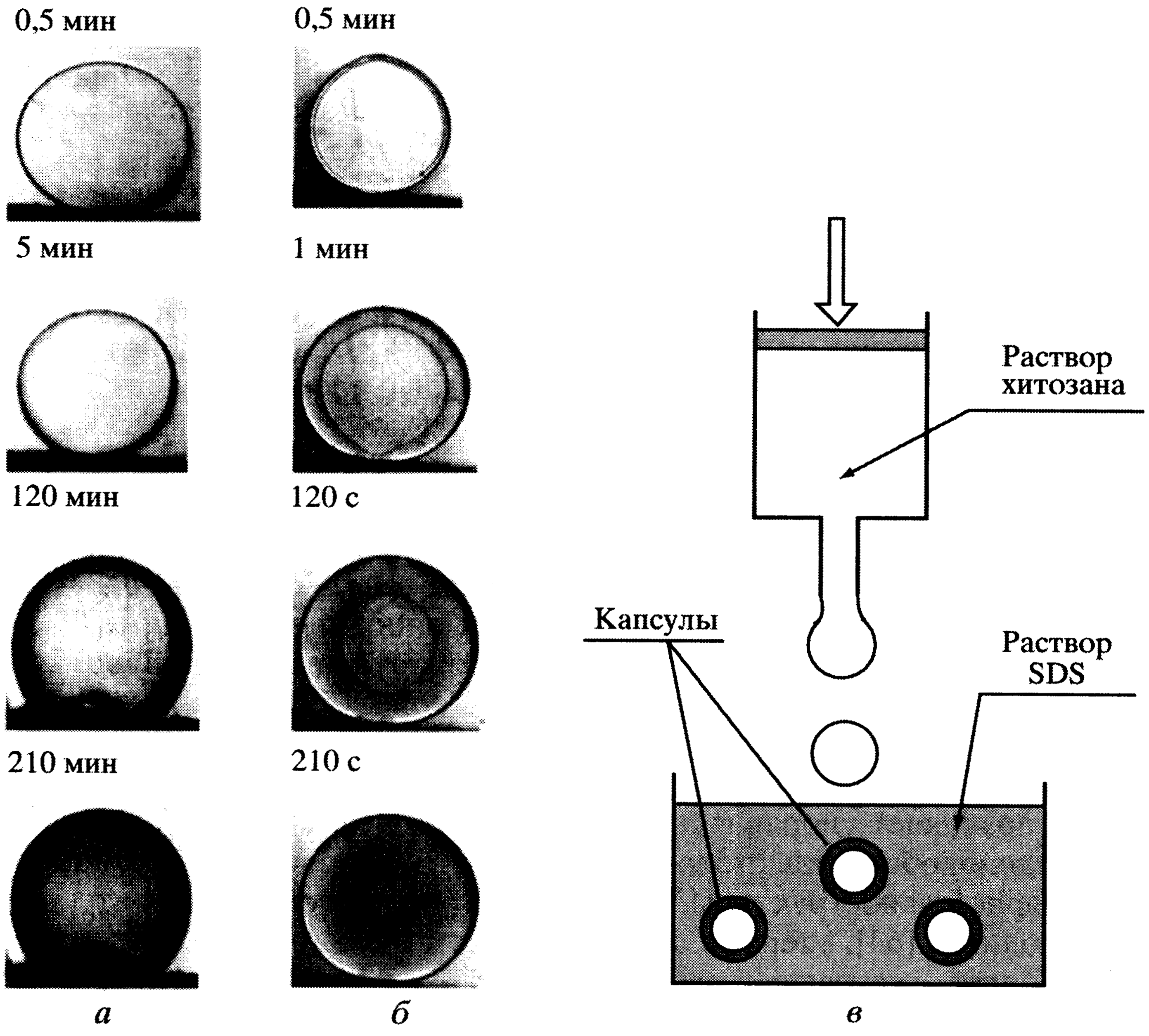 Рис.14. Процессы, происходящие при попадании капли раствора хитозана в раствор ПАВ и в раствор щелочи и схема получения капсул прикапыванием водного раствора хитозана в водный мицеллярный раствор ДДСН. Хитозан способен взаимодействовать с молекулами ДНК, с образованием жидких кристаллов с разными оптическими свойствами (рис.15). ЖК-комлексы ДНК–хитозан являются перспективными материалами для создания биосенсоров.  Рис.15. Микрофотография жидкокристаллической ДНК. Применение хитина и хитозана Хитин, хитозан и их производные находят широкое применение в различных областях современной медицины и фармакологии. На их основе, а также в комплексе с другими полисахаридами создают повязки, губки и т.п. для лечения поверхностных ран разной этимологии. Хитин–хитозан используют при получении биодеградируемых носителей различных фармацевтических форм лекарственных препаратов (антибиотиков, антивирусных, противоопухолевых и антиаллергенных препаратов). Применение таких материалов создает условия для выделения лекарственных средств, обеспечивая эффект пролонгирования их действия. Сульфаты хитозана обладают антикоагулянтной активностью, возрастающей при увеличении степени сульфатирования, уменьшают интенсивность деления раковых клеток. В настоящее время на основе хитин–хитозана и их производных создано большое количество биологически-активных добавок. Хитин, хитозан и их производные являются эффективными флокулянтами и могут рассматриваться как реальная альтернатива традиционным методам очистки технологических жидкостей пищевых производств и сточных вод промышленных предприятий (от соединений таких металлов, как никель, хром, цинк, ртуть, кадмий и др.). Наличие электронодонорных амино- и гидроксильных групп и широкие возможности введения различных ионогенных групп кислотного и основного характера делают производные хитина и хитозана весьма перспективными для использования в хроматографии при разделении и очистке биологически активных соединений (нуклеиновых кислот и продуктов их гидролиза, стероидов, аминокислот). Хитин и хитозан находят широкое применение в различных видах хроматографии в качестве структурного компонента хроматографических носителей, в качестве специфических лигандов, а также в качестве спейсера, соединяющего носитель и лиганд. Хитин–хитозан используются также в фотографических процессах, связанных с быстрым проявлением изображения; в бумажной промышленности, для получения высококачественных сортов бумаги; в мембранных технологиях для процессов первапорационного разделения водно-органических смесей. Литература
|
