2 ИДЗ МКТ и ТД. И дз мкт. Термодинамика
 Скачать 0.94 Mb. Скачать 0.94 Mb.
|
Вариант 3232.1. В сосуде, разделенном на равные части неподвижной теплоизолирующей перегородкой, находятся одинаковые количества одного и того же газа, причем Р1> Р2. 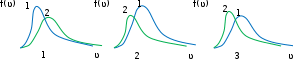 Распределение скоростей молекул газа в сосуде будет описываться кривыми… Распределение скоростей молекул газа в сосуде будет описываться кривыми…3  2.2. Один моль идеального газа сначала сжимается при постоянной температуре, затем нагревается при постоянном давленнии, и, наконец, охлаждается при постоянном объеме до первоначальной температуры. Из приведенных ниже зависимостей этим изменениям в координатах Р–Т соответствует график … 2.2. Один моль идеального газа сначала сжимается при постоянной температуре, затем нагревается при постоянном давленнии, и, наконец, охлаждается при постоянном объеме до первоначальной температуры. Из приведенных ниже зависимостей этим изменениям в координатах Р–Т соответствует график … 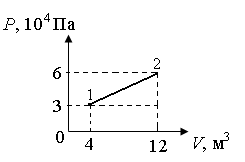 32.3. При переходе из состояния 1 в состояние 2 у двух атомного газа внутренняя энергия изменяется на … МДж. 32.4. При постоянном давлении водороду сообщили 580 Дж теплоты, а его температура повысилась на 10 К. Какое количество молей содержится в данной массе водорода? 32.5. Найти приращение S энтропии при превращении массы m=100 г льда ( t = –10° С) в воду с температурой t=40° С . Удельная теплоемкость льда 2100 Дж/кг∙К, удельная теплоемкость воды 4200 Дж/кг∙К, удельная теплота плавления льда λ = 335кДж/К. ИДЗ «МКТ. Термодинамика» Вариант 3333.1. Классическая статистика Максвелла-Больцмана описывает макроскопическую систему частиц, обладающих следующими свойствами. 1. Частицы неразличимы. 2. Физические характеристики частиц (скорость, импульс, энергия) могут принимать любые конечные значения. 3. В тождественных состояниях может находиться любое число частиц. 4. Частицы системы взаимодействуют между собой при столкновении, т.е. могут обмениваться импульсом и энергией. Укажите номера утверждений, с которыми Вы согласны. 33.2. Два сосуда с объемом 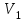 = 40 л и = 40 л и 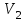 = 20 л содержат газ при одинаковой температуре, но разных давлениях. После соединения сосудов в них установилось давление = 20 л содержат газ при одинаковой температуре, но разных давлениях. После соединения сосудов в них установилось давление 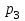 =1,0 МПа. Каково было начальное давление =1,0 МПа. Каково было начальное давление 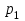 в большом сосуде, если в меньшем оно было в большом сосуде, если в меньшем оно было 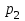 = 600 кПа? Температура не меняется. = 600 кПа? Температура не меняется.33.3. Один моль одноатомного идеального газа, находящегося при температуре T = 250 К, нагревали изобарически. При этом его объем увеличился в 2 раза. Изменение внутренней энергии 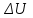 газа равно … кДж. газа равно … кДж.3 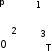 3.4. Два моля идеального одноатомного газа сначала охладили, а затем нагрели до первоначальной температуры Т1 = 300 К, увеличив объем газа в 3 раза. После этого система вернулась в начальное состояние (см. рисунок). Приведите график этого цикла в координатах Р –V. Какое количество теплоты отдал газ за цикл? 3.4. Два моля идеального одноатомного газа сначала охладили, а затем нагрели до первоначальной температуры Т1 = 300 К, увеличив объем газа в 3 раза. После этого система вернулась в начальное состояние (см. рисунок). Приведите график этого цикла в координатах Р –V. Какое количество теплоты отдал газ за цикл?33.5. Во сколько раз следует изотермически увеличить объем 4 молей идеального газа, чтобы его энтропия испытала приращение S= 23 Дж/ К? ИДЗ «МКТ. Термодинамика» Вариант 93 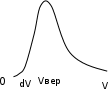 4.1. На рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где 4.1. На рисунке представлен график функции распределения молекул идеального газа по скоростям (распределение Максвелла), где 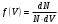 - доля молекул, скорости которых заключены в интервале от - доля молекул, скорости которых заключены в интервале от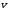 до до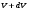 в расчете на единицу этого интервала. в расчете на единицу этого интервала. Если, не меняя температуры, взять другой газ с большей молярной массой и таким же числом молекул, то… 1) величина максимума уменьшится; 2) площадь под кривой увеличится; 3) площадь заштрихованной полоски уменьшится; 4) максимум кривой сместится влево. Укажите номера правильных ответов. 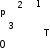 34.2. На рисунке стрелками указаны направления двух изопроцессов 1-2 и 2-3 для одного и того же количества идеального газа. Укажите номера ответов, соответствующих верным соотношениям объемов. 1  . V1<V2 2. V2>V3 3.V1 = V2 4. V1>V2 5. V1 = V3 . V1<V2 2. V2>V3 3.V1 = V2 4. V1>V2 5. V1 = V334.3. При переходе из состояния 1 в состояние 2 у двух атомного газа внутренняя энергия изменяется на … МДж. 34.4. Верно ли, что: 1.количество тепла, полученное системой, является функцией процесса, т.е. зависит от вида процесса, в ходе которого система получает тепло? 2.за счет подведенного тепла система может совершать работу над окружающими телами? 3.можно говорить о запасе тепла в телах? 4.работа расширения системы в конечном счете всегда связана с превращением внутренней энергии системы или окружающих тел в механическую энергию? На какие вопросы Вы ответили «да»? 34.5. Изменение энтропии при изотермическом расширении 0,5 молей углекислого газа от объема V1до V2 =38 м3 равно ΔS= 5,15 Дж/К. Чему равен начальный объем газа V1? ИДЗ «МКТ. Термодинамика» |
