I. Сырьё, используемое для производства серной кислоты
 Скачать 204.02 Kb. Скачать 204.02 Kb.
|
|
| I. Сырьё, используемое для производства серной кислоты. Основное сырьё сера - S серный колчедан (пирит) - FeS2 сульфиды цветных металлов - Cu2S, ZnS, PbS сероводород – H2S Вспомогательный материал катализатор - оксид ванадия – V2O5 II. Подготовка сырья. Разберём производство серной кислоты из пирита FeS2. 1) Измельчение пирита. Перед использованием большие куски пирита измельчают в дробильных машинах, при измельчении вещества скорость реакции увеличивается, т.к. увеличивается площадь поверхности соприкосновения реагирующих веществ. 2) Очистка пирита. После измельчения пирита, его очищают от примесей (пустой породы и земли) методом флотации. Для этого измельчённый пирит опускают в огромные чаны с водой, перемешивают, пустая порода всплывает наверх, затем пустую породу удаляют. III. Основные химические процессы: 4FeS2 + 11O2 t = 800°C→2Fe2O3 + 8SO2 + Q или сжигание серы S + O2 t °C→SO2 2SO2 + O2 400-500°С,V2O5,p↔2SO3 + Q SO3 + H2O → H2SO4 + Q IV. Технологические принципы: - принцип непрерывности; - принцип комплексного использования сырья, использование отходов другого производства; - принцип безотходного производства; - принцип теплообмена; - принцип противотока (“кипящий слой”); - принцип автоматизации и механизации производственных процессов. V. Технологические процессы: Принцип непрерывности: обжиг пирита в печи →поступление оксида серы (IV) и кислорода в очистительную систему →в контактный аппарат →подача оксида серы (VI) в поглотительную башню. VI. Химизм производства: 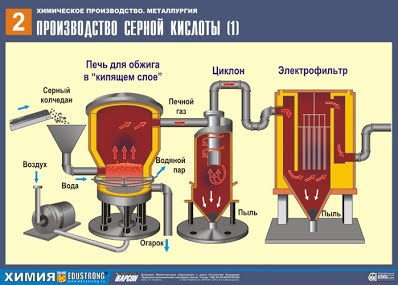 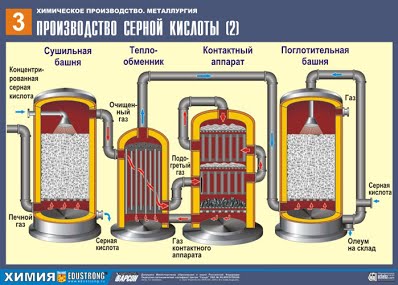 ПЕРВАЯ СТАДИЯ - обжиг пирита в печи для обжига в "кипящем слое". Для получения серной кислоты используют флотационный колчедан - отход производства при обогащении медных руд, содержащих смеси сернистых соединений меди и железа. Уравнение реакции первой стадии 4FeS2 + 11O2 t = 800°C→ 2Fe2O3 + 8SO2 + Q Измельчённый очищенный влажный (после флотации) пирит сверху засыпают в печь для обжига в "кипящем слое". Снизу (принцип противотока) пропускают воздух, обогащённый кислородом, для более полного обжига пирита. Температура в печи для обжига достигает 800°С. Пирит раскаляется до красна и находится в "подвешенном состоянии" из-за продуваемого снизу воздуха. Похоже это всё на кипящую жидкость раскалённо-красного цвета. В “кипящем слое” не слеживаются даже самые мелкие частицы пирита. Поэтому процесс обжига происходит очень быстро - всего несколько секунд. Притом, в “кипящем слое” можно поддерживать температуру 800°С. Образовавшийся оксид железа Fe2O3 (огарок) в производстве серной кислоты не используют. Но его собирают и отправляют на металлургический комбинат, на котором из оксида железа получают металл железо и его сплавы с углеродом - сталь (2% углерода С в сплаве) и чугун (4% углерода С в сплаве). Таким образом, выполняется принцип химического производства - безотходность производства. Из печи выходит печной газ, состав которого: SO2, O2, пары воды (пирит был влажный!) и мельчайшие частицы огарка (оксида железа). Такой печной газ необходимо очистить от примесей твёрдых частиц огарка и паров воды. Очистка печного газа от твёрдых частичек огарка проводят в два этапа - в циклоне (используется центробежная сила, твёрдые частички огарка ударяются о стенки циклона и ссыпаются вниз). Для удаления мелких частиц смесь направляем в электрофильтры, где идет очищение под действием тока высокого напряжения 60000 В (используется электростатическое притяжение, частицы огарка прилипают к наэлектризованным пластинам электрофильтра, при достаточном накоплении под собственной тяжестью они ссыпаются вниз), для удаления паров воды в печном газе (осушка печного газа) используют серную концентрированную кислоту, которая является очень хорошим осушителем, поскольку поглощает воду. Осушку печного газа проводят в сушильной башне - снизу вверх поднимается печной газ, а сверху вниз льётся концентрированная серная кислота. Для увеличения поверхности соприкосновения газа и жидкости башню заполняют керамическими кольцами. На выходе из сушильной башни печной газ уже не содержит ни частичек огарка, ни паров воды. Печной газ теперь представляет собой смесь оксида серы SO2 и кислорода О2. ВТОРАЯ СТАДИЯ – каталитическое окисление SO2 в SO3 кислородом в контактном аппарате. Уравнение реакции этой стадии: 2SO2 + O2 400-500°С,V2O5,p ↔2SO3 + Q Сложность второй стадии заключается в том, что процесс окисления одного оксида в другой является обратимым. Поэтому необходимо выбрать оптимальные условия протекания прямой реакции (получения SO3). Из уравнения следует, что реакция обратимая, а, значит, на этой стадии необходимо поддерживать такие условия, чтобы равновесие смещалось в сторону выхода SO3, иначе нарушится весь процесс. Т.к. реакция идет с уменьшением объема (3V↔2V), то необходимо повышенное давление. Повышают давление до 7-12 атмосфер. Реакция экзотермическая, поэтому, учитывая принцип Ле-Шателье, при высокой температуре этот процесс вести нельзя, т.к. равновесие сдвинется влево. Начинается реакция при температуре = 420 градусов, но благодаря многослойности катализатора (5 слоев), мы можем ее повышать до 550 градусов, что значительно ускоряет процесс. Катализатор используют ванадиевый (V2O5). Он дешевый, долго служит (5-6 лет), т.к. наиболее устойчив к действию ядовитых примесей. Кроме того, он способствует сдвигу равновесия вправо. Смесь (SO2 и O2) нагревается в теплообменнике и движется по трубам, между которыми в противоположном направлении проходит холодная смесь, которую надо нагреть. В результате происходит теплообмен: исходные вещества нагреваются, а продукты реакции охлаждаются до нужных температур. ТРЕТЬЯ СТАДИЯ - поглощение SO3 серной кислотой в поглотительной башне. А почему оксид серы SO3 не поглощают водой? Ведь можно было бы оксид серы растворить в воде: SO3 + H2O →H2SO4. Но дело в том, что если для поглощения оксида серы использовать воду, образуется серная кислота в виде тумана, состоящего из мельчайших капелек серной кислоты (оксид серы растворяется в воде с выделением большого количества теплоты, серная кислота настолько разогревается, что закипает и превращается в пар). Для того, чтобы не образовывалось сернокислотного тумана, используют 98%-ную концентрированную серную кислоту. Два процента воды - это так мало, что нагревание жидкости будет слабым и неопасным. Оксид серы очень хорошо растворяется в такой кислоте, образуя олеум: H2SO4·nSO3. Уравнение реакции этого процесса: nSO3 + H2SO4 → H2SO4·nSO3 Образовавшийся олеум сливают в металлические резервуары и отправляют на склад. Затем олеумом заполняют цистерны, формируют железнодорожные составы и отправляют потребителю. |
Производство аммиака
При высоком давлении и температуре в присутствии осмиевого катализатора азот вступает в реакцию с водородом, в результате чего образуется аммиак:N2 +3H2
Закономерности влияния давления и температуры на равновесие реакции были обобщены в пр.
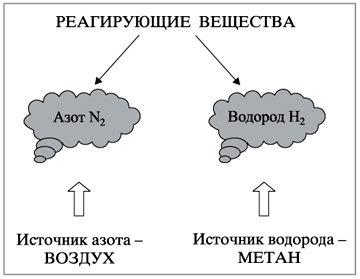
Исходную смесь газов берут в соотношении: 1 объем N2к 3 объемам Н2.Реагирующие газы тщательно очищают, затем подают в турбокомпрессор, где сжимают до 25–60 МПа, после чего смешивают с циркуляционным газом и направляют в колонну синтеза.
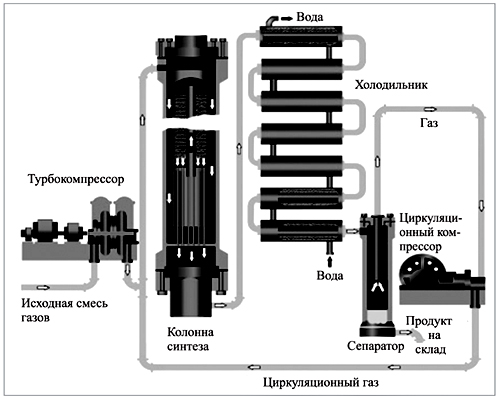
Установка для синтеза аммиака
Рассмотрим реакцию, лежащую в основе получения целевого продукта:
N2 +3H2
Подбор оптимальных условий проведения синтеза осуществляется исходя из характеристик химической реакции.
1) Реакция обратимая, гомогенная (исходные вещества и продукты – это газы) и идет с уменьшением объема, следовательно, смещению равновесия в сторону продуктов способствует повышенное давление.
2) Реакция экзотермическая, повышение температуры смещает химическое равновесие в сторону исходных веществ, а понижение температуры – в сторону продуктов реакции, но при этом скорость синтеза будет очень мала. Поэтому реакцию проводят при оптимальнойдля данного процесса температуре: 450–500 °С. Исходную смесь газов сначала нагревают в теплообменнике за счет движущихся противотоком выходящих газов, а затем в зоне экзотермической реакции. (Противоток – это движение различных веществ навстречу друг другу с целью создания наилучших условий для обмена энергией.)
3) Для ускорения синтеза, быстрейшего установления равновесия используют катализатор – восстановленное железо, активированное оксидами калия, алюминия и др.
Реагенты и продукты реакции находятся в газовой фазе и образуют гомогенную систему. Реакция протекает на поверхности твердых катализаторов. Такая реакция составляет особый класс гетерогенно-каталитических реакций. Большое значение имеет площадь поверхности катализатора. Катализатор изготавливают в виде губчатых гранул или таблеток
4) При всех указанных условиях проведения реакции равновесный выход продукта составляет не более 20%. Поэтому синтез продукта осуществляется по способу многократной циркуляции, т. е. непрореагировавшую смесь газов многократно возвращают в производство после отделения от нее полученного продукта.
Отвод продуктов и непрореагировавших веществ из зоны реакции производят через холодильник с последующим разделением в сепараторе.
Газовая смесь, состоящая из непрореагировавших веществ и продукта реакции (азот, водород, аммиак) после контакта с катализатором предварительно охлаждается в теплообменнике, отдавая теплоту входящим газам, а затем поступает в холодильник. Охлаждение, которое производят водой, движущейся противотоком, приводит к конденсации продукта реакции, в сепараторе он отделяется от непрореагировавших газов, которые циркуляционный компрессор возвращает в колонну синтеза.
Многократная циркуляция газов позволяет повысить выход продукта до 85–90% от теоретического.
Таблица
| Общие принципы | Частные принципы |
| 1. Создание оптимальных условий проведения химических реакций | Противоток веществ, прямоток веществ, увеличение площади поверхности соприкосновения реагирующих веществ, использование катализатора, повышение давления, повышение концентраций реагирующих веществ |
| 2. Полное и комплексное использование сырья | Циркуляция, создание смежных производств (по переработке отходов) |
| 3. Использование теплоты химических реакций | Теплообмен, утилизация теплоты реакций |
| 4. Принцип непрерывности | Механизация и автоматизация производства |
| 5. Защита окружающей среды и человека | Автоматизация вредных производств, герметизация аппаратов, утилизация отходов, нейтрализация выбросов в атмосферу |
Перегонка нефти
Сложный состав нефти позволяет получать из неё большое количество продуктов. Основные методы переработки нефти — перегонка и крекинг.
Углеводороды нефти кипят при разных температурах. Чем больше молекулярная масса вещества, тем выше его температура кипения. На этой закономерности основано разделение нефти на отдельные части, или фракции.
Фракции — смеси веществ, имеющих близкие значения температур кипения.
При перегонке нефти получают бензин, лигроин, керосин, газойль и мазут.
Бензин содержит лёгкие углеводороды с числом атомов углерода от 5 до 11 и используется как топливо для автомобильных двигателей. В состав керосина входят более тяжёлые углеводороды (C12–C18). Он применяется в качестве топлива для авиационных двигателей. Более тяжёлый газойль (C>18) используется в качестве дизельного топлива.
Мазут также разделяют перегонкой при пониженном давлении на смазочные масла. Оставшийся после отделения смазочных масел гудрон применяется для асфальтирования дорог.
Сложный состав нефти позволяет получать из неё большое количество продуктов. Основные методы переработки нефти — перегонка и крекинг.
Перегонка
Углеводороды нефти кипят при разных температурах. Чем больше молекулярная масса вещества, тем выше его температура кипения. На этой закономерности основано разделение нефти на отдельные части, или фракции.
Фракции — смеси веществ, имеющих близкие значения температур кипения.
При перегонке нефти получают бензин, лигроин, керосин, газойль и мазут.
Бензин содержит лёгкие углеводороды с числом атомов углерода от 5 до 11 и используется как топливо для автомобильных двигателей. В состав керосина входят более тяжёлые углеводороды (C12–C18). Он применяется в качестве топлива для авиационных двигателей. Более тяжёлый газойль (C>18) используется в качестве дизельного топлива.
Мазут также разделяют перегонкой при пониженном давлении на смазочные масла. Оставшийся после отделения смазочных масел гудрон применяется для асфальтирования дорог.
Крекинг
Для увеличения выхода бензина, а также для получения из нефти химического сырья применяют термический и каталитический крекинг.
Крекинг — высокотемпературная переработка нефти с целью получения продуктов с меньшими молекулярными массами.
При нагревании углеводородов с длинными углеродными цепями происходит их расщепление на более короткие молекулы. При этом образуются насыщенные и ненасыщенные углеводороды:
C20H42−→−tC10H22+C10H20.
В результате крекинга получают дополнительное количество бензина. Продукты крекинга содержат химически активные ненасыщенные углеводороды, которые используют в химической промышленности для производства полимеров и других органических веществ.

Крекинг
Для увеличения выхода бензина, а также для получения из нефти химического сырья применяют термический и каталитический крекинг.
Крекинг — высокотемпературная переработка нефти с целью получения продуктов с меньшими молекулярными массами.
При нагревании углеводородов с длинными углеродными цепями происходит их расщепление на более короткие молекулы. При этом образуются насыщенные и ненасыщенные углеводороды:
C20H42−→−tC10H22+C10H20.
В результате крекинга получают дополнительное количество бензина. Продукты крекинга содержат химически активные ненасыщенные углеводороды, которые используют в химической промышленности для производства полимеров и других органических веществ.
