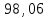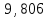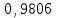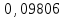|
|
_+И_- спектрде ж_тылу жола_ыны_ болуы (1). И спектрде жтылу жолаыны болуы
158 г/моль
*31,6 г/моль
1,58 г/моль
52,6 г/моль
5,26 г/моль
2. Сілтілік ортада KMnO4 MnO4- + e → MnO42- өзгеріске ұшырайды. Сілтілік ортадағы эквивалентінің молярлық массасы неге тең? М(KMnO4) = 158 г/моль: *158 г/моль 15,8г/моль
31,6 г/моль
3,16 г/моль
52,6 г/моль
3. Cr2O72- + 14HI+ + 6e→2Cr3+ + 7H2O тотығу тотықсыздану реакциясында калий дихроматы эквивалентінің молярлық массасы қанша?M(K2Cr2O7) = 294.22 г/моль. 38,09 г/моль
294,22 г/моль
*49,03 г/моль
29,42 г/моль
98,09 г/моль
4. М(K2Cr2O7) = 294.22 г/моль, СЭ = 0,02 моль/л 100 мл калий бихроматының ерітіндсін дайындауға қажетті массасын есептеңіз: A) 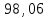
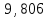
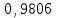
*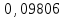
7. Иодометрия әдісінің титранты: { NaCl
(NH4)2C2O4
KMnO4
=Na2S2O3
Na2SO3}
8. Fe(II) тұзы ерітіндісін калий бихроматымен титрлеу кезінде титрлеу секірмесі 0,94-1,32 В потенциалдар мәндерінің интервалында жатыр. Эквиваленттік нүктені анықтауда қолданылатын индикатор:
{ дифениламин E0 = +0.76 B
=фенилантронил қышқылы E0 = +0.88 B
дифениламиназосульфон қышқылы E0 = +0.04 B
бейтарап қызыл E0 = +0.24 B
метил көк E0 = +0.53 B}
11. C2O42- - 2e → 2CO2 жартылай реакциясы берілген M(H2C2O4∙2H2O) = 126,08 г/моль, H2C2O4∙2H2O эквивалентінің молярлық массасын табыңыз:
{ 49,04
31,61
248,19
127
=63,04}
16. Тотығу-тотықсыздану потенциалының ерітіндінің иондық күшін ескерместен тотыққан және тотықсызданған формалардың концентрациясына тәуелділігі Нернст теңдеуімен сипатталады:
[a][+]Е = Е0 +0,059/n lg C(ok) /C(вос)
[a]Е = Е0 + nF/RT + ln C(ok) C(вос)
[a]Е = Е0 + RT/F ln C(ок) /C(вос)
[a]Е = Е0 + RT/n ln C(ok) /C(вос)
[a]Е = Е0 + RT/nFlnC(вос) /C(ок)
18. Тотығу-тотықсыздану титрлеу қисықтары мына координаттарда тұрғызылады:
[a][+] E – V
[a] pH – V
[a]E /V– V
[a] CЭ(ok) – V
[a] Cэ(вос) – V
1. Мордың аргентометиялық титрлеу әдісінде қолданылатын индикатор:
{ K2Cr2O7
= K2СrO4
PbCrO4
Ag2CrO4
BaCrO4}
2.Мына жағдайда Мор әдісімен хлоридтерді анықтауға болмайды:
{ рН>10 болғанда
рН<6,5 болғанда
H+, Pb2+, Ba2+, Bi3+катиондар қатысында
=PO43-, AsO43-, CO32-, C2O42-иондары қатысында
айтылғандардың барлығы}
3. Фольгардтыңаргентометриялықтитрлеуәдісіндеқолданылатыниндикатор:
{ (NH4)2Fe(SO4)2 ∙ 6H2O
=NH4Fe(SO4)2 ∙ 12H2O
FeSO4
K4[Fe(CN)6]
Fe2O3}
4. Меркуриметриялық титрлеуде қолданылатын реакция:
{ =2Cl- + Hg22+ → Hg2Cl2
2Cl- + Hg2+ → HgCl2
2Br- + Hg2+ → HgBr2
2I- + Hg2+ → HgI2
Cl- + Ag+ → AgCl}
5. Қай қосылыстың титрле секірмесі үлкенірек:
{ =Ks(AgI) = 8.3∙10-17
Ks(AgBr) = 5.3∙10-13
Ks(AgCl) = 1.8∙10-10
Ks(AgIO3) = 3.0∙10-8
Ks(Ag2Cr2O4) = 1∙10-12}
6. Тұндыру титрлеуінің титранты:
{ NaOH
HNO3
=AgNO3
Ca(NO3)2
NH4NO3}
11. Фольгард әдісінің титранты:
{ NaCl
AgNO3
= NH4SCN
I2
Na2S2O3}
1. Комплексон І:
A) Nа2Н2Y*2Н2О
B) H4Y
C) *H3Y
D) Nа2Y*2Н2О
E) Na3Y
4. Мына реакция бойынша негізделген әдіс қалай аталады Mg2+ + H2V2- = MgV2- + 2H:
A) кислқышқылдық негіздік әрекеттесу
*B) комплекс түзу
C)тұндыру
D) тотығу-тотықсыздану
E) гравиметрия
5. Комплексонометриялық анықтаудакомлексон (II) үшін Mg(II) эквиваленттік факторытең:
|
|
|
 Скачать 363.11 Kb.
Скачать 363.11 Kb.