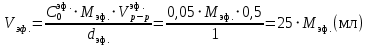8_кинетика омыления эфира. Исследование кинетики омыления сложного эфира Цель работы Определить константу скорости реакции омыления сложного эфира щелочью
 Скачать 36.13 Kb. Скачать 36.13 Kb.
|
Лабораторная работа № 8. Исследование кинетики омыления |
| Название эфира | |
| Химическая брутто-формула | |
| Молярная масса эфира 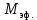 , г/моль , г/моль | |
| Концентрация раствора эфира: 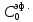 , моль/л , моль/л | |
| Объем раствора эфира 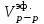 , мл , мл | |
| Объем эфира, взятого на приготовление раствора: Vэф., мл | |
| Объем раствора щелочи, взятого на омыление: VNaOH, мл | |
| Концентрация раствора щелочи, взятого на омыление: СNaOH, моль/л | |
| Объем пробы, отбираемой для анализа: 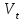 , мл , мл | |
| Концентрация соляной кислоты: 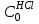 , моль/л , моль/л | |
| Объем соляной кислоты, отбираемой для остановки реакции 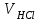 , мл , мл | |
| Концентрация щелочи для титрования: 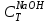 , моль/л , моль/л | |
Результаты титрования проб:
| № | t, мин | 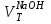 , мл , мл |
| 1 | 10 | |
| 2 | 20 | |
| 3 | 30 | |
| 4 | 40 | |
| 5 | 50 | |
| 6 | 60 | |
| 7 | 70 | |
| 8 | 80 | |
| 9 | 90 | |
| 10 | 100 | |
Обработка результатов эксперимента
1. По результатам титрования для каждой из отобранных проб рассчитать концентрацию гидроксида натрия
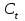 по формуле
по формуле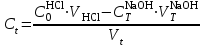
2. Заполнить таблицу
| № | t, мин | 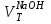 , мл , мл | 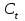 | ‑ 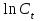 | 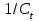 | 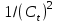 |
| 1 | 10 | | | | | |
| 2 | 20 | | | | | |
| 3 | 30 | | | | | |
| | … | | | | | |
| 10 | 100 | | | | | |
3. По данным таблицы построить
3.1) зависимость
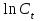 от времени;
от времени;3.2) зависимость
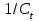 от времени;
от времени;3.3) зависимость
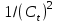 от времени.
от времени.4. Для каждой из зависимостей построить линейную линию тренда и вывести на график уравнение линии тренда и коэффициент апппроксимации.
5. Выбрать зависимость, у которой коэффициент аппроксимации будет ближе всего к единице.
6. Угловой коэффициент уравнения линии тренда – значение константы скорости реакции.
Содержание отчета по лабораторной работе
1. Название работы.
2. Цель работы.
3. Ход эксперимента.
4. Экспериментальные данные (см. протокол к лабораторной работе).
5. Обработка экспериментальных данных.
6. Вывод.

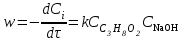 .
.