отчет химия овр. Исследование окислительновосстановительных реакций
 Скачать 31.31 Kb. Скачать 31.31 Kb.
|
|
Министерство образования и науки Российской Федерации САНКТ-ПЕТЕРБУРГСКИЙ ГОРНЫЙ УНИВЕРСИТЕТ ЛАБОРАТОРНАЯ РАБОТА ПО ХИМИИ ОТЧЕТ Тема: ИССЛЕДОВАНИЕ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ Выполнил: студент гр. (шифр группы) (подпись) (Ф.И.О.) Оценка: Дата: Проверил преподаватель: доцент Кужаева А.А. (должность) (подпись) (Ф.И.О.) Санкт-Петербург 2021 Цель работы: познакомиться с наиболее распространенными окислителями и восстановителями, с продуктами их взаимодействия между собой и научиться составлять уравнения окислительно-восстановительных реакций. Общие сведения: Высшая степень окисления элемента равна номеру группы периодической системы, в которой данный элемент расположен. Низшая отрицательная степень окисления равна числу электронов, которое может принять данный элемент на застраивающийся np-подуровень. В простых веществах степень окисления равна нулю. Степени окисления переменно-валентных элементов рассчитывают по правилу баланса зарядов: «сумма степеней окисления всех элементов в соединении равна нулю, а в многоатомном ионе – заряду иона». Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления. Окислитель при этом принимает электроны на валентную оболочку, а восстановитель отдает электроны. Правила составления уравнений окислительно-восстановительных реакций следующие: 1) Определяют степени окисления переменно-валентных элементов, окислитель и восстановитель 2) Составляют ионные уравнения полуреакций окисления и восстановления. Для уравнивания числа атомов кислорода добавляют воду и ионы: H+ в кислой среде или ОН в щелочной среде. 3) Приводят число электронов к наименьшему общему кратному, в примере к 6. Для этого уравнения полуреакций домножают на соответствующие коэффициенты. В результате получают ионное уравнение реакции: 4) Составляют молекулярное уравнение реакции путем добавления к ионам имеющихся в растворе противоионов. Cогласно принципу Ле-Шателье, в кислой среде, при избытке ионов Н+, равновесие смещается влево. В щелочной среде, когда ионы Н+ в недостатке, равновесие смещено вправо. Опыт №1 H2O2 + H2SO4 + 2KI 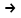 K2SO4 + I2 + 2H2O – после добавления крахмала раствор окрасился в синий цвет. K2SO4 + I2 + 2H2O – после добавления крахмала раствор окрасился в синий цвет.2O– + 2e– 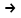 2O2– окислитель 2O2– окислитель2I– – 2e– 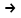 2I20 восстановитель 2I20 восстановительОпыт №3 5Na2S + 2KMnO4 + 8H2SO4 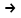 2MnSO4 + 5S↓ + K2SO4 + 5Na2O + 3H2O– выделение серы. Цвет раствора мутно белый. 2MnSO4 + 5S↓ + K2SO4 + 5Na2O + 3H2O– выделение серы. Цвет раствора мутно белый.Mn7+ +5e- =Mn2+ окислитель S2- -2e- =S0 восстановитель Опыт №6 2KI + 2NaNO2 + 2H2SO4 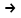 I2 + 2NO + K2SO4 + Na2SO4 + 2H2O – после добавления крахмала раствор окрасился в тёмно-фиолетовый цвет. I2 + 2NO + K2SO4 + Na2SO4 + 2H2O – после добавления крахмала раствор окрасился в тёмно-фиолетовый цвет.2I– – 2e→I2 восстановитель N3+ + 1e–→N2+ окислитель Опыт №7 2KMnO4+5NaNO2+3H2SO4 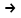 2MnSO4+5NaNO3+K2SO4+3H2O – при добавлении H2SO4 раствор стал прозрачным, выделение газа. Mn7++5ē→Mn2+ восстановитель 2MnSO4+5NaNO3+K2SO4+3H2O – при добавлении H2SO4 раствор стал прозрачным, выделение газа. Mn7++5ē→Mn2+ восстановительN3+-2ē→N5+ окислитель Опыт №8 1) K2Cr2O7+4H2SO4+3Na2SO3 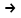 Cr2(SO4)3 +3Na2SO4+K2SO4+H2O – при добавлении Na2SO3 раствор стал темно-зеленого цвета Cr2(SO4)3 +3Na2SO4+K2SO4+H2O – при добавлении Na2SO3 раствор стал темно-зеленого цветаCr6++3ē→Cr3+ S+4-2ē→S6+ 2)K2Cr2O7+7H2SO4+ 3Na2S 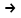 Cr2(SO4)3+3Na2SO4+K2SO4+7H2O+3S – раствор окрасился в мутно-зеленый цвет, выпадение серы. Cr2(SO4)3+3Na2SO4+K2SO4+7H2O+3S – раствор окрасился в мутно-зеленый цвет, выпадение серы.2Cr6++6ē→Cr23+ S2--2ē→S0 3) K2Cr2O7+7H2SO4+6Fe2SO4  Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O – раствор стал красного цвета. Cr2(SO4)3+3Fe2(SO4)3+K2SO4+7H2O – раствор стал красного цвета.2Cr6++6ē→Cr23+ 2Fe+2-2ē→2Fe+3 Опыт №9 (А)Кислая среда 1) 2KMnO4+8H2SO4+10KI=5I2+2MnSO4+6K2SO4+8H2O  Mn7++5ē→Mn2+ 2 Mn7++5ē→Mn2+ 22I--2ē→I02 5 раствор ярко-оранжевого цвета 2) 2KMnO4+8H2SO4+10Fe2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O  Mn7++5ē→Mn2+ 2 Mn7++5ē→Mn2+ 22Fe+2-2ē→2Fe+3 5 раствор обесцветился 3) 2KMnO4+3H2SO4+5Na2SO3=5Na2SO4+2MnSO4+K2SO4+3H2O  Mn7++5ē→Mn2+ 2 Mn7++5ē→Mn2+ 2S4+-2ē→S6+ 5 раствор бледно-желтого цвета (Б) Нейтральная среда 1) 2KMnO4+3Na2SO3+H2O =2MnO2 +3Na2SO4+2KOH  Mn7++3ē→Mn4+ 2 Mn7++3ē→Mn4+ 2S+4-2ē→S+6 3 выпал коричневый осадок. 2) 2KMnO4+3MnSO4+2H2O→5MnO2+K2SO4+2H2SO4  Mn7++3ē→Mn4+ 2 Mn2+-2ē→Mn4+ 3 раствор стал мутно-коричневого цвета. (В) 2KMnO4+KOH +Na2SO3 =Na2SO4 +2K2MnO4 +H2O  Mn7++ē→Mn6 2 Mn7++ē→Mn6 2S+4-2ē→S+6 1 раствор стал бледно-зеленого цвета. Заключение: из проведенных реакции следует, что перманганат калия обладает наибольшими свойствами окислителя в кислой среде. Вывод: В результате, после выполнения данной лабораторной работы, были изучены окислительно-восстановительные реакции, также были получены знания по составлению уравнений окислительно-восстановительных реакций. |
