Исследование окислительно восстановительных реакций
 Скачать 88.1 Kb. Скачать 88.1 Kb.
|
|
Министерство науки и образования Российской Федерации  Федеральное государственное бюджетное образовательное учреждение высшего образования Санкт - Петербургский горный университет Кафедра общей химии Лабораторная работа № 6 По дисциплине: ХИМИЯ (наименование учебной дисциплины согласно учебному плану) Тема: «Исследование ОКИСЛИТЕЛЬНО - ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ » Выполнил: студент гр. ГТС-20 Степанов И.А. Проверил: Санкт - Петербург 2021 Цель работы: познакомиться с наиболее распространенными окислителями и восстановителями, с продуктами их взаимодействия между собой и научиться составлять уравнения окислительно-восстановительных реакций. Общие сведенияОкислительно-восстановительными называют реакции, протекающие с изменением степени окисления элементов. Степень окисления – это гипотетический заряд, который был бы на атомах данного элемента, если бы соединение было построено из ионов. Высшая степень окисления элемента равна номеру группы периодической системы, в которой данный элемент расположен. Низшая отрицательная степень окисления равна числу электронов, которое может принять данный элемент на застраивающийся np-подуровень: zmin = N – 8, где N – номер группы. Например, у серы высшая степень окисления равна 6, а низшая: 6 – 8 = −2. В простых веществах степень окисления равна нулю. Многие элементы проявляют в соединениях постоянные значения степени окисления: фтор −1; кислород −2, кроме пероксидов, в которых степень окисления кислорода −1; щелочные металлы +1; щелочноземельные металлы +2; водород, кроме гидридов и органических соединений, +1. Степени окисления переменновалентных элементов рассчитывают по правилу баланса зарядов: «сумма степеней окисления всех элементов в соединении равна нулю, а в многоатомном ионе – заряду иона». Например, в дихромате калия K2Cr2O7 согласно балансу зарядов 2zK + 2zCr + 7zO = 0, следовательно, подставив zK = 1 и zO = −2, получаем zCr = +6; в перманганат-ионе 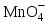 zMn + 4zO = −1, следовательно, zMn = +7. zMn + 4zO = −1, следовательно, zMn = +7. Окислителем называют элемент, который в ходе реакции понижает степень окисления, а восстановителем – элемент, который повышает степень окисления. Окислитель при этом принимает электроны на валентную оболочку, а восстановитель отдает электроны. Правила составления уравнений окислительно-восстановительных реакций следующие. Возьмем в качестве примера восстановление перманганата нитритом калия в нейтральной среде: KMnO4 + KNO2 + H2O = Определяют степени окисления переменновалентных элементов, окислитель и восстановитель. Калий, кислород и водород имеют постоянные значения степеней окисления, указанные выше. По балансам зарядов вычисляем zMn = +7, zN = +3. Поскольку марганец в высшей степени окисления, равной номеру группы, он является окислителем. Азот может повысить степень окисления до номера группы +5, поэтому он является восстановителем. Составляют ионные уравнения полуреакций окисления и восстановления. Для уравнивания числа атомов кислорода добавляют воду и ионы: H+ в кислой среде или ОН в щелочной среде. Восстановление:  . .Окисление: 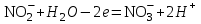 . .Приводят число электронов к наименьшему общему кратному, в примере к 6. Для этого уравнения полуреакций домножают на соответствующие коэффициенты, в примере на 2 и 3. Суммируют уравнения полуреакций, сокращая одинаковые члены в левой и правой частях и учитывая нейтрализацию Н+ + ОН = Н2О. В результате получают ионное уравнение реакции: 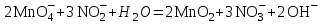 . .Составляют молекулярное уравнение реакции путем добавления к ионам имеющихся в растворе противоионов: 2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2KOH. Глубина восстановления перманганата зависит от кислотности среды. В кислой среде перманганат восстанавливается до степени окисления +2 согласно полуреакции: 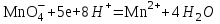 . .В нейтральной среде, ввиду недостатка ионов Н+, восстановление идет до MnO2 по приведенной в примере полуреакции. В щелочной среде восстановление заканчивается уже на стадии образования Mn(6+) в форме манганат-иона 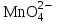 . Уравнение полуреакции: . Уравнение полуреакции: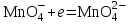 . .От кислотности среды зависит также состояние в растворе хрома (VI) вследствие протекания реакций:  . .Cогласно принципу Ле-Шателье, в кислой среде, при избытке ионов Н+, равновесие смещается влево, и хром находится в растворе в форме оранжевого дихромата. В щелочной среде, когда ионы Н+ в недостатке, равновесие смещено вправо, и хром переходит в форму желтого хромата. Окислительная способность хрома (VI) выше в кислой среде. Дихромат – сильный окислитель, восстанавливающийся по полуреакции: 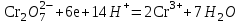 . .Хромат – слабый окислитель, поэтому хром (VI) получают обычно окислением хрома (3+) в щелочной среде по полуреакции: 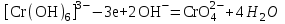 . .Протокол лабораторной работы: 1 Опыт: Окислительные св-ва перекиси водорода.  H2O2+H2SO4+2KI=I2+K2SO4+2H2O H2O2+H2SO4+2KI=I2+K2SO4+2H2O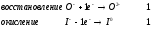 В ходе реакции раствор стал коричневого цвета, после добавления крахмала – стал темносиним. 3 Опыт: Восстановительные свойства сульфидов.  2KMnO4 + 3H2SO4 + 5H2S = 8H2O + K2SO4 + 2MnSO4 + 5S 2KMnO4 + 3H2SO4 + 5H2S = 8H2O + K2SO4 + 2MnSO4 + 5S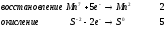 В ходе реакции раствор обесцветился 6 Опыт: Окислительные и восстановительные свойства нитритов. (А) 6KI + 4H2SO4 + 2NaNO3 = 4H2O + 3K2SO4 + 2NO + 3I2 + Na2SO4  В ходе реакции произошла бурная хим. реакция с выделением NO2 и изменением цвета на тёмно-рыжый. 7 Опыт: 2KMnO4 + 3H2SO4 + 5NaNO2 = 3H2O + K2SO4 + 2MnSO4 + 5NaNO3 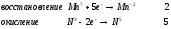 Обесцвечивание раствора 8 Опыт K2Cr2O7 + 4H2SO4 + 3Na2SO3 = 4H2O + K2SO4 + Cr2(SO4)3 + 3Na2SO3 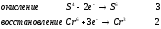 В ходе реакции раствор окрасился в зелёный цвет, ощущалось выделение тепла  K2Cr2O7 + 7H2SO4 + 6KI = 7H2O + 4K2SO4 + Cr2(SO4)3 + 3I2 K2Cr2O7 + 7H2SO4 + 6KI = 7H2O + 4K2SO4 + Cr2(SO4)3 + 3I2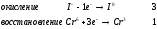 В ходе реакции раствор помутнел, S выпала в осадок. K2Cr2O7 + 7H2SO4 + 6FeSO4 = 7H2O + K2SO4 + Cr2(SO4)3 + 3Fe2(SO4)3 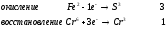 В ходе реакции раствор чуть-чуть помутнел, после добавления NaSCNокрасился в красный цвет. 9 Опыт Кислая 1) 2KMnO4 + 8H2SO4 + 10KI = 8H2O + 6K2SO4 +2MnSO4 + 5I2  В ходе реакции раствор не менял своего цвета, наблюдался осадок I2 2KMnO4 + 3H2SO4 + 5 Na2SO3 = 3H2O + K2SO4 +2MnSO4 + 5Na2SO3 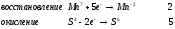 В ходе реакции раствор обесцветился 3) 2KMnO4 + 3H2SO4 + 10FeSO4 = 8H2O + K2SO4 +2MnSO4 + 5Fe2(SO4)3 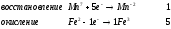 В ходе реакции раствор обесцветился Нейтральная 1) KMnO4 + 2Na2SO3 = MnO2 + 2Na2SO4 + K 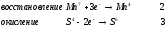 В ходе реакции раствор стал на половину прозрачный, выпал осадок 2) 2KMnO4 + 3MnSO4 = K2SO4 +5MnO2 + Mn(SO4)2  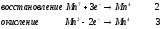 В ходе реакции раствор стал коричневого цвета и помутнел (В) 2KMnO4 + 6KI + 4H2O = 2KMnO2 + 8KOH + 3I2  В ходе реакции раствор стал бирюзовым Вывод: познакомилась с наиболее распространенными окислителями и восстановителями ,с продуктами их взаимодействия между собой и научилась составлять уравнения ОВР. |
