Исследование зависимости скорости гетерогенного процесса от темп. Исследование зависимости скорости гетерогенного процесса от температуры, выявление лимитирующих стадий процесса
 Скачать 1.23 Mb. Скачать 1.23 Mb.
|
|
Работа № 10. ИЗУЧЕНИЕ ФОРМАЛЬНО-КИНЕТИЧЕСКИХ ЗАКОНОМЕРНОСТЕЙ РЕАКЦИИ ГОРЕНИЯ УГЛЕРОДА В АТМОСФЕРЕ ВОЗДУХА Цель работы: исследование зависимости скорости гетерогенного процесса от температуры, выявление лимитирующих стадий процесса. Строим 2 зависимости (рис.1) - «изменение температуры – время» и «убыль массы - время». 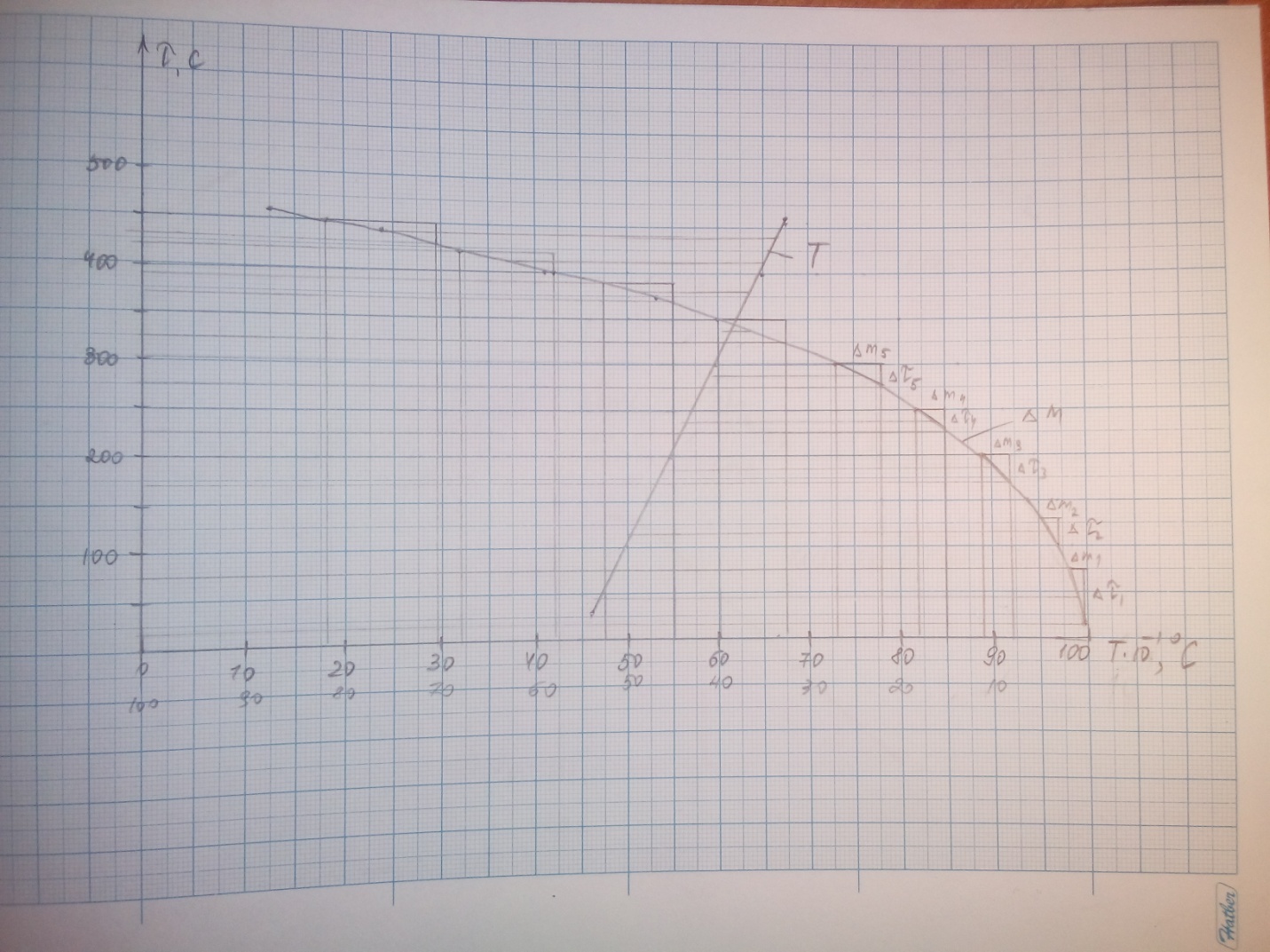 Рис.1. Изменение массы и температуры со временем Графическим дифференцированием зависимости «убыль массы – время» определяем скорость процесса  при нескольких температурах. при нескольких температурах.Результаты заносим в табл. 1 и строим график зависимости ln v −1/T . Таблица 1 Результаты опыта
Для кинетического режима реакции справедлива линейная зависимость в координатах lnν−1/T . Действительно, логарифмируя уравнение ν=νхр=Аe-E/RT, получим lnν=lnА-E/RT (1) Считая, что y ≡ ln vхим , a ≡ ln A, b ≡ −E / R , x ≡ 1/T , уравнение (1) можно записать в виде прямолинейной функции y = a + bx. Тогда энергию активации E находят по тангенсу угла α наклона прямой в координатах ln ν −1/T , как E = −R⋅ tgα (E > 0, tgα < 0) .  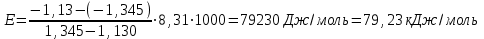  Рис. 2. Зависимость в координатах lnν−1/T . 1000/1,345=743 К 1000/1,130=885 К Интервал температур, в котором реакция протекает в кинетическом режиме – от 743 до 885 К. ВЫВОД: Скорость процесса увеличивается с увеличением температуры. Для кинетического режима при пониженных температурах скорость химического взаимодействия мала и выравнивание концентраций газов у поверхности угля и в объеме газовой фазы успевает завершиться, не задерживая процесса горения. Другими словами, константа скорости диффузии К диф=D/δ в выражении для скорости гетерогенной реакции окажется большей по сравнению с константой адсорбционно-химического взаимодействия 1/k. С повышением температуры значительная часть молекул окислителя обладает необходимым избытком энергии и, достигая поверхности графита, вступает с ним в реакцию. Это приводит к обеднению близлежащего слоя газа молекулами кислорода и обогащению его продуктами реакции. На том режиме при достаточно высоких температурах скорость всего процесса начнет определяться скоростью диффузии. Для кинетического режима интервал температур от 743 до 885 К. Для диффузионного режима - от 885 до 948 К. Способ определения энергии активации - графический и величина энергии активации химической реакции 79,23 кДж/моль. |
