К ВОПРОСУ О ПОЛУЧЕНИИ КАРДИОМИОЦИТОВ ИЗ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК. Абу-Салех. К вопросу о получении кардиомиоцитов из индуцированных плюрипотентных стволовых клеток
 Скачать 490.49 Kb. Скачать 490.49 Kb.
|
|
К ВОПРОСУ О ПОЛУЧЕНИИ КАРДИОМИОЦИТОВ ИЗ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК Абу-Салех М.С., Григорьева Ю.В. Кафедра гистологии, цитологии и эмбриологии, Ростовский государственный медицинский университет, г. Ростов-на-Дону Кафедра гистологии, цитологии и эмбриологии, Самарский государственный медицинский университет, Россия Аннотация: Развивающимся направлением медицины является использование стволовых клеток, способных дифференцироваться до конечных гистогенетических единиц, с целью лечения различных заболеваний. Инфаркт миокарда — основное проявление ИБС, приводящее к гибели в области ишемии кардиомиоцитов и замещением дефекта волокнистым компонентом межклеточного вещества соединительной ткани. В результате формируется рубец не способный сокращаться, что приводит к развитию сердечной недостаточности и, даже, к разрыву стенки всего сердца. Достижения в современных клеточных технологиях позволили разработать новый способ лечения ИБС – трансплантацию кардиомиоцитов, выращенных из индуцированных плюрипотентных стволовых клеток. Ключевые слова: Ишемическая болезнь сердца, инфаркт миокарда, кардиомиоциты, индуцированные плюрипотентные стволовые клетки. OBTAINING CARDIOMYOCYTES FROM INDUCED PLURIPOTENT STEM CELLS AND THEIR APPLICATION IN THERAPY OF ISCHEMIC HEART DISEASE Abu-Saleh M.S. Department of Histology, Cytology and Embryology Rostov State Medical University, Rostov-on-Don, Russia Abstract: A developing area of medicine is the use of stem cells capable of differentiating to final histogenetic units for the treatment of various diseases. Myocardial infarction is the main manifestation of ischemic heart disease, leading to the death of some cardiomyocytes and the development of connective tissue around ofmyocardial ischemia. As a result, a scar is formed; such tissue in the heart is unable to contract, which leads to the development of heart failure. Thanks to the achievements of fundamental medicine, a new method of treating coronary artery disease has been proposed - transplantation of cardiomyocytes grown from induced pluripotent stem cells. Key words: Ischemic heart disease, myocardial infarction, cardiomyocytes, induced pluripotent stem cells. Стволовые клетки у человека имеются как во внутриутробном, так и в постнатальном периодах онтогенеза – они поддерживают свои популяции благодаря способности к самообновлению. Во взрослом организме ими осуществляются обновление (т.н. физиологическая рег.) и восстановление (т.н. репаративная рег.) тканей и органов. Стволовой называется недифференцированная, а следовательно, неспециализированная клетка, способная дать начало узким клеточным типам, характеризующаяся способностью к самообновлению и обеспечивающая физиологическую и репаративную регенерацию. Из определения вытекает 2 основных свойства стволовых клеток: - наличие потентности (фенотипических вариаций, обусловленных различной экспрессией генов); - способность к самообновлению (бывает а) ассиметричным – в ходе пролиферации образуется одна стволовая и одна дифференцирующаяся специализированная клетка [2]; б) стохастическим – в ходе пролиферации образуются две дифференцирующиеся узкоспециализированные клетки [1]). Каждая клетка обладает т.н. потентностью, определяющуюся различной активностью генов, и, как следствие, различной экспрессией белков, производимых клеткой. Важным напоминанием является тот факт, что все клетки организма обладают одинаковым набором генетической информации, но развитие того или иного типа ткани связано с канализацией развития. В зависимости от уровня дифференцировки выделяют следующие клеточные потенции: тотипотентность – способность клеточной линии дать начало всему организму (зигота и бластомеры, собственно, до начала гаструляции); плюрипотентность – разделение линий на способность дать начало либо зародышу, либо провизорным (внезародышевым) органам; мультипотентность – развитие т.н. клеток-родоначальниц, способных развиваться в пределах одного зародышевого листка (этапы гаструляции и нейруляции). Стоит сказать, что мультипотентные клетки-родоначальницы в небольшой массе сохраняются и у взрослого организма; полипотентность объясняется способностью клетки-родоначальницы давать начало клеткам в пределах уже одной только определенной ткани; унипотентными называются т.н. клетки-предшественницы, дающие начало определенному клеточному типу (как пример, из клеток-предшественниц уротелия будут развиваться только уротелиоциты). В 2012 году специалистам по клеточной биологии — Синье Яманаке (Япония) и Джону Гёрдону (Великобритания) была присуждена Нобелевская премия в области физиологии или медицины за работы по стволовым клеткам и клонированию животных [4]. Группа ученых под руководством Яманаки разработала метод получения из обычных дифференцированных клеток человека (фибробластов) стволовые. Эти клетки получили название индуцированные плюрипотентные стволовые клетки [5]. Индуцированные плюрипотентные стволовые клетки получают из соматических клеток репрограмируя их эпигеном – совокупность факторов, влияющих на транскрипцию и трансляцию ДНК, не затрагивающих саму нуклеотидную последовательность. Совершается эпигенетическое репрограммирование путем влияния регуляторных факторов транскрипции (белков, экспрессируемых одним из генов семейства Pax, контролирующих процесс транскрипции путем связывания себя с молекулой ДНК: активаторы, репрессоры, различные полимеразы) на экспрессию генов [8]. С помощью генетических манипуляций, используя ретровирусную трансфекцию (встраивание), ученые произвели трансформацию мышиных эмбриональных фибробластов в индуцированные плюрипотентные стволовые клетки с помощью комбинации факторов, называемых коктейлем Яманаки: Oct-4, Sox2, c-Myc и Klf4 (рис. 1). Четверо этих регуляторных факторов транскрипции активно экспрессируются в недифференцированных эмбриональных стволовых клетках и необходимы им для поддержания плюрипотентного состояния [3]. 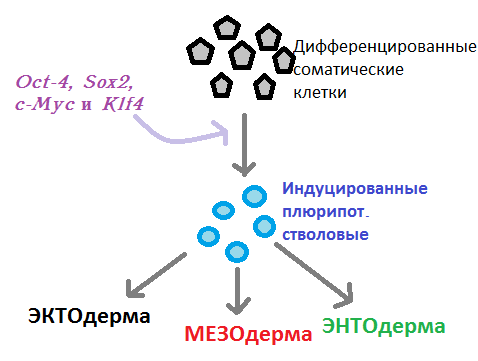 Рис.1. Схема воздействия коктейля Яманаки на дифференцированные соматические клетки. Получив популяцию индуцированных плюрипотентных стволовых клеток (ИПСК), далее направляют ее дифференцировку в сторону образования кардиомиоцитов методом сокультивирования их с клеточной линией END-2 согласно методике Маммери и соавт. от 2007 г. в течение 24 суток [7]. Кардиомиоциты (КМЦ), полученные из ИПСК спустя 24 дня культивирования по методике Маммери с соавт. [7], в основе своей похожи на обычные КМЦ – у них схожий набор ионных каналов, структура саркомеров и миофибрилл, но морфологически у них меньший размер, округлая форма (подобная незрелым фетальным КМЦ), недоразвитые органеллы и внутренние системы. Потому их классифицировали как клетки «ранней стадии» [6]. 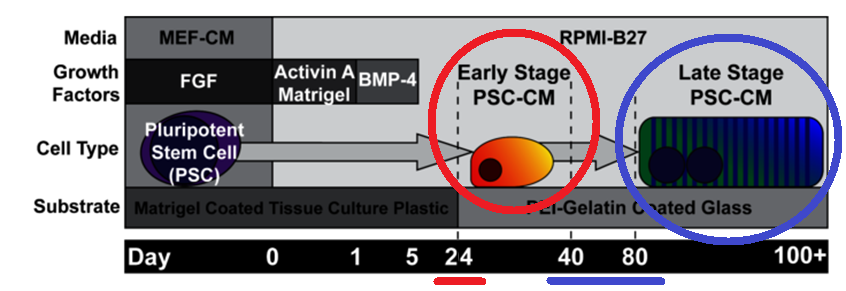 Рис. 2. Схема дифференциации и созревания кардиомиоцитов из ИПСК (по Mignoneetal., 2010) [6]. ИПСК поддерживали в среде, кондиционированной фибробластами мыши-эмбриона (MEF-CM) с добавлением фактора роста фибробластов (FGF), и дифференцировали в кардиомиоциты путем последовательной обработки активином A и BMP-4. Активность спонтанного биения обычно начиналась на 14-й день. На 20-й день культуру клеток повторно наносили на покровные стекла, покрытые PEI-желатином. Линию клеток «ранней стадии» после 24 дня культивирования переносят в среду с жестким субстратом из фибрилл коллагена, что позволяет им зафиксироваться и облегчить ориентировку в пространстве, в результате чего они вытягиваются вдоль волокон, что ведет и к последующим физиологическим изменениям. Также в среде находятся другие типы клеток (фибробласты, эндотелиоциты) для создания наиболее близких к естественным условий микроокружения [6]. К 40-80 дню КМЦ изменяются морфологически и физиологически и уже почти полностью похожи на естественные зрелые КМЦ. Они становятся более поляризованными, их миофибриллы уплотняются и саркомеры становятся более структурированными. Помимо этого, отмечается более зрелый с физиологической точки зрения, характер сокращения [6]. 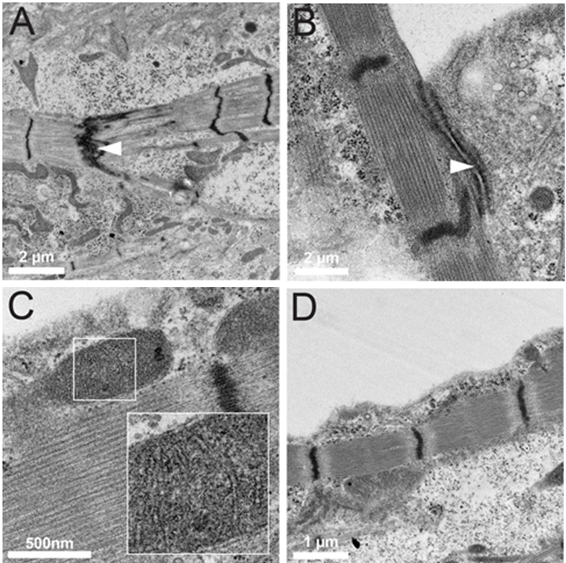 Рис.3. Кардиомиоциты, полученные из ИПСК (по Mignoneetal., 2010) [6]. (А) Подробный ультраструктурный анализ продемонстрировал сращение фасций между миофибриллами последовательно; (B) поперечные щелевые соединения между соседними клетками; (C) митохондрии с многочисленными кристами, расположенными рядом с саркомерными структурами; (D) повторяющиеся гребешки мембран в соответствии с Z-дисками. По результатам исследований invitro, была обозначена возможность клеточной терапии ишемической болезни сердца с помощью культур клеток КМЦ, полученных из ИПСК, причём, линии «ранней стадии» ввиду их морфологической незрелости, для возможности созревания непосредственно invivo. По способам доставки культуры клеток в сердце были предложены: а) интракоронарная инфузия; б) транскоронарная инъекция и в) прямая интрамиокардиальная инъекция [9]. Заключение. Таким образом, по результатам анализа нашего литературного обзора, были обозначены: 1) основные понятия о стволовых клетках; 2) понятие и методы получения ИПСК; 3) метод получения КМЦ из ИПСК; 4) морфология созревших из ИПСК кардиомиоцитов; 5) перспективный способ терапии ИБС. Список литературы: Вермель, А. Е. Стволовые клетки : общая характеристика и перспективы применения в клинической практике / А. Е. Вермель // Клиническая медицина. 2004. № 1. С. 5–11. Зуева, Е. Е. Стволовые клетки. Некоторые биологические особенности и терапевтические возможности / Е. Е. Зуева, А. В. Куртова, Л. С. Комарова // Гематология. 2005. Т. 6. С. 705–724. Christophersen NS, Helin K. "Epigenetic control of embryonic stem cell fate". J Exp Med. 207 (11), 2010: 2287–95. doi:10.1084/jem.20101438. PMC 2964577. PMID 20975044. Ladewig J., Mertens J., Kesavan J., et al. Small molecules enable highly efficient neuronal conversion of human fibroblasts. (англ.) // Nature methods. — 2012. — Vol. 9, no. 6. — P. 575—578. — DOI:10.1038/nmeth.1972. — PMID 22484851. Lin J., Li M. R., Ti D. D., et al. Microenvironment-evoked cell lineage conversion: Shifting the focus from internal reprogramming to external forcing. (англ.) // Ageing research reviews. — 2013. — Vol. 12, no. 1. — P. 29—38. — DOI: 10.1016/j.arr.2012.04.002. — PMID 22561469. Mignone JL, Kreutziger KL, Paige SL, Murry CE. Cardiogenesis from human embryonic stem cells. Circ J 2010; 74: 2517- 2526. Mummery C. L., Ward D., Passier R. Differentiation of human embryonic stem cells to cardiomyocytes by coculture with endoderm in serum-free medium // Curr Protoc Stem Cell Biol. —2007. —Jul. —V. Chapter 1. —P. Unit 1F.2. Pandian G. N., Nakano Y., Sato S., et al. Synthetic small molecule for rapid induction of multiple pluripotency genes in mouse embryonic fibroblasts. (англ.) // Scientific reports. — 2012. — Vol. 2. — P. 544. — DOI:10.1038/srep00544. — PMID 22848790. Tongers, J., Losordo, D. W., & Landmesser, U. Stem and progenitor cell-based therapy in ischaemic heart disease: promise, uncertainties, and challenges. European Heart Journal, 32(10), 1197–1206. 2011. DOI:10.1093/eurheartj/ehr018. |
