Класс соединений
|
Основные химические свойства
|
Характерные механизмы реакций
|
Качественные реакции
|
Алканы
СnH2n+2
|
Замещение, галогенирование, нитрованее, дегидрирование, дегидроциклизация(Pt), пиролиз, крекинг, горение, изомеризация AlCl3(разв.угл.скелет), ароматизация, каталитическое окисление кислородом(метан до спирта,бутан до этановаой кислоты)
|
SR-замещение
|
Для этого газ либо поджигают — горение алканов сопровождается синим пламенем, либо пропускают через раствор перманганата калия. Алканы не окисляются перманганатом калия на холоду, вследствие этого раствор не будет изменять окраску.
|
Алкены
CnH2n
|
Гидрирование, галогенирование, гидрогалогенирование, гидратация, полимеризация, окисление(мягкое и жесткое(полный разрыв связей )), горение, замещение в боковой цепи, изомеризация
|
AE-присоединение
AN-присоединение
|
1. Обесцвечивание бромной воды
2. Изменение окраски раствора перманганата калия(Реакция Вагнера)
|
Алкины
CnH2n-2
|
Галогенирование, гидрогалогенирование, гидратация, гидрирование,тримеризация, димеризация(CuCl3 бутен1-ин-3), окисление, реакции с основаниями, полимеризация, горение
|
AE-присоединение
AR-присоединение
|
Взаимодействие с с аммиачным раствором оксида серебра (гидроксид диаминсеребра (I)) (реактив Толленса)
Только для алкинов с тройной связью у крайнего атома углерода (!)
C2H2 + 2[Ag(NH3)2]OH ——> Ag2C2↓ + 4NH3↑ + 2H2O
(белый осадок ,выделение аммиака)
|
Амины
CnH2n+1NH2
|
С водой ,кислотами, алкилирование, с солями, окисление, с азотистой кислотой

Анилин-галогенирование, сульфирование, окисление, диазотирование

|
SN-замещение
|
а) Лакмус(Синий цвет)
б) Взаимодействие с галогеноводородами (HHal)( Образуют соли с галогеноводородами — после выпаривания твердый осадок.)
На анилин:
а)Взаимодействие с бромной водой(обесцвечивание р-ра)
б)Взаимодействие с хлорной известью(Сиреневая окраска)
C6H5NH2 + Ca(Cl)OCl = C6H5NO2+CaCl2+3H2O
|
Ароматические углеводороды
CnH2n-6
|
Галогенирование, нитрование, гидрировние, замещение, алкилирование(AlCl3,H2SO4), сульфирование, окисление, горение,
|
SE-замещение
|
Ароматические углеводороды образуют с формалином в присутствии серной кислоты ярко окрашенные продукты конденсации. Это свойство используют как качественную реакцию на присутствие ароматических углеводородов в нефтепродуктах.
|
Спирты
CnH2n+1OH
|
С растворами щелочей, с гидроксидом меди,Щел. и ЩЗ металлами, с галогенводородами, межмолекулярная и внутримолекулярная дегидратация, с карбоновыми кислотами, окисление, окисление оксидом меди до альдегида(кислородом с катализатором Cu, жесткое окисление, горение, дегидрирование, этерификация
|
SN-замещение
E-элиминирование
|
1.На одноатомные:
а)Окисление спирта оксидом меди,раствор становится фиолетовым благодаря фуксинсернистой кислоте.
б)Взаимодействие с натрием.
2.На многоатомные:
Взаимодействие с гидроксидом меди (II)без нагревания
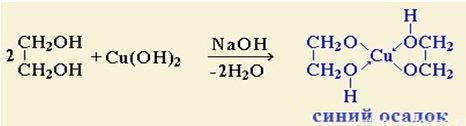

|
Фенолы
CnH2n-7OH
|
Фенолы являются более сильными кислотами, чем спирты и вода, т. к. за счет участия неподеленной электронной пары кислорода в сопряжении с π-электронной системой бензольного кольца полярность связи О–Н увеличивается
С растворами щелочей,Щел. и ЩЗ металлами,с щелочами,галогенирование и нитрование,с алкилгалагенидами, сульфирование, гидрирование, поликондесация, гидрирование, реакция с FeCl3, с альдегидами с образование фенолформальдегида, горение, окисление хромовой смесью
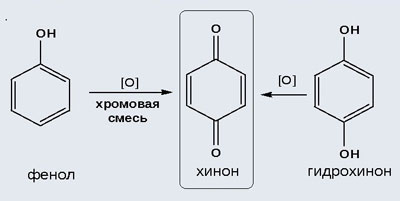
|
SE-замещение
SN-замещение
|
Реакция с FeCl3(фиолетовое окрашивание)
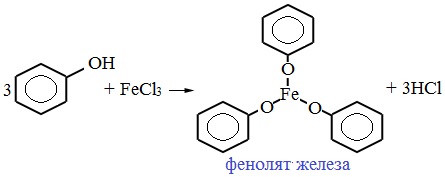
|
Альдегиды
CnH2nO
|
Взаимодействие со спиртами (в присутствии кислоты или основания как катализатора) Восстановление до спирта, окисление, гидратация,с аммиаком, окисление, присоединение реактивов Гриньяра – синтез спиртов всех типов, горение, окисление, а-галогенировние, полимеризация, поликонденсация, диспропорционирование, присоединение циановодородной (синильной) кислоты НСN
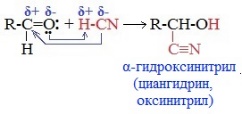
С гидроксиламином

Ацетали и полуацетали
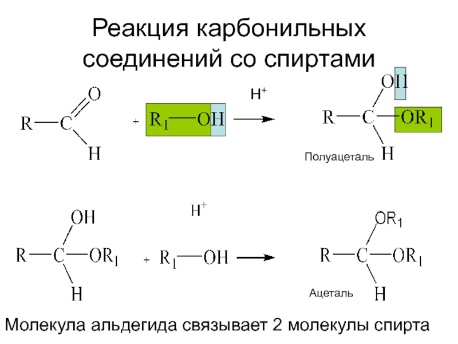
С гидросульфатом натрия

Получение гидрозонов
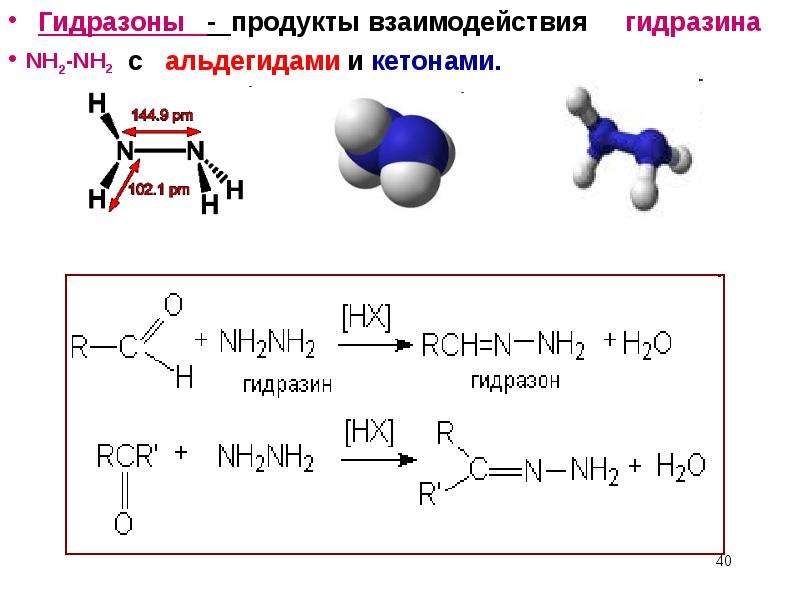
|
AN-присоединение
|
а) Взаимодействие с аммиачным раствором оксида серебра (реакция серебряного зеркала)
CH3-CHO + 2[Ag(NH3)2]OH —> CH3-COOH + 2Ag↓ + 4NH3↑ + H2O (реакция идет при нагревании)поверхность пробирки становится зеркальной
б) Взаимодействие с гидроксидом меди (II) (реакция медного зеркала)
Для этого к свежеприготовленному гидроксиду меди (II) добавляют альдегид и нагревают смесь:
CuSO4 + 2NaOH —> Na2SO4 + Cu(OH)2↓
CH3-CHO + 2Cu(OH)2 —> CH3-COOH + Cu2O↓ + 2H2O (реакцияидетпринагревании)
в) Взаимодействие с раствором фуксинсернистой кислоты.
При добавлении альдегида к раствору фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
|
Кетоны
CnH2nO
|
Все что и в альдегидах,но кетоны, в отличие от альдегидов, в реакции окисления не вступают
|
AN-присоединение
|
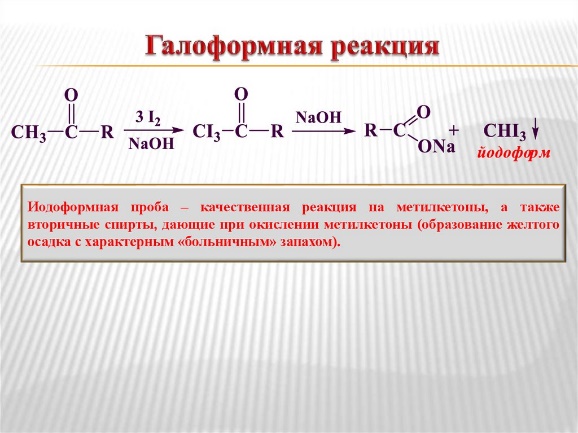
Осадок лимонно-желтого цвета
|
Карбоновые кислоты
CnH2n+1COOH
|
Диссоциация, с маталлами , с основными оксидами, гидроксидами металлов, с солями сл.кисл, этерификация, гидрирование по кратной связи, замещение
Получение хлорангидридов

Получение полных и не полных хлорангидридов

|
SN-замещение
|
а) Лакмус.Красное окрашивание
Качественные реакции на муравьиную кислоту
а) Реакция серебряного зеркала.
б) Взаимодействие с концентрированной серной кислотой.
При добавлении концентрированной серной кислоты H2SO4 к раствору муравьиной кислоты образуется угарный газ и вода:
HCOOH + H2SO4—> CO↑ + H2O
Угарный газ можно поджечь. Горит синем пламенем
в) Окисление перманганатом калия.
Качественная реакция на олеиновую кислоту (кислота содержит двойную связь)
а) Обесцвечивание бромной воды
Качественная реакция на щавелевую кислоту H2C2O4 или HOOC-COOH
а) Взаимодействие с растворами солей меди (II)
При добавлении к раствору щавелевой кислоты раствор соли меди (II) выпадет осадок оксалата меди (II):
Cu2+ + C2O42- ——> CuC2O4↓
б) Разложение концентрированной серной кислотой.
H2C2O4 + H2SO4—> CO↑ + CO2↑ + H2O
| |
 Скачать 437.09 Kb.
Скачать 437.09 Kb.