органика билет. Классификация аминокислот. Отношение , , аминокислот к нагреванию
 Скачать 195.47 Kb. Скачать 195.47 Kb.
|
|
Билет 7 Классификация аминокислот. Отношение α, β, -γ аминокислот к нагреванию. Аминокислоты или аминокарбоновые кислоты — органические соединения, в молекуле которых одновременно содержатся карбоксильные −COOH и аминные −NH2 группы. Аминокислоты классифицируют по следующим структурным признакам. I. Классификация по взаимному положения функциональных групп В зависимости от взаимного расположения амино- и карбоксильной групп аминокислоты подразделяют на α- , b- , g- , d- , e- и т. д. 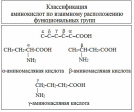 Греческая буква при атоме углерода обозначает его удаленность от карбоксильной группы. II. Классификация по строению бокового радикала (функциональным группам) Алифатические аминокислоты Моноаминомонокарбоно вые кислоты: глицин, аланин, валин, изолейцин, лейцин. Оксимоноаминокарбоновые кислоты (содержат-ОН-группу): серин, треонин. Моноаминодикарбоновые кислоты (содержат СООН-группу): аспартат, глутамат (за счёт второй карбоксильной группы несут в растворе отрицательный заряд). Амиды моноаминодикарбоновых кислоты (содержат NH2СО-группу): аспарагин, глутамин. Диаминомонокарбоновые кислоты (содержат NH2-группу): лизин, аргинин (за счёт второй аминогруппы несут в растворе положительный заряд). Серусодержащие кислоты: цистеин, метионин. Ароматические аминокислоты: фенилаланин, тирозин, триптофан. Гетероциклические аминокислоты: триптофан, гистидин, пролин. Иминокислоты: пролин. III. Классификация по полярности бокового радикала (по Ленинджеру) Выделяют четыре класса аминокислот, содержащих радикалы следующих типов. Гидрофобные аминокислоты располагаются внутри молекулы белка, тогда как гидрофильные – на внешней поверхности, что делает гидрофильными и хорошо растворимыми в воде молекулы белка. Благодаря этому свойству белки хорошо связывают воду, удерживая жидкость в крови, в межклеточном пространстве и внутри клеток. 1. Неполярные (гидрофобные) К неполярным (гидрофобным) относятся аминокислоты с неполярными R-группами и одна серусодержащая аминокислота: — алифатические: аланин, валин, лейцин, изолейцин — ароматические: фенилаланин, триптофан. — серусодержащие: метионин — иминокислота: пролин. 2. Полярные незаряженные Полярные незаряженные аминокислоты по сравнению с неполярными лучше растворяются в воде, более гидрофильны, так как их функциональные группы образуют водородные связи с молекулами воды. К ним относятся аминокислоты, содержащие: — полярную ОН-группу (оксиаминокислоты): серин, треонин и тирозин — HS-группу: цистеин — амидную группу: глутамин, аспарагин — и глицин (R-группа глицина, представленная одним атомом водорода, слишком мала, чтобы компенсировать сильную полярность a-аминогруппы и a-карбоксильной группы). 3. Заряженные отрицательно при рН-7 (кислые) Аспарагиновая и глутаминовая кислоты относятся к отрицательно заряженным аминокислотам. Они содержат по две карбоксильные и по одной аминогруппе, поэтому в ионизированном состоянии их молекулы будут иметь суммарный отрицательный заряд: 4. Заряженные положительно при рН-7 (основные) К положительно заряженным аминокислотам принадлежат лизин, гистидин и аргинин. В ионизированном виде они имеют суммарный положительный заряд В зависимости от характера радикалов природные аминокислоты также подразделяются на нейтральные, кислые и основные. К нейтральным относятся неполярные и полярные незаряженные, к кислым – отрицательно заряженные, к основным – положительно заряженные. IV. Классификация по кислотно-основным свойствам В зависимости от количества функциональных групп различают кислые, нейтральные и основные аминокислоты. Основные Аминокислоты, в которых число аминогрупп превышает число карбоксильных групп, называют основными аминокислотами: лизин, аргинин, гистидин: 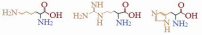 Кислые Если в аминокислотах имеется избыток кислотных групп, их называют кислыми аминокислотами: аспарагиновая и глутаминовая кислоты:  Все остальные аминокислоты относятся к нейтральным. V. По числу функциональных групп Аминокислоты по числу функциональных групп можно разделить моноаминомонокарбоновые, моноаминодикарбоновые, диаминомонокарбоновые: VI.Биологическая классификация (по способности синтезироваться в организме человека и животных) Заменимые аминокислоты – десять из 20 аминокислот, входящих в состав белков, могут синтезироваться в организме человека. К ним относятся: глицин (гликокол), аланин, серин, цистеин, тирозин, аспарагиновая и глутаминовая кислоты, аспарагин, глутамин, пролин. Незаменимые аминокислоты (8 аминокислот) – не могут синтезироваться в организме человека и животных и должны поступать в организм в составе белковой пищи. Абсолютно незаменимых аминокислот восемь: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан. Незаменимые аминокислоты входят часто в состав пищевых добавок, используются в качестве лекарственных препаратов. Условно незаменимые (2 аминокислоты) — синтезируются в организме, но в недостаточном количестве, поэтому частично должны поступать с пищей. Такими аминокислотами являются гистидин, аргинин. Для детей также незаменимыми являются гистидин и аргинин. Отношение аминокислот к нагреванию Превращения аминокислот при нагревании зависят от взаимного расположения карбоксильной и аминогруппы и определяются возможностью образования термодинамически стабильных 5-ти- 6-тичленных циклов a -Аминокислоты вступают в реакцию межмолекулярного самоацилирования. При этом образуются циклические амиды – дикетопиперазины. 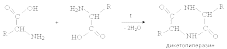 b -Аминокислоты при нагревании переходят a ,b -непредельные кислоты.  γ-Аминокислоты при нагревании превращаются в лактамы – продукты внутримолекулярного ацилирования аминогруппы карбоксилом. 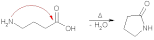 Стирол, строение, получение и свойства. Применение в промышленности. Стиро́л (фенилэтиле́н, винилбензо́л, этенилбензо́л), брутто-формула C8H8 {\displaystyle {\ce {C8H8}}}, рациональная формула C6H5CH=CH2 , сокращённое химическое обозначение PhVi 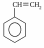 {\displaystyle {\ce {C6H5-CH=CH2}}} {\displaystyle {\ce {C6H5-CH=CH2}}}Свойства. Стирол (фенилэтилен) C6H5CH=CH2 - бесцветная жидкость со своеобразным сладковатым запахом, молекулярная масса – 104,14. Температура плавления -30,6 0С, температура кипения 145,2 0С, плотность при 200С – 906 кг/м3. При 40 0С вода растворяет 0,05% стирола, а стирол растворяет 0,1% воды. Пары стирола раздражают слизистые оболочки; предельно допустимая концентрация стирола в воздухе населенных мест равна 0,003 мг/м3, ПДК в воде водоемов - 0,1 мг/дм3. Стирол легко окисляется, присоединяет галогены, полимезируется и сополимезируется с различными мономерами Получение стирола На сегодняшний день главным промышленным методом получения стирола является каталитическое дегидрирование этилбензола в токе водяного пара при 500-630 0С. По этой схеме производство стирола выглядит следующим образом: C6H5CH2CH2 ⇄ C6H5CH=CH2 + H2 Еще один промышленный метод заключается в окислении этилбензола в присутствии марганцового катализатора до ацетофенона, который далее гидрируют под давлением на медно-хромово-железном катализаторе до метилфенилкарбинола, с последующим дегидрированием на окиси алюминия или титана: C6H5C2H5 →+O2 C6H5(С=О)CH3 →+H2 C6H5CH(OH)CH3 →-H2O C6H5CH=CH2 Сырьё для синтеза стирола – это этилбензол, получаемый алкилированием бензола: C6H6 + CH2 = CH2 →C6H5CH2=CH3 Стирол - применение Основное направление использования стирола – это создание огромного количества полимеров. Среди них: полистирол пенопласт (вспененный полистирол) модифицированные стиролом полиэфиры пластики АБС (акрилонитрил-бутадиен-стирол) и САН (стирол-акрилонитрил). Кроме этого, стирол является составляющим компонентом напалма. В результате реакции сополимеризации бутадиена и стирола получаются бутадиен-стирольные каучуки, которые активно применяют в шинном производстве, а также при изготовлении формовой и неформовой резиновой продукции. Вследствие высокого уровня радиационной стойкости, бутадиен-стирольные каучуки используют в процессе создания резин, которые противостоят гамма-излучению. Если стружку из полистирола растворить в стироле, то получается отличный клеевой состав для полистирола. Тепло и остатки полимеризаторов действуют таким образом, что клеевой шов в короткие сроки полимеризуется и становится полностью незаметным. В конце получаем монолит из двух деталей. Провести превращения: изб. Н2, р, Ni Al2O3, t K2Cr2O7, H+ 2NH3, t 2P2O5, t изб.Н2. Ni A фенол ————>? ———>? ————> A ———>? ———>? ———>? —>полимер 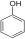 + 3H2 → + 3H2 → 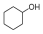 Циклогексанол (kat = Ni, t0 = 130 – 150, p = 5 – 20 атм) Циклогексанол (kat = Ni, t0 = 130 – 150, p = 5 – 20 атм)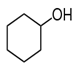 → (kat.Al3O3,H2SO4,t) → (kat.Al3O3,H2SO4,t)  Циклогексен Циклогексен 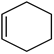 + K2Cr2O7 + 3H2SO4 → Cr2(SO4)2 + 3H2O + K2SO4 + + K2Cr2O7 + 3H2SO4 → Cr2(SO4)2 + 3H2O + K2SO4 + 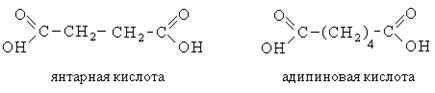 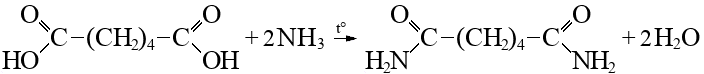 гександиамид гександиамид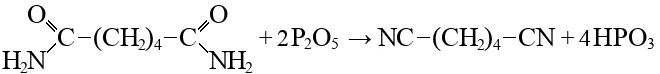 гександинитрил гександинитрил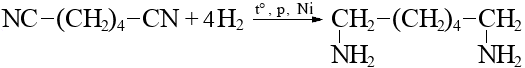 гександиамин-1,6 гександиамин-1,6нейлон 66. |
