Классификация
 Скачать 3.67 Mb. Скачать 3.67 Mb.
|
  1.Опишите классификацию и номенклатуру оксидов, приведите примеры соединений 1.Опишите классификацию и номенклатуру оксидов, приведите примеры соединенийКЛАССИФИКАЦИЯ Несолеобразующие : CO, N2O, NO Солеобразующие : -Основные- это оксиды металлов, в которых последние проявляют небольшую степень окисления +1, +2: Na2O; MgO; CuO -Амфотерные- обычно оксиды металлов со степенью окисления +3, +4: Cr2O3; SnO2; + ZnO; Al2O3 -Кислотные-это оксиды неметаллов и металлов со степенью окисления от +5 до +7: SO2; SO3; P2O5; Mn2O7; CrO3 Основным оксидам соответствуют основания, кислотным – кислоты, амфотерным – и те и другие. НОМЕНКЛАТУРА ОКСИД + Э(русское название, род. падеж) + (валентность Э) Примеры: MgO – оксид магния NiO – оксид никеля Сu2О – оксид меди (I) Fe2O3 – оксид железа (III) SO2 – оксид серы (IV) SO3 – оксид серы (VI) Cl2O7 – оксид хлора (VII) P2O5 – оксид фосфора (V) 2.Опишите способы получения оксидов, приведите примеры химических реакций . Получение оксидов 1. Взаимодействие простых и сложных веществ с кислородом: CH4 + 2O2 = CO2 + 2H2O 2Mg + O2= 2MgO 4P + 5O2 = 2P2O5 S + O2 = SO2 2CO + O2 = 2CO2 2CuS + 3O2 = 2CuO + 2SO2 4NH3 + 5O2 = 4NO + 6H2O ( в присутствии катализатора) 2. Разложение некоторых кислородсодержащих веществ (оснований, кислот, солей) при нагревании: Cu(OH)2 t= Cu2O↓ + H2O (CuOH)2CO3 = 2CuO + CO2 + H2O 2Pb(NO3)2 = 2PbO + 4NO2 + O2 2HMnO4 = Mn2O7 + H2O ( в присутствии H2SO4(конц.)) 3.Опишите химические свойства оксидов 1. Взаимодействие с водой: -Основные оксиды-- образуется основание: Na2O + H2O = 2NaOH CaO + H2O = Ca(OH)2 -Кислотные оксиды-- образуется кислота: SO3 + H2O = H2SO4 P2O5 + 3H2O = 2H3PO4 Исключение SiO2, который с водой не реагирует 2. Взаимодействие с кислотой или основанием: -Основные оксиды-- при реакции с кислотой образуется соль и вода: MgO + H2SO4 t= MgSO4 + H2O CuO + 2HCl t= CuCl2 + H2O -Кислотные оксиды-- при реакции с основанием образуется соль и вода: CO2 + Ba(OH)2 =BaCO3 + H2O SO2 + 2NaOH = Na2SO3 + H2O Амфотерные оксиды взаимодействуют с кислотами как основные: ZnO + H2SO4 = ZnSO4 + H2O с основаниями как кислотные: ZnO + 2NaOH + H2O = Na2[Zn(OH)4]) 3. Взаимодействие основных и кислотных оксидов между собой приводит к солям. Na2O + CO2 = Na2CO3 4. Восстановление до простых веществ: 3CuO + 2NH3 = 3Cu + N2 + 3H2O P2O5 + 5C = 2P + 5CO 4.Опишите классификацию и номенклатуру основания, приведите примеры Основания классифицируются по растворимости и по кислотности - растворимые в воде (щелочи) М – IА и IIА, кроме Be и Mg NaOH, Ca(OH)2 ; - нерастворимые в воде Ni(OH)2, Cr(OH)3 -oднокислотные: NaOH, KOH - двухкислотные: Ca(OH)2 -трёхкислотные: Fe(OH)3 НОМЕНКЛАТУРА ОСНОВАНИЙ ГИДРОКСИД + Э(русское название, род. падеж) + (валентность Э) NaOH – гидроксид натрия Cr(OH)3 – гидроксид хрома (III) Ba(OH)2 – гидроксид бария 5.Опишите способы получения оснований 1. Реакции активных металлов ( щелочных и щелочноземельных металлов) с водой: 2Na + 2H2O = 2NaOH + H2 Ca + 2H2O = Ca(OH)2 + H2 2. Взаимодействие оксидов активных металлов с водой: BaO + H2O = Ba(OH)2 3. Электролиз водных растворов солей: 2NaCl + 2H2O = 2NaOH + H2 + Cl2 6.Опишите химические свойства оснований ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВАНИЙ Щелочи 1. Действие на индикаторы. лакмус – синий метилоранж - жёлтый Нерастворимые основания ---- фенолфталеин - малиновый 2. Взаимодействие с кислотными оксидами. 2KOH + CO2 = K2CO3 + H2O ---- KOH + CO2 = KHCO3 3. Взаимодействие с кислотами (реакция нейтрализации) NaOH + HNO3 = NaNO3 + H2 Cu(OH)2 + 2HCl = CuCl2 + 2H2O 4. Обменная реакция с солями Ba(OH)2 + K2SO4 = 2KOH + BaSO4↓ ---- 3KOH+Fe(NO3)3 = Fe(OH)3 ↓ + 3KNO3 5. Термический распад. --- Cu(OH)2 t°= Cu2O + H2O 7. Опишите классификацию и номенклатуру кислот, приведите примеры НОМЕНКАТУРА КИСЛОТ 1. БЕСКИСЛОРОДНЫЕ КИСЛОТЫ (Н+1 n Э -n ) Э + [o] + водородная кислота HCl – хлороводородная кислота HF – фтороводороная кислота H2S – сероводородная кислота H2Se – селеноводородная 2. КИСЛОРОДСОДЕРЖАЩИЕ КИСЛОТЫ (Н +1 Э +n О -2 ) а) Степень окисления Э = № группы Э + [ная] кислота [овая] б) Степень окисления Э < № группы Э + [истая] кислота H2S+6O4 - cерная кислота H2S+4O3 – сернистая кислота H3As+5O4 – мышьяковая кислота H3As+3O3 – мышьяковистая кислота 8.Опишите способы получения кислот Получение кислот 1. Взаимодействие кислотного оксида с водой (для кислородсодержащих кислот): SO3 + H2O = H2SO4 P2O5 + 3H2O =2H3PO4 2. Взаимодействие водорода с неметаллом и последующим растворением полученного продукта в воде (для бескислородных кислот): H2 + Cl2 = 2HCl H2 + S = H2S 3. Реакциями обмена соли с кислотой Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3 в том числе, вытеснение слабых, летучих или малорастворимых кислот из солей более сильными кислотами: Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl 2NaCl(тв.) + H2SO4(конц.) t°= Na2SO4 + 2HCl 9.Опишите химические свойства кислот  10.Опишите классификацию и номенклатуру солей, приведите примеры КЛАССИФИКАЦИЯ 1. Средние (нормальные) – продукт полного замещения атомов водорода в кислоте на металл а) соли кислородсодержащих кислот Н2SO4 → Na2SO4 – сульфат натрия Н2SO3 → Na2SO3 – сульфит натрия б) соли бескислородных кислот HCl → KCl - хлорид калия  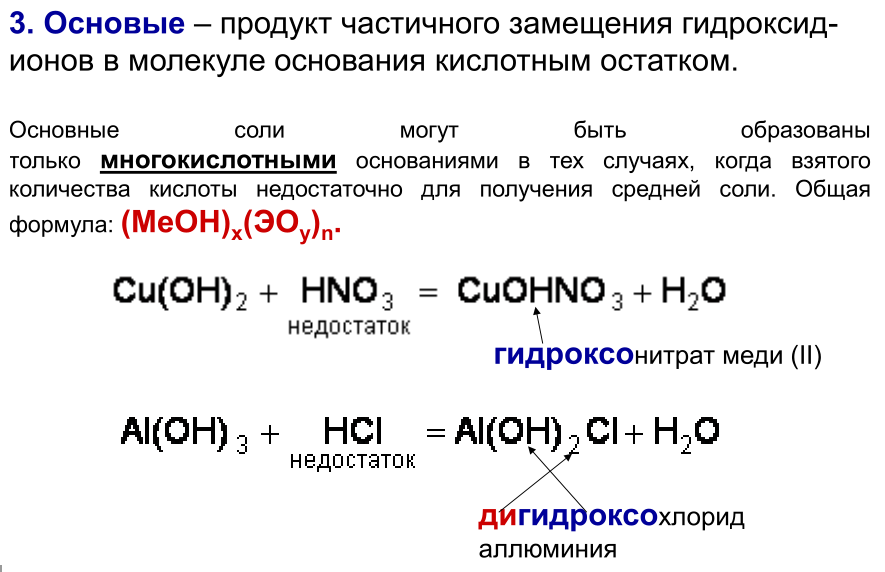 4. Двойные соли состоят из ионов двух разных металлов и кислотного остатка. KNaCO3 – калий натрий карбонат 5. Смешанные соли – содержат один ион металла и анионы двух кислот. AlCl(SO4) – алюминий хлорид сульфат. 6. Комплексные соли состоят из сложных (комплексных) ионов [Ag(NH3)2] Cl 11.Опишите способы получения средних солей  12.Опишите строение атома, охарактеризуйте частицы, находящиеся в составе атома 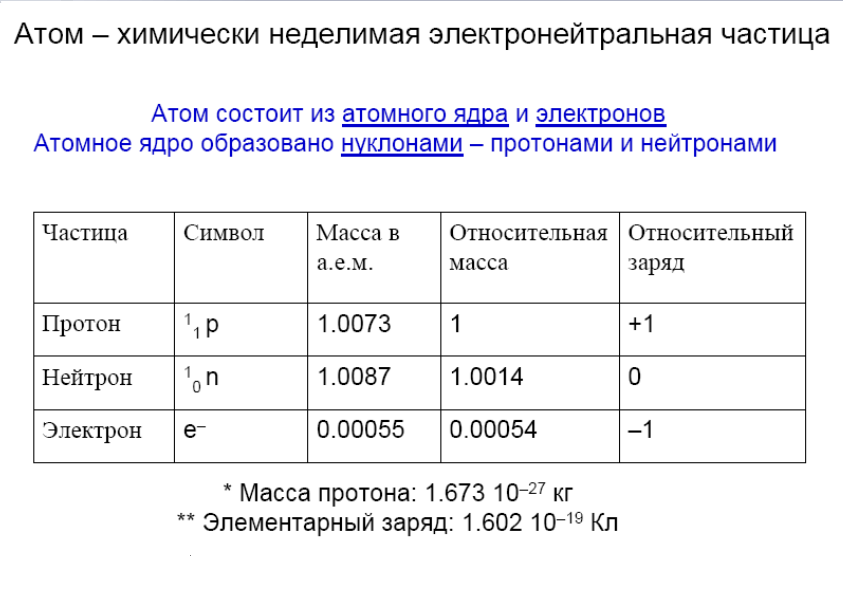 13.Сформулируйте постулаты Бора Первый постулат Бора. Электроны могут вращаться вокруг ядра по строго определенным стационарным орбитам, при этом они не излучают и не поглощают энергию. Второй постулат Бора. При переходе с одной орбиты на другую электрон поглощает или испускает квант энергии. 14.Опишите квантовые числа, тукажите их физический смысл, приведите формулы для расчета    15)СТРУКТУРА ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ Менделеева (короткая форма) Современная периодическая система включает 109 хим элементов В периодической системе существуют горизонтальные и вертикальные ряды химических элементов: Период – это горизонтальный ряд химических элементов, расположенные в порядке возрастания заряда атомного ядра. У химических элементов находящихся в одном периоде атомы имеют одинаковое количество энергетических уровней. Всего существует семь периодов. Различают малые и большие периоды химических элементов.Каждый период начинается со щелочного металла и заканчивается инертным газом. Группа – вертикальные ряды, химические элементы в которых имеют одинаковое количества электронов на внешнем энергетическом уровне. Нахождение элемента в подгруппе определяется сходством конфигурации внешнего энергетического уровня. От порядка заполнения атомныхорбиталей все элементы делятся на s,p,d и f семейства. 16) 1. Номер периода = числу энергетических уровней в атоме 2. Порядковый номер элемента = количеству электронов = заряду ядра атома 3. Длина периода определяется числом электронов, необходимых для завершения соответствующих энергетических подуровней 4. В коротких периодах, начале и конце длинных периодов наблюдается увеличение числа электронов на внешнем уровне 5. В длинных периодах происходит заполнение внутренних электронных оболочек в атомах переходных металлов 6. Электронных конфигурации элементов в группе аналогичны, что приводит к сходству физических и химических свойств 17) АТОМНЫЙ РАДИУС
18)Потенциал ионизации атома - минимальная разность потенциалов U, которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома. Чаще употребляемое понятие - энергия ионизации E. Это минимальная энергия, которую надо затратить для удаления электрона из атома. Потенциал ионизации U тесно связан с энергией ионизации соотношением: E=Ue, где е-элементарный электрический заряд. Энергия ионизации атома является внутренним свойством частицы и не зависит от способа ионизации, тогда как потенциал ионизации, можно сказать,- характеристика исторически первого метода ионизации. Энергия ионизации атома, выраженная в эВ (электроновольтах), численно совпадает с потенциалом ионизации атома, выраженным вВ (вольтах) Энергии ионизации возрастает в периоде по мере увеличения порядкового номера элемента. Наименьшее ее значение имеют щелочные металлы, находящиеся в начале периода. Наибольшее значение энергии ионизации характерно для инертных газов, находящихся в конце периода. 19.ПАРАМЕТРЫ ХИМИЧЕСКОЙ СВЯЗИ 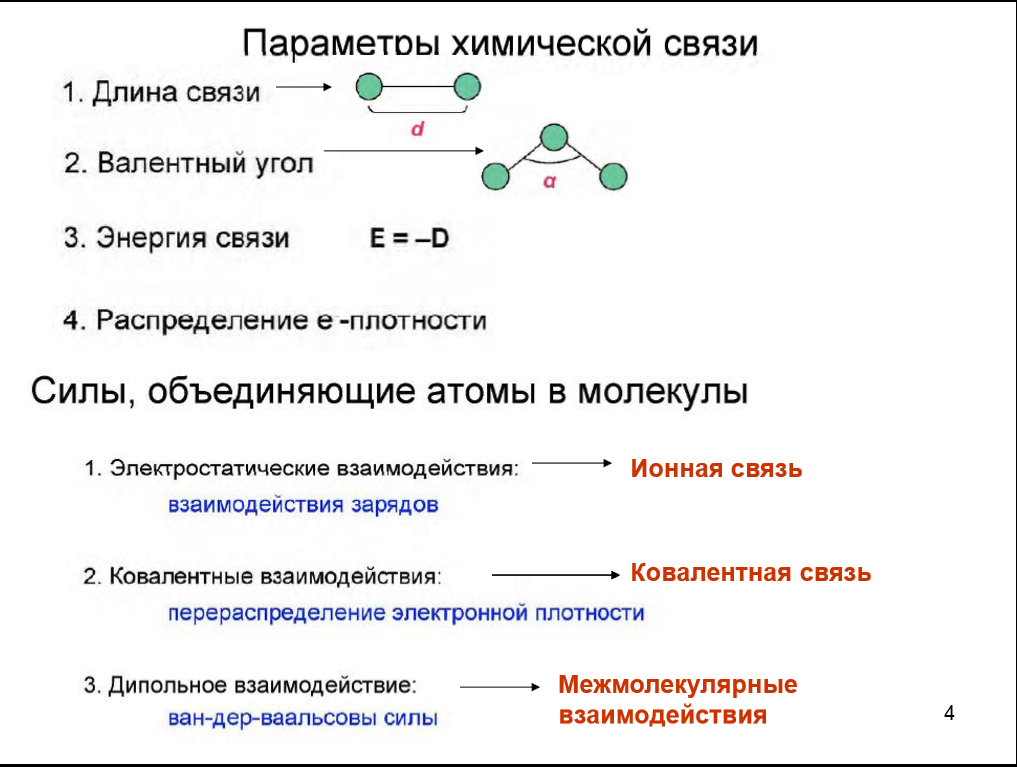 20)зависимость потенциальной энергии (1927 г. немецкие физики В. Гейтлер и Ф. Лондон): оценили зависимость потенциальной энергии системы Е из двух атомов водорода от межъядерного расстояния r Характер изменения E определяется взаимной ориентацией электронных спинов атомов. Сближение атомов приводит к возрастанию E – отталкивание, химическая связь не образуется Сближение атомов приводит к убыванию E до минимального значения Eсв при расстоянии r0 – образование химической связи Дальнейшее сближение –электростатическое отталкивание одноименно заряженных ядер 21)ОСНОВНОЕ И ВОЗБУЖДЕННОЕ СОСТОЯНИЯ АТОМА Для атома углерода электроны разместятся по уровням и подуровням следующим образом, что соответствуют нормальному состоянию атома, т.е. минимальному значению энергии. Однако при затрате сравнительно незначительной энергии возможен перевод электронов в пределах одного и того же уровня, с одного подуровня на другой, энергетически более высокий. Такое состояние атома называется возбуждённым. В нормальном состоянии углерод двухвалентен, в возбуждённом − четырёхвалентен. 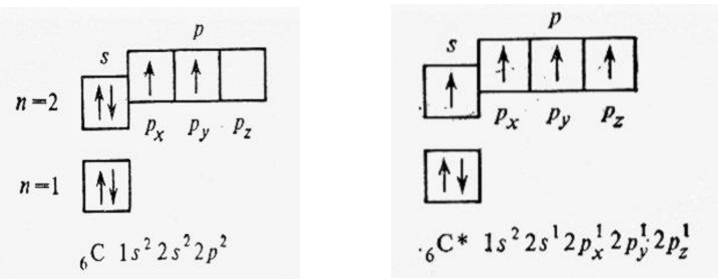 22. ПОДХОДЫ К ОПИСАНИЮ ХИМИЧЕСКОЙ СВЯЗИ В МОЛЕКУЛАХ( с позиций квантово механической теории) 1. Метод валентных связей (МВС) – - Ковалентную химическую связь между двумя атомами образуют два электрона с антипараллельными спинами, одновременно принадлежащие обоим атомам. - Ковалентная связь тем прочнее, чем больше степень перекрывания электронных орбиталей взаимодействующих атомов - Пространственное расположение химической связи соответствует направлению, в котором достигается наибольшее пе5рекрывание валентных орбиталей 23. МЕХАНИЗМЫ ОБРАЗОВАНИЯ КОВАЛЕНТНОЙ СВЯЗИ: 1) ОБМЕННЫЙ: каждый атом предоставляет по одному электрону для образования общей электронной пары (Н + F = HF) 2) ДОНОРНО – АКЦЕПТОРНЫЙ: атом – донор предоставляет для образования связи орбиталь с неподеленной электронной парой, а атом – акцептор предоставляет вакантную орбиталь для размещения неподеленной электронной пары (СО=С+О) 24) Способы перекрывания электронных облаков В зависимости от симметрии электронных облаков, участвующих в перекрывании, общее электронное облако будет иметь различную симметрию. Эта симметрия определяет три вида хим. связи: 1) σ-связь осуществляется при перекрывании облаков вдоль линии, соединяющей центры атомов (s, p, d) Максимальная электронная плотность достигается в межъядерном пространстве и имеет цилиндрическую симметрию относительно линии, соединяющей центры атомов. 2) π-связь – осуществляется при перекрывании электронных облаков над и под линией, соединяющей центры атомов. Общие электронные облака расположены симметрично относительно оси, соединяющей центры атомов, но не имеют цилиндрической симметрии 3) δ-связь – образуют d-орбитали за счет перекрывания всех четырех лепестков электронных облаков, расположенных в параллельных плоскостях 25.ВИДЫ ГИБРИДИЗАЦИИ 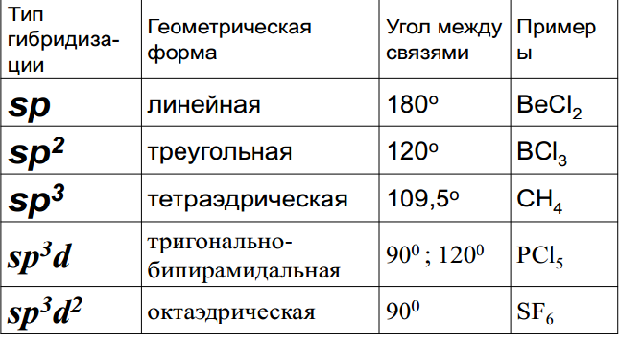 26)Свойства ковалентной связи 1.Энергия связи 2. Длина связи 3. Кратность связи 4. Насыщаемость 5. Направленность 6. Полярность 7. Поляризуемость Виды ковалентной связи  27.ИОННАЯ СВЯЗЬ.  28.ВОДОРОДНАЯ СВЯЗЬ 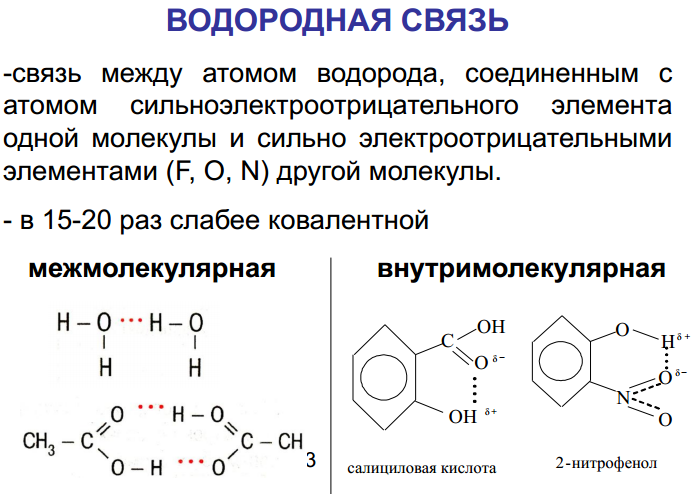 29.МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ Они включают в себя три составляющие: 1) диполь-дипольное 2) индукционное 3) дисперсионное взаимодействия. Диполь-дипольное взаимодействие(ориентационное). При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя Индукционное взаимодействие. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи. Между постоянными и наведенными диполями возникает притяжение. Энергия индукционного взаимодействия возрастает с увеличением поляризуемостимолекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля. Дисперсионное притяжение В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. Дисперсионное притяжение В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц. Для неполярных молекул дисперсное взаимодействие является единственной составляющей ван-дер-ваальсовых сил Межмолекулярное взаимодействие имеет электростатическую природу. 30.Виды растворов: Газообразный р-р Жидкий р-р Твердый 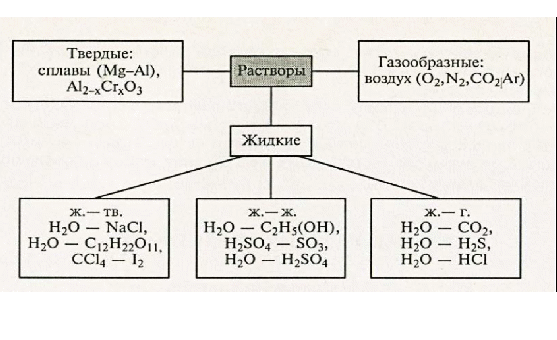 31. ОСМОС   32.Основные положения ТЭД Аррениуса 1. Электролиты в растворе диссоциируют на ионы Ион - атом или группа атомов, имеющая заряд К+ - катионы; А- - анионы 2. Ионы в растворе устойчивы и по свойствам резко отличаются от их атомов. NaCl = Na+ + Cl– 3. Ионы в растворе перемещаются хаотично. Если в раствор электролита опустить электроды и наложить внешнее электрическое поле, то пойдет электрический ток - ионы имеют направленное движение: катионы – к катоду (–), анионы – к аноду (+). 4. Наряду с процессом диссоциации в растворе электролита идет процесс ассоциации (моляризации), т.е образование молекул из ионов. NaClNa+ + Cl– диссоциация моляризация  33.ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ 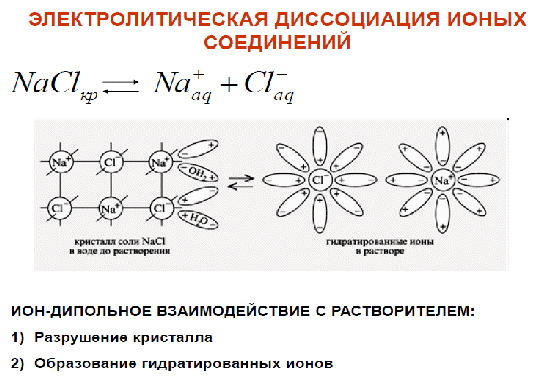 34. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ  35.СТЕПЕНЬ ДИССОЦИАЦИИ (α)ЗАВИСИТ ОТ: •Природы растворителя (чем более полярна молекула растворителя, тем выше степень диссоциации) •Температуры (электролитическая диссоциация-эндотермический процесс, т.о. если Т↑, то α ↑; если Т↓, то α ↓ •Концентрации раствора ( чем больше разбавление раствора, тем выше α ) 36 вопрос:опишите виды электролитов в зависимости от их силы,приведите примеры.  37 вопрос:охарактеризуйте константу диссоцииацииэлектролитов,от каких факторов она зависит,приведите выражения для константы диссоциации кислоты и соли.   38 вопрос:опишите связь между ионным произведением воды,pH и кислотностью растворов.   39 вопрос:какие типы солей подвергаются гидролизу,приведите примеры реакций.      40 вопрос:укажите типы окислительно-восстановительных реакций,приведите примеры реакций.   41вопрос:опишите положения метода электроного баланса, приведите пример расстановки коэффицентов в окислительно-восстановительной реакции.  42вопрос:опишите строение гальванического элемента Якоби-Даниэля и процессы,протекающие в нем.     43. Альфред Вернер выдвинул координационную теорию: •Помимо «главных» валентностей атомы и даже целые молекулы могут обладать «побочными» валентностями. •При реализации «побочных» валентностей образуются устойчивые соединения, которые называются комплексными или координационными соединениями. Комплексное соединения - это соединения, существующие как в кристаллическом состоянии, так и в растворе, особенностью которых является наличие центрального атома ( акцептора электронов), окруженного лигандами ( донорами электронов) Комплексное соединение – это соединение, образованное из простых частиц ( атомов, ионов или молекул), способное к самостоятельному существованию Состоит из комплексообразователя ,внешней и внутренней сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определённое число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд. Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешнюю координационную сферу. (Пример стр 7,9 лекция)  44. ОБЩИЕ ПРАВИЛА: 1.Большинство комплексных соединений соли и называется сначала анион а потом катион в родительном падеже. 2.Внутренняя сфера называется одним длинным словом. 3.Название нейтральных лигандов соответствует названиям молекул за исключением: Н2О – аква NH3 – аммин CO - карбонил 4. Название анионных лигандов: + суффикс [о] Cl- - хлоро, Br- -бромо, OH- - гидроксо, СN- - циано, SO42- -сульфато 5.Количество лигандов указывается в приставках: 2 – ди, 3 – три, 4-тетра, 5 – пента, 6 – гекса, 7 – гепта [Cu(NH3)4]Cl2 Заряд комплексного иона [Cu(NH3)4]2+ Комплексообразователь - Cu2+ Лиганды - NH3 Координационное число - 4 [Cu(NH3)4]. Название: хлорид тетраамминмеди (II) 45. Механизм: донорно – акцепторный Комплексообразователь – акцептор (имеет вакантные орбитали на валентном уровне Лиганд – донор (имеет неподеленные электронные пары на валентном уровне) ФОРМА комплексной частицы определяется с использованием КОНЦЕПЦИИ ГИБРИДИЗАЦИИ Л. Полинг установил, что число орбиталей центрального атома, участвующих в образовании комплексного соединения, равно числу окружающих лигандов Позволяет определить: форму внутренней координационной сферы магнитные свойства Не позволяет определить: оптические свойства  [CoF6]3- Комплексообразователь: Co3+ 3d64s0 Лиганды: F- Высокоспиновый, Парамагнитный (пример стр 17, 9 лекция) 46. Описывает влияние природы (кристаллического поля) лигандов на электронные орбитали комплексообразователя и свойства комплексных соединений. Позволяет определить: форму внутренней координационной сферы магнитные свойства оптические свойства ЛИГАНДЫ имеют заряд или обладают дипольным моментом, следовательно образуют вокруг комплексообразователя электростатическое поле. РЕЗУЛЬТАТ: расщепление валентных орбиталей комплексообразователя Позволяет определить: форму внутренней координационной сферы магнитные свойства оптические свойства  47. 1.Параметр ( энергия) расщепления – Δ Параметр расщепления определяется как разность в энергиях между расщепленными подуровнями под действием электростатического поля лигандов ( е - дважды вырожденное состояние, t - трижды вырожденное) Δ зависит от: 1.Числа лигандов 2.Типа химической связи между лигандами и комплексообразователем 3.Геометрии комплекса 4.Степени окисления комплексообразователя  Δтетр = 4/9 Δокт 48. ИЗОМЕРАМИ называются соединения, имеющие одинаковый состав, но разное строение  1.ГЕОМЕТРИЧЕСКАЯ ( cis-trans )Проявляется для комплексов с разными лигандАМИ. 2. ИОНИЗАЦИОННАЯ ИЗОМЕРИЯ – различное распределение ионов между внутренне й и внешней координационными сферами [Pt(NH3)4Br2]Cl2 [Pt(NH3)4Cl2]Br2 яркая бледная оранжево-желтая окраска 3. СОЛЬВАТНАЯ ИЗОМЕРИЯ – различное распределение молекул растворителя между внутренней и внешней координационными сферами Растворитель H2O – ГИДРАТНАЯ изомерия [Cr(NH3)6]3+ × nH2O 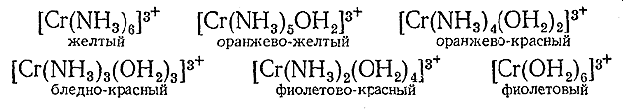 4. ОПТИЧЕСКАЯ ИЗОМЕРИЯ (ЗЕРКАЛЬНАЯ) - связана со способностью некоторых комплексных соединений существовать в виде двух форм, не совмещаемых в трехмерном пространстве и являющихся зеркальным отображением друг друга, как левая рука и правая. 5. КООРДИНАЦИОННАЯ ИЗОМЕРИЯ - различное распределение лигандов во внутренних координационных сферах комплексов. Присуща соединениям, состоящим из комплексного катиона и комплексного аниона, центральные атомы которых различны [Pt(NH3)4][PdCl4] и [Pd(NH3)4][PtCl4] [Co(NH3)6][Cr(CN)6] и [Cr(NH3)6][Co(CN)6] 49. [Ag(NH3)2]Cl 1.Первичная диссоциация: Процесс диссоциации комплексной соли на внутреннюю сферу + ионы внешней сферы ( как сильный электролит) [Ag(NH3)2]Cl = [Ag(NH3)2]+ + Cl- 2. Вторичная диссоциация: Процесс ступенчатого отщепления лигандов от иона комплексообразователя ( как слабый электролит) [Ag(NH3)2]+ = [Ag(NH3)]+ + NH3 [Ag(NH3)]+ = Ag+ + NH3 / [Ag(NH3)2]+ = Ag+ + 2 NH3 [Ag(NH3)2]+ = Ag+ + 2 NH3 КОНСТАНТА УСТОЙЧИВОСТИ Бета= [[Ag(NH3)2]+] / [Ag+] [NH3]2 Чем выше константа устойчивости, тем прочнее комплексная частица |
