|
|
спектрофотометрия. Количественное определение барбитуратов
КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ БАРБИТУРАТОВ
Для количественного определения барбитуратов, изолирован ных из биологического материала животного происхождения ( кровь, моча, внутренние органы трупа), наиболее перспективным является спектрофотометрический метод.
155
Спектрофотометрический метод требует сравнительно высокой чистоты исследуемого вещества. Такую степень чистоты обеспе чивает хроматография в тонком слое силикагеля КХК ( см. стр. 59).
Спектрофотометрическое определение барбитуратов основано на способности барбитуратов к кето- энольной или амидоими-дольной таутометрии: при р Н 2 , 0 барбитурат находится в рас творе в виде кетонной ( неионизированной) формы, не обладающей в пределах длин волн ( К )200— 300 нм специфической аб- сорбцией. При р Н 10, 0 образуется моноимидольная форма, в гетероциклическом ядре возникает двойная связь, способная к поглощению в ультрафиолетовой области спектра. Поглощение наблюдается при А = 240 нм. При р Н 13, 0 и выше в растворе при сутствует диимидольная форма с двумя двойными связями в кольце. Максимум абсорбции наблюдается при Х=25Б— 260 нм.
Для определения барбитуратов рекомендованы: методы пря мого спектрофотометрирования при р Н 10, 0 и Л - = 240 нм и два варианта дифференциального метода: при р Н 10, 0 — р Н 2, 0 и Я = =239 нм при исследовании внутренних органов трупа и при р Н 13, 0 — р Н 10, 0 и Я = 260 нм при исследованиях крови и мочи. Дифференциальные варианты спектрофотометрического опреде ления дают более надежные результаты, так как здесь в значительной степени исключается влияние посторонних веществ, экстрагируемых хлороформом из кислого раствора вместе с бар битуратами.
Для расчета содержания барбитурата пользуются калибровочным графиком или, что лучше, значениями удельного
показателя поглощения. Удельный показатель поглощения Ei^, вычисляется по формуле:
pl% AD
£1 с м с-1'
где D— оптическая плотность; AD—Др НЮ— Др Н2 или Др Н13 — Др НЮ; С— концентрация вещества в процентах; / — толщина поглощающего слоя в сантиметрах. Отсюда
В сочетании с хроматографией спектрофотометрический метод является достаточно специфичным, быстрым, чувствительным. Определяются микрограммовые количества барбитуратов.
В. И. Попова на основе метода Маттесона и Гольта разрабо тала применительно к химико-токсикологическому анализу метод фотометрического определения барбитала, фенобарбитала и барбамила. В основу методики положена реакция барбитуратов с раствором ацетата кобальта в СН 3ОН в присутствии пзоиро- пиламина в СН 3ОН. Определяются миллиграммовые количества перечисленных барбитуратов.
Ноксирон1. Известные недостатки производных барбитуровой кислоты, их сравнительно невысокий терапевтическ ий индекс, побочное действие, явления привыкания и др. привели за послед ние 2 — 3 десятилетия к синтезу ряда снотворных препаратов небарбитурового характера. Среди этих соединений определенное токсикологическое значение приобрел ноксирон или глутетимид. C9Hs
H2Cf , зТ^Сб Н5 0=С6 i yz—oN
- н
2,6-диоксо-З-этил-З-фенил-пиперидин. Бесцветный кристаллический порошок горьковатого вкуса, без запаха: Температура плавления 85—87°. Практически нерастворим в холодной воде. В горячей воде растворяется в соотношении 1 : 1000. Хорошо растворим (1:5) в этиловом алкоголе, эфире (1 : 12), очень хорошо растворяется в метиловом спирте, хлороформе, дихлорэтане, бензоле, едких щелочах. В завиг симости от рН среды в растворах существует в двух формах:

рН-1-10 (Кето-форма)
р Н > 1 0 , 0 (Енольная форма)
1 Описано по результатам исследований Е. Д. Зинаковой. 160
Изолирование ноксирона из внутренних органов трупа возможно подкисленным этиловым алкоголем при условии обработ ки исследуемого остатка г о р я ч е й водой ( изолируется 25, 6% введенного в объект вещества), водой, подкисленной щавелевой кислотой ( 29, 5%), спиртово -хлороформной смесью ( по методу Изолирование подщелоченной водой ( мето д Валова) недопустимо.
Из крови, мочи, рвотных масс производят непосредственную экстракцию органическими растворителями ( хлороформ, эфир, бензол). При однократной экстракции ( как показало изучение условий экстракции из водных растворов) указанными растворителями ( равный объем, время экстрагирования 15 минут) извлекается 94 -— 97 % вещества. Значение р Н в интервале р Н 1 до р Н — 10 влияния не оказывает, в резкощелочной среде ( р Н>12, 0) процент экстрагируемого вещества резко снижается.
Для очистки хлороформную вытяжку подвергают промыванию 0, 45 н. Na OH и 0, 5 н. HCI. Ноксирон как вещество нейтрального характера при этом ( в отличие от барбитуратов) полностью остается в органической фазе.
Для очистки и предварительной идентификации возможно применение хроматографии в тонком закрепленном слое силика -геля КСК. Система растворителей хлороформ — ацетон ( 9: 1). Пробег фронта 10 см. Время хроматографирования 50 минут, Rf = 0, 6 — 0, 65. Проявление хроматограммы возможно дифенил-карбазоном и раствором Hg S04 или раствором Hg N03, модифицированным реактивом Драгендорфа.
Качественное обнаружение. 1. Интенсивная абсорбция в спир товом щелочном растворе с максимумом при длине волны 235 нм.
Микрокристаллические реакции: а) с раствором хлорцинк йода 1; б) с железойодидным реактивом; в) с раствором 12 в КУ ( рис. 9) Чувствительность всех реакций 1 мкг в пробе.
Перекристаллизация: а ) из концентрированной серной кис лоты ( рис. 10). Чувствительность 0 , 11 мг вещества в пробе;
Количественное определение ноксирона в фармацевтических препаратах возможно ацидиметрическим способом ( Гф. X), ос нованном на разложении препарата в присутствии щелочи и оттитровывании избытка щелочи.
Кроме того, для анализа таблеток ноксирона может быть при менен ф о т о э л е к т р о к о л о р и м е т р и ч е с к и й м е т о д , основанный на образовании окрашенного комплекса гидроксамо -вой кислоты с хлоридом окисного железа и экстракцией этого комплекса в слой н -бутанола.
Реакция идет по схеме:

С2Н5
СбНб N^0 Щелдчь
Н
Ноксирон НО
СгН-, NH,
4-NH„0H
.6н5 -
Амидокарбоновая кислота

с2н5 СбНб НО-N Н
Гидроксамовая кислота
j4o
NH,
-Fen СН5
СбНб
I40
FeО—NH NH2 3
Гидроксамат (красно-фиолетовое окрашивание)
Для химико-токсикологического исследования лучшим мето дом является УФ- спектрофотометрия, позволяющая определять низкие уровни вещ ества. Метод основан на измерении разницы абсорбции ноксирона в нейтральной и щелочной среде при длине волны 235 нм.
Концентрация вещества пропорциональна разности абсорбции, подчинение закону Ламберта — Бера наблюдается в интервале концентраций 1 — 12 мкг/ мл.
§ 6. ПЕСТИЦИДЫ ИЗ КЛАССА ФЕНОЛОВ
Фенолы обладают широким диапазоном физиологического дей ствия и являются инсектицидами, фунгицидами, бактерицидами и гербицидами.
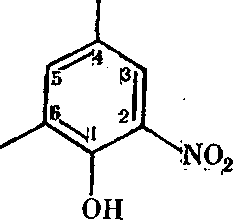
Пестицидная активность фенолов возрастает при введении в ароматический радикал различных заместителей. Из нитро-производных фенолов максимальной инсектицидной активностью обладают динитрофенолы и особенно алкилдинитрофенолы. Из многочисленных динитропроизводных фенолов, применяемых с 1933 г., практическое значение приобрели лишь немногие. К ним относятся 2, 4 -динитроортокрезол — ДИНОК ( ДНОК, селинон).
N02
н,о
или ( 2, 4 -динитро-6 -метилфенол) и 2, 4 -динитро-6 -вторичный бутил-фенол) ( диносеб).
Н5С2-

сн3 ОН
Синтез 2, 4 -динитроортокрезола и 2, 4 -динитро-6 -вторичного бу-тилфенола осуществляется по схемам:
SO,H
Н„С
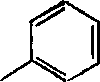
H2 so 4 ->-
70-93%
няс
ОН
Н
H8Cjs—С
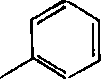
H2SQ4
80—98% Н
Н5С2—С СН,
ОН

270
По физическим свойствам оба препарата — желтые кристаллические вещества. Температура плавления 86 , 4 ° и 38 — 39 ° соответственно. Препараты сравнительно мало растворимы в воде, лучше в спиртах, бензоле, ацетоне и других растворителях. За счет наличия феполыюго гидроксила ДИНОК и дпносеб взаимодействуют со щелочами, аммиаком и органическими основа - ниями.
ЛД5о динитроортокрезола при введении per os для животных составляет 10 — 50 мг/ кг.
И з о л и р о в а н и е д и н н т р о ф е м о л ь н ы х п р о и з в о д-н ы х при химико- токсикологическом анализе внутренних орга нов трупа, крови, мочи возможно как подщелоченной ( лучше карбонатом натрия), так и подкисленной водой ( исследования К. Г. Янкова). При этом подщел оченной водой удается изолиро - вать 93, 87% 2 , 4 -дипитроортокрезола и 96, 28% 2, 4 -динитро-6 -вто-р'ичного бутилфенола. Подкисленной водой изолируется соответ ственно 88, 34% и 89, 41% динитрофенолов, а подкисленным спир том 59 , 6% и 62, 18%.
Использование метилэтилкетона позволяет изолировать 68, 8% динитроортокрезола. Для изолирования ди -нитропроизводных фенолов из крови, мочи, каловых масс, внут ренних органов трупа предложены экстракционные методы извлечения метилэтилкетоном. Для очистки выделенных динитро- производных фенола рекомендована экстракция эфиром из растворов, подкисленных НС1 до р Н 2, 0 ( по универсальному ин дикатору), с последующей реэкстракцией в 1% раствор едкого натра и хроматография в тонком слое силикагеля ( для очистки и для разделения). Адсорбент — силикагель «Вулказил» ( ФРГ), система: петролейный эфир — этиловый эфир— ледяная уксусная кислота в соотношении 90: 10: 1. Время пробега 15 — 20 ми- нут, Rf динитроортокрезола 0 , 74; Rf динитро-2 -Бторичного бутил-фенола 0, 89. Проявление в камере, насыщенной парами аммиака. Метчик — 0 , 001% раствор соответствующего динитрофенола в эфире.
Качественное обнаружение. 1. Реакция с раствором едкой ще лочи— желтое окрашивание. Обнаруживается 0, 5 мкг вещества пр'и разведении 1 : 10 000000. 2. Реакция образования индофенола и другие реакции, харак терные для фенола ( см. стр. 111).
Количественное определение проводится спектрофотометриче -ским методом. Максимум светопоглощения наблюдается при дли не волны 370 нм кювета 1 см. Подчинение закону Бера в пределах концентраций 0,5— 30 мкг в 1 мл.
Токсикологическое значение динитропроизводных фенолов обу словлено высокой токсичностью по отношению не только к на секомым, бактериям, сорным растениям, но и к теплокровным животным. В организме животных динитропроизводные фенолов ведут себя как фенолы, выводятся мочой в виде парных соединений с серной и глюкуроновой кислотами.
271 |
|
|
 Скачать 61.94 Kb.
Скачать 61.94 Kb.