соч 8 - 1ч. Количество баллов
 Скачать 226.62 Kb. Скачать 226.62 Kb.
|
|
Количество баллов - 25 Ф.И.________________________________Класс:________ дата:____________ 1Вариант Задания суммативного оценивания за 1 четверть по предмету «Химия» 1. Определите электронную формулу, соответствующую иону F- А) 1s2 2s22p63s23p5 B) 1s22s22p63s2 C) 1s22s22p6 D) 1s22s22p5 [1] 2. Определите строку, в которой схема распределения электронов соответствует атому гелия. А) Н+ 1s0 B) Li , 1s22s1 C) Li+, 1s2 D) Cl+5, 1s22s22p63s2 [1] 3(а) Элемент, который образует ион с зарядом Э-2, присоединяет электроны на второй энергетический уровень. Составьте формулу его соединения с водородом: Ответ _______________________________ [1] 3(b) Закончите схему образования иона Cl+5. 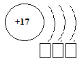  [1] [1]4. Напишите электронную и электронно – графическую формулы атома кислорода: Электронная формула: _______________________________________________________ Э  лектронно – графическая формула: лектронно – графическая формула:[2] 5. Сера может образовывать 2 оксидов разного состава. Составьте формулу оксида серы методом «нулевой суммы». (a) S+6xOy (b) S+4xOy [2] 6(a) Рассчитайте массовую долю серы в получившемся оксиде серы в задании 5(a). [2]
(b) Выведите формулу оксида азота, если известно, что массовая доля азота в соединении составляет 63,64%, кислорода 36,36%. [2]
7. Из предложенного перечня веществ выпишите необходимые формулы и закончите уравнения реакций: H2SO3, CaCO3, C, NaCl, H2O, H2CO3, Na2SO3, NaCl, H2SO4, SO2, NaH 1) 2KOH + …….. = K2SO4 + ………….. 2) Na2CO3 + 2HCl = 2………. + ………….. [2] 8. Определите и подпишите тип химической реакции. [2]
9. На рисунке изображен один из типов химической реакции:  + + = = Приведите пример уравнения данного типа реакции: ____________________________________________________________________________ [2] 10. На рисунке изображено исследование процесса коррозии. Железный гвоздь поместили в различную среду. 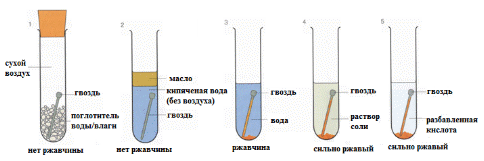 (а) Объясните, по каким причинам ржавчина не образуется. _____________________________________________________________________________________________________________________________________________________________ [1] 11(a) На рисунке изображены реакции взаимодействия металлов с кислотой: Задание: О  бъясните как протекает реакции в пробирке №1 и напишите бъясните как протекает реакции в пробирке №1 и напишитепример металла для данной реакции Пробирка №1 ____________________________ [2] 12. Для исследования активности металла ученик поместил цинк в разные растворы. (а) Заполните таблицу, поставив «+» и «-» в соответствие с возможностью или отсутствием реакции:
[2] (b) Объясните причину подобного химического поведения цинка. __________________________________________________________________________________________________________________________________________________________________________________ [2] Количество баллов - 25 Ф.И.________________________________Класс:________ дата:____________ 2Вариант Задания суммативного оценивания за 1 четверть по предмету «Химия» 1. Определите электронную формулу, соответствующую иону О-2 А) 1s2 2s22p63s23p5 B) 1s22s22p63s2 C) 1s22s22p6 D) 1s22s22p5 [1] 2. Определите строку, в которой схема распределения электронов соответствует атому аргона. А) Н+ 1s0 B) Li+ , 1s22s0 C) К+, 1s22s22p63s2 3р6 D) K+5, 1s22s22p63s2 3p5 4S1 [1] 3(а) Элемент, который образует ион с зарядом Э-, присоединяет электроны на третий энергетический уровень. Составьте формулу его соединения с водородом: Ответ _______________________________ [1] 3(b) Закончите схему образования иона Cl+4. 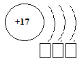  [1] [1]4. Напишите электронную и электронно – графическую формулы атома углерода: Электронная формула: _______________________________________________________ Э  лектронно – графическая формула: лектронно – графическая формула:[2] 5. Углерод может образовывать 2 оксидов разного состава. Составьте формулу оксида серы методом «нулевой суммы». (a) С+2xOy (b) С+4xOy [2] 6(a) Рассчитайте массовую долю углерода в получившемся оксиде углерода в задании 5(a). [2]
(b) Выведите формулу оксида азота, если известно, что массовая доля азота в соединении составляет 63,64%, кислорода 36,36%. [2]
7. Из предложенного перечня веществ выпишите необходимые формулы и закончите уравнения реакций: H2SO3, CaCO3, C, NaCl, H2O, H2CO3, Na2SO3, LiCl, H2SO4, SO2, NaH 1) 2 LiOH + …….. = Li 2SO3 + ………….. 2) Li2SO4 + 2HCl = 2………. + ………….. [2] 8. Определите и подпишите тип химической реакции. [2]
9. На рисунке изображен один из типов химической реакции:  = = + +  Приведите пример уравнения данного типа реакции: ____________________________________________________________________________ [2] 10. На рисунке изображено исследование процесса коррозии. Железный гвоздь поместили в различную среду.  (а) Объясните, как образуется ржавчина? _____________________________________________________________________________________________________________________________________________________________ [1] 11(a) На рисунке изображены реакции взаимодействия металлов с кислотой:  Задание: Объясните как протекает реакции в пробирке №3 и пример металла для данной реакции Пробирка №3 ____________________________ [2] 12. Для исследования активности металла ученик поместили железо в разные растворы. (а) Заполните таблицу, поставив «+» и «-» в соответствие с возможностью или отсутствием реакции:
[2] (b) Объясните причину подобного химического поведения железо. __________________________________________________________________________________________________________________________________________________________________________________ [2] |
