овтетаввыф. коллоид было предложено
 Скачать 2.89 Mb. Скачать 2.89 Mb.
|
Допишите ответКоагулирующим действием в электролите обладают ионы, имеющие заряд, одноименный по знаку с зарядом противоиона мицеллы. Количественная теория кинетики коагуляции была разработана Смолуховским. Разность гидростатических давлений в пленке и в окружающей пленку фазе можно рассматривать как расклинивающее давление. Теория, учитывающая баланс сил притяжения и сил отталкивания ионностабилизированных частиц была разработана Дерягиным, Ландау, Фервеем и Овербеком. В области больших расстояний между частицами (h > 100 нм) образуется дальняя потенциальная яма, в которой происходит обратимая коагуляция золей. Термодинамические факторы устойчивости уменьшают вероятность эффективных соударений между частицами за счет создания потенциальных барьеров, замедляющих или даже исключающих процесс коагуляции. При обратимой коагуляции в зоне контакта между частицами происходит уменьшение поверхностного натяжения. По правилу значности Дерягина – Ландау порог коагуляции золя электролитом изменяется обратно пропорционально шестой степени валентности противоиона. Коллоидная защита – это повышение устойчивости ионностабилизированных золей к действию электролитов при введении в них ВМС и неионных ПАВ. Расклинивающее давление между частицами возникает, если толщина пленки h меньше толщины суммы поверхностных слоев δ. По теории ДЛФО зависимость энергии отталкивания частиц от расстояния между ними описывается экспоненциальной функцией. В системе, потенциальная кривая взаимодействия частиц имеет вид, представленный на рисунке, происходит медленная коагуляция и образование коагуляционных структур. 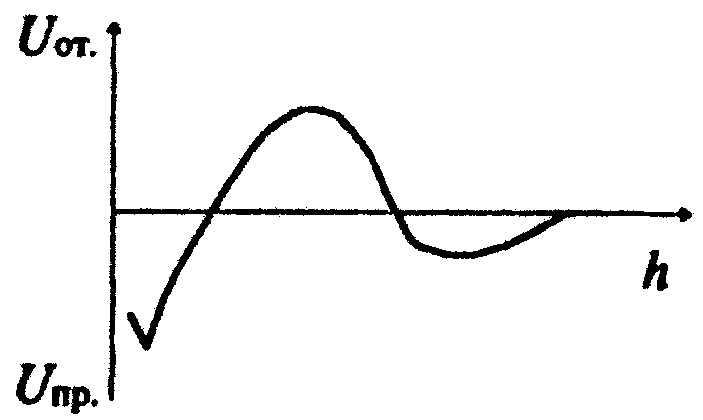 По теории ДЛФО зависимость энергии притяжения частиц от расстояния между ними описывается степенной функцией. Лиофобные коллоидные системы принципиально агрегативно неустойчивы, т.к. обладают избытком свободной поверхностной энергии. В области малых расстояний между частицами (h < 10 нм) образуется ближняя потенциальная яма, в которой происходит необратимая коагуляция золей и образование конденсационно-кристаллизационных структур. При быстрой коагуляции потенциальный барьер ∆U меньше нуля и стерический множитель равен единице. Система, потенциальная кривая взаимодействия частиц в которой вид, представленный на рисунке, находится в устойчивом состоянии. 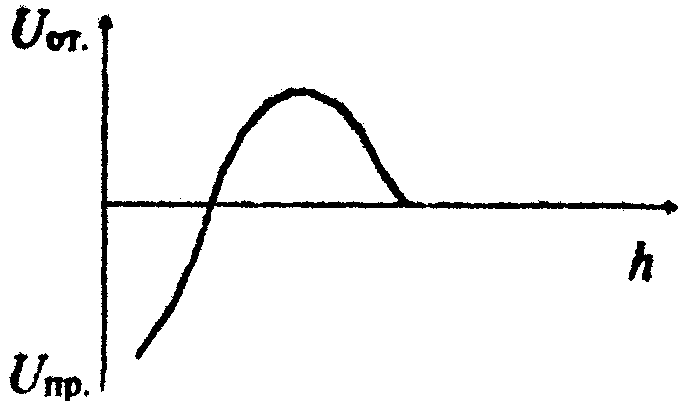 Теория Смолуховского описывает коагуляцию как реакцию второго порядка. Установите последовательностьПорог коагуляции – это ………………….. при концентрация максимальная , начинается минимальная заканчивается электролита которой коагуляция 6, 2, 8, 4, 1, 9, 5, 10 Порог коагуляции – это минимальная концентрация электролита, при которой начинается коауляция. Концентрационная коагуляция – это коагуляция, ……. добавлении электролита неиндифферентного происходит снижения при в золь которая индифферентного в результате увеличения потенциала электрокинетического 8, 4, 6, 1, 7, 9, 2, 10, 5, 13, 12 Концентрационная коагуляция – это коагуляция, которая происходит при добавлении в золь индифферентного электролита в результате снижения электрокинетического потенциала. Нейтрализационная коагуляция осуществляется ……….. в сильно индифферентного по знаку в слабо заряд по знаку электролита золь при введении имеющего неиндифферентного ионов заряженный противоположный с зарядом потенциалопределяющих 9, 4, 13, 8, 11, 7, 10, 5, 14, 3 (6), 15, 16, 12 Нейтрализационная коагуляция осуществляется при введении в слабо заряженный золь неиндифферентного электролита, имеющего заряд, противоположный по знаку с зарядом потенциалопределяющих ионов. Стерическая компонента расклинивающего давления возникает …………. адсорбционных результате углеводородными полимеров в радикалами слоев ПАВ перекрывания с длинными и 5, 2, 9, 1, 7, 8, 10, 3, 6, 11, 4 Стерическая компонента расклинивающего давления возникает в результате перекрывания адсорбционных слоев ПАВ с длинными углеводородными радикалами и полимеров. Расположите коагулирующие ионы в порядке уменьшения порога коагуляции при введении их в золь АgBr, стабилизированный KBr. Na+ Th4+ Li+ РО43- Al3+ Ca2+ SO42- Сs+ Br- 3, 1, 8, 6, 5, 2 Энтропийный фактор устойчивости …… дисперсной к больцмановскому со стремлением по системы распределению фазы связан объему частиц 8, 3, 10, 1, 7, 2, 6, 4, 9, 5 Энтропийный фактор устойчивости связан со стремлением частиц дисперсной фазы к больцмановскому распределению по объему системы. Расположите коагулирующие ионы в порядке уменьшения порога коагуляции при введении их в золь Аg2S, стабилизированный AgNO3. I- Ca2+ Cl- Na+ SO42- Br- Al3+ [Fe(CN)6]4- 3, 6, 1, 5, 8 Электростатический фактор устойчивости связан…….. на поверхности возникновения в соответствии с уравнением электрического Липпмана межфазного двойного натяжения частиц с уменьшением вследствие слоя 11, 7, 9, 12, 2, 8, 5, 13, 1, 10, 3, 4, 6 Электростатический фактор устойчивости связан с уменьшением межфазного натяжения вследствие возникновения двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана. Латекс является …… которой диспергирован но трехкомпонентной стабилизатора. системой, полимер двухфазной в воде в в присутствии. 7, 3, 5, 9, 1, 6, 2, 8, 10, 4 Латекс является двухфазной, но трехкомпонентной системой, в которой полимер диспергирован в воде в присутствии стабилизатора. Опишите последовательность проведения эксперимента при определении защитного числа желатины для ионностабилизированных золей. 1% раствор желатины добавить в 1-ю пробирку 0,1 мл раствора желатины через 8 – 10 минут добавить во все пробирки раствор коагулятора любой концентрации; и 200 мл ионностабилизированного золя в каждую последующую пробирку добавить возрастающее на 0,1 мл количество желатины отметить рассчитать защитное число по формуле S = Cст∙Vзащ/ Vзоля налить в 10 пробирок встряхнуть пробирки по 10 мл ионностабилизированного золя количество раствора желатины, достаточное для защиты золя, рассчитывают, взяв среднее значение стабилизатора, при котором произошла коллоидная защита, и тем количеством, при котором еще не происходит защита ( в предыдущей пробирке) пробирку, в которой золь остался прозрачным, т.е. произошла коллоидная защита золя приготовить 13, 1, 4, 8, 10, 2, 5, 9, 3, 6, 12, 11, 7 Приготовить 1% раствор желатины и 200 мл ионностабилизированного золя. Налить в 10 пробирок по 10 мл ионностабилизированного золя. Добавить в 1-ю пробирку 0,1 мл раствора желатины. В каждую последующую пробирку добавить возрастающее на 0,1 мл количество желатины. Встряхнуть пробирки. Через 8 – 10 минут добавить во все пробирки раствор коагулятора любой концентрации. Отметить пробирку, в которой золь остался прозрачным, т.е. произошла коллоидная защита золя. Количество раствора желатины, достаточное для защиты золя, рассчитывают, взяв среднее значение стабилизатора, при котором произошла коллоидная защита, и тем количеством, при котором еще не происходит защита ( в предыдущей пробирке). Рассчитать защитное число по формуле S = Cст∙Vзащ/ Vзоля. Опишите последовательность проведения эксперимента при определении порога коагуляции золя гидроксида железа. реакцией FeCl3 приготовить по 10 мл встряхнуть пробирки гидролиза золь Fe(OH)3 добавить в 1 пробирку 0,5 мл раствора Na2SO4 отметить отсутствие мутности добавить в 3 пробирку 0,5 мл раствора Na2SO4 приготовленного золя или налить в пробирки добавить во 2 пробирку 0,5 мл раствора Na2SO4 наличие 3, 7, 1, 6, 2, 14, 4, 12, 8, 15, 11, 5, 9, 13, 16, 10 Приготовить золь Fe(OH)3 реакцией гидролиза FeCl3. Налить в пробирки по 10 мл приготовленного золя, добавить в 1 пробирку 0,5 мл раствора Na2SO4, добавить во 2 пробирку 0,5 мл раствора Na2SO4, добавить в 3 пробирку 0,5 мл раствора Na2SO4, встряхнуть пробирки. Отметить отсутствие или наличие мутности. Зеленое – верные утверждения, красное – неверные утверждения 100. Лиофобные коллоидные системы принципиально агрегативно неустойчивы, ПОТОМУ ЧТО они обладают недостатком свободной поверхностной энергии. 101. Лиофильные коллоидные системы агрегативно неустойчивы, ПОТОМУ ЧТО при их образовании изменение энергии Гиббса меньше нуля. 102. Лиофобные коллоидные системы принципиально агрегативно не устойчивы, ПОТОМУ ЧТО обладают избытком свободной поверхностной энергии. 103. Электростатический фактор устойчивости относится к кинетическим факторам устойчивости, ПОТОМУ ЧТО он связан с увеличением межфазного поверхностного натяжения при возникновении двойного электрического слоя на поверхности частиц в соответствии с уравнением Липпмана. 104. Адсорбционно-сольватный фактор устойчивости относится к термодинамическим факторам устойчивости, ПОТОМУ ЧТО он связан с увеличением межфазного поверхностного натяжения при взаимодействии частиц дисперсной фазы со средой в соответствии с уравнением Дюпре. 105. Энтропийный фактор устойчивости относится к кинетическим факторам устойчивости, ПОТОМУ ЧТО связан со стремлением частиц дисперсной фазы к больцмановскому распределению по объему системы. 106. Структурно-механический фактор относится к термодинамическим факторам устойчивости, ПОТОМУ ЧТО связан с образованием на поверхности частиц пленок стабилизатора, обладающих упругостью и механической прочностью. 107. Энтропийный фактор устойчивости относится к термодинамическим факторам устойчивости, ПОТОМУ ЧТО при использовании в качестве стабилизатора высокомолекулярного соединения на поверхности частиц образуются пленки, обладающие упругостью и механической прочностью. 108. Концентрационная коагуляция осуществляется при введения в слабо заряженный золь неиндифферентного электролита, ПОТОМУ ЧТО при неиндифферентного электролита, имеющего заряд, противоположный по знаку с зарядом потенциалопределяющих ионов происходит уменьшение ϕ0-потенциала. 109. Концентрационная коагуляция осуществляется при введении в сильно заряженный золь индифферентного электролита, ПОТОМУ ЧТО при этом происходит сжатие диффузионной части двойного электрического слоя и уменьшение энергетического барьера, препятствующего слипанию частиц. 110. Нейтрализационная коагуляция осуществляется при введении в сильно заряженный золь индифферентного электролита, ПОТОМУ ЧТО при этом происходит сжатие диффузионной части двойного электрического слоя и уменьшение энергетического барьера, препятствующего слипанию частиц. 111. Коагуляцию ионностабилизированной системы вызывают все электролиты, ПОТОМУ ЧТО при добавлении электролитов происходит расширение диффузионной части двойного электрического слоя и уменьшение энергетического барьера, препятствующего слипанию частиц. 112. Коагулирующим действием в электролите обладают ионы, имеющие заряд, одноименный по знаку заряду коллоидной частицы, ПОТОМУ ЧТО при введении индифферентного электролита происходит сжатие диффузионной части двойного электрического слоя и уменьшение энергетического барьера, препятствующего слипанию частиц. 113. Коагулирующим действием в электролите обладают ионы, имеющие заряд, одноименный по знаку заряду противоиона мицеллы, ПОТОМУ ЧТО при введении неиндифферентного электролита, имеющего заряд, одинаковый по знаку с зарядом потенциалопределяющих ионов происходит их специфическая адсорбция и нейтрализация ϕ0-потенциала в адсорбционном слое. 114. Коагуляция ионностабилизированных систем наступает при добавлении сколь угодно малой концентрации электролита, ПОТОМУ ЧТО при добавлении в систему любого количества индифферентного электролита происходит сжатие двойного электрического слоя. |
