Реферат Сильные и слабые электролиты. Диссоциация кислот, основа. Сильные и слабые электролиты. Диссоциация кислот, оснований и солей
 Скачать 61.18 Kb. Скачать 61.18 Kb.
|
|
АНГАРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ Технологический факультет Кафедра Технологии электрохимических производств РЕФЕРАТ По дисциплине «Общая и неорганическая химия» На тему: «Сильные и слабые электролиты. Диссоциация кислот, оснований и солей» Выполнил: Швецов А. С. Группа ХТз-20-2 Проверил: Кривидин Л. Б. Заведующий кафедрой химии Профессор. Ангарск 2020г. Введение Электролиты чрезвычайно важны в науке и технике. Все жидкие системы в живых организмах содержат электролит. Важный класс электролитов - полиэлектролиты. Электролиты являются средой для проведения многих химических синтезов и процессов электрохимических производств. При этом всё большую роль играют неводные растворы электролитов. Благодаря им возможно создания новых химических источников тока и совершенствования технологических процессов разделения веществ - экстракции из растворов и ионного обмена. Электролиты – вещества, подвергающиеся в растворах или расплавах электролитической диссоциации и проводящие электрический ток за счет движения электронов. Сила электролита в значительной степени зависит от природы растворителя. Мерой воздействия растворителя является диэлектрическая проницаемость, значение которой для воды весьма высока и при 20 градусах равно 81. Именно для воды свойство ослаблять химические связи между ионами особенно сильно. Деление электролитов на сильные и слабые в некоторой степени условно, т. к. оно отражает не свойства самих электролитов, а их состояние в растворе. Последнее зависит от концентрации, природы растворителя, температуры, давления и др. Цель данного реферата дать определение понятию электролиты, выявить их свойства и различия, а также подробно рассмотреть диссоциации кислот, оснований и солей. Электролитическая диссоциация. Одним из важнейших факторов растворимости являются силы межмолекулярного взаимодействия возникающие между частицами растворенного вещества и молекулами растворителя. В ряде случаев действие этих сил приводит к тому, что дробление веществ на мельчайшие частицы в растворе идет дальше и растворение сопровождается диссоциацией молекул на ионы. Например:  Представьте, что газообразный хлористый водород попадает в воду и начинает взаимодействовать с молекулами растворителя. При этом молекулы HCl связываются с молекулами воды силами межмолекулярного взаимодействия. Обобщенно такой процесс называется гидратацией, а связанные с HCl молекулы воды – гидратной оболочкой. В случае с раствором хлороводорода (соляная кислота) дальнейшая гидратация молекул HCl приводит к разрыву связи H–Cl и образованию в растворе гидратированных подвижных ионов H+(водн) и Cl–(водн). Ионы несут электрический заряд – положительный и отрицательный. Раствор, в котором теперь присутствуют подвижные ионы, становится электропроводным. Поэтому процесс распада вещества в растворе на ионы называется электролитической диссоциацией. Электролитическая диссоциация – это полный или частичный распад растворенного вещества на ионы. Теорию электролитической диссоциации в 80-х годах XIX века предложил выдающийся шведский химик Сванте Аррениус (1859-1927). Сегодня нам кажется вполне естественным, что растворенные вещества могут распадаться на ионы. Мы знаем, почему устойчивы именно такие, а не другие ионы – это знание опирается на современные представления о строении атомов. Например, элемент Na (электронная оболочка 1s2 2s2 2p6 3s1) может существовать в виде устойчивого катиона Na+, имеющего уже электронную оболочку чрезвычайно стабильной частицы – атома инертного газа неона (1s2 2s2 2p6). В отличие от нейтрального атома неона, заряженная частица Na+ хорошо взаимодействует с молекулами полярного растворителя – воды. Анион Cl– имеет электронную оболочку инертного газа аргона (…3s2 3p6). Таким образом, на процесс диссоциации влияет не только взаимодействие ионов с растворителем, но и фактор устойчивости самих ионов. Однако в конце XIX века о строении атомов ничего не было известно и многие ученые не поняли и не приняли теорию Аррениуса. Уязвимым местом теории была и ее неспособность объяснить, какие именно силы обеспечивают разделение прочно связанных в соединениях атомов при растворении. Удивительно, но одним из наиболее непримиримых противников теории электролитической диссоциации был Д. И. Менделеев, развивавший химическую теорию растворов. Он полагал, что при растворении веществ происходит их соединение с молекулами растворителя, в то время как теория Аррениуса отводила растворителю лишь роль некой пассивной среды, не влияющей на свойства раствора. Критика теории электролитической диссоциации Менделеевым не могла не вызвать резкой отрицательной реакции у Аррениуса – одну из своих статей он назвал «Электролитическая диссоциация против гидратации» (1889 г). Интересно то, что каждый из оппонентов был по-своему прав: сегодня мы знаем, что вещества-электролиты в водных растворах диссоциируют на гидратированные ионы, и именно энергия гидратации расходуется на разрушение связей в веществе при его растворении и диссоциации. В 1903 году С. Аррениусу была присуждена Нобелевская премия с формулировкой: «в признание выдающихся заслуг в развитии химии, достигнутых теорией электролитической диссоциации». По признаку электрической проводимости все растворы можно разделить на две большие группы: растворы электролитов (проводят электрический ток) и растворы неэлектролитов (ток не проводят). Например, чистая вода, а также водные растворы сахара, глюкозы, спирта и ряда других веществ ток практически не проводят (в растворах отсутствуют ионы), поэтому эти вещества – неэлектролиты. Напротив, раствор хлороводорода (соляная кислота) – это не просто электролит, а сильный электролит: более 99% молекул HCl в растворе распадаются на ионы H+ и Cl–. Поэтому обратную стрелку в уравнении диссоциации HCl изображают короткой или вообще не пишут. Такие же свойства у растворов HBr (бромоводородная кислота) и HI (иодоводородная кислота). Однако вполне похожее соединение – фтороводород HF – не проявляет свойств сильного электролита и в растворе ток проводит плохо. Здесь, наоборот, в уравнении диссоциации нужна более длинная обратная стрелка: 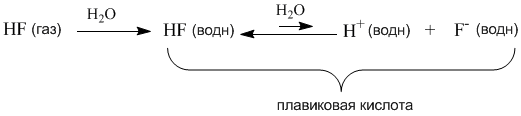 Константа и степень диссоциации. В месте с процессом диссоциации на ионы, в растворах происходит и обратный процесс – ассоциация ионов в нейтральные молекулы. Таким образом, электролитическая диссоциация – это обратимая химическая реакция или динамическое равновесие, к которому применимы те же закономерности, что и к любому другому химическому равновесию. Например, для описания процесса диссоциации можно использовать константу равновесия Кр, которая в данном случае будет называться константой диссоциации Кд: 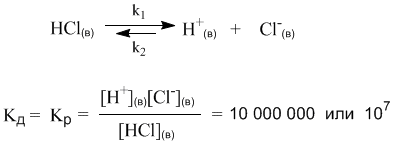 Маленький индекс (в) означает «водный» – т.е. молекулы и ионы находятся в водном растворе. Часто его не пишут, полагая, что и так все понятно. Итак, константа диссоциации Кд – это частный случай константы равновесия. Значения Кд для сильных электролитов часто бывают настолько велики, что их не удается измерить непосредственно. Эти значения получают косвенно, из термодинамических данных, и в разных справочниках они могут отличаться, хотя и остаются очень большими. Для нас здесь важно то обстоятельство, что ионов H+ и Cl– в растворе очень много (их концентрация – в числителе дроби), а недиссоциированных молекул [HCl] чрезвычайно мало. Напротив, Кд фтороводорода намного меньше единицы (ее значение уже можно определить более точно – см. следующий параграф). Следовательно, в растворе много недиссоциированных молекул HF и мало ионов H+ и F–. 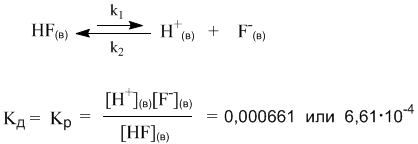 Оба раствора (HCl и HF) являются растворами электролитов, но HCl – сильный электролит, а HF – слабый. На примере этих двух веществ мы видим, что хорошую (или плохую) диссоциацию в растворе, как и хорошую (или плохую) растворимость трудно предсказать только по формуле вещества. Помимо константы диссоциации, мерой силы электролита может служить степень диссоциации α. Это отношение числа распавшихся на ионы молекул (n1) к общему числу молекул (n0), изначально попавших в раствор:  Если речь идет не о молекулярных, а ионных соединениях, то понятие «молекула» следует заменить понятием «формульная единица» (например, NaCl). Допустим, в опыте установлено, что при растворении в воде уксусной кислоты CH3COOH только одна из каждых 100 молекул распадается на ионы Н+ и CH3COO–. Это означает, что степень диссоциации уксусной кислоты в растворе составляет примерно 1/100 или 0,01. Можно α выразить и в процентах (1%). На основании степеней диссоциации удобно разделять все электролиты на сильные и слабые: сильные электролиты – α близка к 1 (или 100%); слабые электролиты – α около 0,01 (1% и менее). Такое деление условно, но оно очень удобно для написания ионных уравнений химических реакций: достаточно принять за правило, что только сильные электролиты можно записывать в ионном виде, а слабые – нет. Поскольку вода – полноправный участник процесса диссоциации, ее иногда включают в химическое уравнение. Например, для уксусной кислоты процесс ее диссоциации в воде можно записать так:  Такие уравнения как бы подчеркивают, что ионы в водном растворе не изолированы, а связаны с молекулами растворителя. Для иона Н+ это взаимодействие очень характерно: благодаря его связыванию с не поделенной электронной парой атома кислорода молекулы Н2О образуется достаточно прочный комплекс Н2О---Н+ или, как его условно называют, ион гидроксония Н3О+. Конечно, молекулы воды взаимодействуют и с анионом CH3COO– (и любыми другими анионами), но это обстоятельство в уравнениях диссоциации обычно не отражают просто по традиции (и чтобы не загромождать уравнения). Поскольку к процессу диссоциации применим принцип Ле Шателье, последнее уравнение указывает нам на еще одну важную закономерность: если разбавлять раствор уксусной кислоты, т.е. добавлять в него воду, то по принципу Ле Шателье должен активизироваться процесс, связанный с расходованием воды, т.е. прямая реакция (распад на ионы). В этом случае в растворе должен активизироваться процесс образования ионов из молекул. Иными словами, при разбавлении растворов слабых электролитов степень диссоциации возрастает. Этот закон, установленный физико-химиком Вильгельмом Оствальдом в 1888 г., позволяет, в частности, с высокой точностью определять константы диссоциации многих веществ (за исключением очень сильных электролитов). Дело в том, что величину α удается опытным путем связать с электропроводностью раствора. Таким образом, зная концентрацию раствора, и выяснив в опыте степень диссоциации электролита, можно вычислить и величину Кд. Полезность закона разбавления не исчерпывается определением констант диссоциации. Приведем простой пример его практического использования – вычислим более точно степень диссоциации в 0,1 М растворе уксусной кислоты, если ее константа диссоциации Кд = 1,8·10–5. Поскольку электролит слабый (это видно из константы диссоциации), можно воспользоваться законом разбавления для слабых электролитов: Кд = α2С. Отсюда:  Подставляя в эту формулу численные значения, получим: 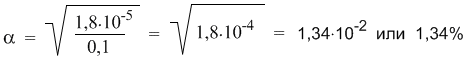 Эта же формула поможет нам количественно определить, как изменитя степень диссоциации в таком растворе, если его разбавить в 10 раз. После разбавления концентрация уксусной кислоты составит 0,01 М. Отсюда: 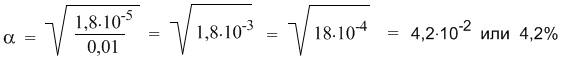 Мы видим, что при разбавлении степень диссоциации уксусной кислоты заметно возросла. Диссоциация кислот, оснований, солей. При диссоциации кислот роль катионов играют ионы водорода (H+), других катионов при диссоциации кислот не образуется: HF ↔ H+ + F- HNO3 ↔ H+ + NO3- Именно ионы водорода придают кислотам их характерные свойства: кислый вкус, окрашивание индикатора в красный цвет и проч. Отрицательные ионы (анионы), отщепляемые от молекулы кислоты, составляет кислотный остаток. Одной из характеристик диссоциации кислот является их основность - число ионов водорода, содержащихся в молекуле кислоты, которые могут образовываться при диссоциации: одноосновные кислоты: HCl, HF, HNO3; двухосновные кислоты: H2SO4, H2CO3; трехосновные кислоты: H3PO4. Процесс отщепления катионов водорода в многоосновных кислотах происходит ступенчато: сначала отщепляется один ион водорода, затем другой (третий). Ступенчатая диссоциация двухосновной кислоты: H2SO4 ↔ H+ + HSO4- HSO4- ↔ H+ + HSO42- Ступенчатая диссоциация трехосновной кислоты: H3PO4 ↔ H+ + H2PO4- H2PO4- ↔ H+ + HPO42- HPO42- ↔ H+ + PO43- При диссоциации многоосновных кислот самая высокая степень диссоциации приходится на первую ступень. Например, при диссоциации фосфорной кислоты степень диссоциации первой ступени равняется 27%; второй - 0,15%; третьей - 0,005%. При диссоциации оснований роль анионов играют гидроксид-ионы (ОH-), других анионов при диссоциации оснований не образуется: NaOH ↔ Na+ + OH- Кислотность основания определяется кол-вом гидроксид-ионов, образующихся при диссоциации одной молекулы основания: однокислотные основания - KOH, NaOH; двухкислотные основания - Ca(OH)2; трехкислотные основания - Al(OH)3. Многокислотные основания диссоциируют, по аналогии с кислотами, также ступенчато - на каждом этапе отщепляется по одному гидроксид-иону: Zn(OH)2 ↔ ZnOH+ + OH- ZnOH+ ↔ Zn2+ + OH- Некоторые вещества, в зависимости от условий, могут выступать, как в роли кислот (диссоциировать с отщеплением катионов водорода), так и в роли оснований (диссоциировать с отщеплением гидроксид-ионов). Такие вещества называются амфотерными. Диссоциация Zn(OH)2, как основания: Zn(OH)2 ↔ ZnOH+ + OH- ZnOH+ ↔ Zn2+ + OH- Диссоциация Zn(OH)2, как кислоты: Zn(OH)2 + 2H2O ↔ 2H+ + [Zn(OH)4]2- Соли диссоциируют в воде на анионы кислотных остатков и катионы металлов (или других соединений). Классификация диссоциации солей: Нормальные (средние) соли получаются полным одновременным замещением всех атомов водорода в кислоте на атомы металла - это сильные электролиты, полностью диссоциируют в воде с образованием катоинов металла и однокислотного остатка: NaNO3, Fe2(SO4)3, K3PO4. Пример диссоциации нормальной соли: K3PO4 ↔ 3K+ + PO43- Кислые соли содержат в своем составе кроме атомов металла и кислотного остатка, еще один (несколько) атомов водорода - диссоциируют ступенчато с образованием катионов металла, анионов кислотного остатка и катиона водорода: NaHCO3, KH2PO4, NaH2PO4. Пример диссоциации кислой соли: NaHCO3 ↔ Na+ + HCO3- HCO3- ↔ H+ + CO32- Основные соли содержат в своем составе кроме атомов металла и кислотного остатка, еще одну (несколько) гидроксильных групп - диссоциируют с образованием катионов металла, анионов кислотного остатка и гидроксид-иона: (CuOH)2CO3, Mg(OH)Cl. Пример диссоциации основной соли: Mg(OH)Cl ↔ Mg(OH)+ + Cl- Mg(OH)+ ↔ Mg2+ + OH- Двойные соли получаются одновременным замещением атомов водорода в кислоте на атомы различных металлов: KAl(SO4)2. Пример Диссоциации двойной соли: KAl(SO4)2 ↔ K+ + Al3+ + 2SO42- Смешанные соли диссоциируют на катионы металла и анионы нескольких кислотных остатков: CaClBr. Пример диссоциации смешанной соли: CaClBr ↔ Ca2+ + Cl- + Br- Заключение. Итак, подведем итоги: Электролитами называют вещества, растворы и сплавы которых с другими веществами электролитически проводят гальванический ток. Признаком электролитической проводимости в отличии от металлической должно считать возможность наблюдать химическое разложение данного вещества при более или менее продолжительном прохождении тока. В химически чистом состоянии электролиты обыкновенно обладают ничтожно малой электропроводностью. Термин электролит широко используется в биологии и медицине. Чаще всего подразумевают водный раствор, содержащий те или иные ионы (напр., «всасывание электролитов» в кишечнике). Слово электролит широко используется в науке и технике, в разных отраслях оно может иметь различающийся смысл. Многокомпонентный раствор для электроосаждения металлов, а также травления и др. (технический термин, например электролит золочения) Электролиты являются важной частью химических источников тока: гальванических элементов и аккумуляторов. Электролит участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС. В источниках тока электролит может находиться в жидком состоянии (обычно это водный раствор) или загущённым до состояния геля. В электролитических конденсаторах в качестве одной из обкладок используется электролит. В качестве второй обкладки — металлическая фольга (алюминий) или пористый, спечённый из металлических порошков блок (тантал, ниобий). Диэлектриком в таких конденсаторах служит слой оксида самого металла, формируемый химическими методами на поверхности металлической обкладки. Список используемой литературы. Ипполитов Е.Г., Артемов А.В., Батраков В.В. Физическая химия [Электронный ресурс]: Учебник для студентов высших учебных заведений. – Москва: Издательский центр «Академия» 2005. – 448с. Глинка Н.Л. Общая химия [Электронный ресурс]: Учебное пособие предназначено для студентов нехимических специальностей высших учебных заведений. – Москва, 2005. – 687с. Ахметов Н.С. Общая и неорганическая химия. Учебник для вузов. – Москва, 2003. – 743с. Гельфман М.И., Юстратов В.П. Неорганическая химия [Электронный ресурс]: Учебное пособие для студентов, обучающихся по технологическим направлениям и специальностям. – Москва, Санкт-Петербург, Краснодар: Издательство «Лань» 2009. –528с. |
