Вариант 16. Комплексная задача 2
 Скачать 0.93 Mb. Скачать 0.93 Mb.
|
|
Вариант №16 Комплексная задача №2 В настоящее время в системах противопожарной безопасности небольших объектов, подлежащих защите системами автоматического пожаротушения, все большее распространение получают автоматические установки газового пожаротушения. Составной частью таких установок пожаротушения является стальной баллон, в котором находится сжиженное или сжатое газовое огнетушащее вещество (ГОТВ) [5]. В баллоне емкостью V1 дм3 находится m1 кг ГОТВ (определяется вариантом задания) под давлением p1 атм. Задания: 1.Часть газа была взята для работы, при этом давление в баллоне понизилось до p2 атм. Какое количество ГОТВ m2 кг осталось в баллоне, если температура во время отбора не изменилась? 2.Какой объем V2 м 3 займет m2 кг ГОТВ при н.у.? 3.Во сколько раз уменьшилось количество молекул ГОТВ в баллоне после его использования (см.п.1)? 4.Какова плотность ГОТВ по воздуху? Cогласно закону Бойля-Мариотта: при постоянной температуре абсолютное давление, производимое данной массой газа обратно пропорционально объему газа: P1V1 = P2V2 илиPV = const V2= 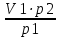 =20л =20лm=pV=1,98‧20=39,6 г pV= 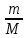 RT RT32V= 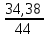 ‧8,31‧273 ‧8,31‧273V=55 л N= vNa, v=39,6:44=0,9 моль N=5,42‧10-23 моль D(CO2)(воздух)=44:29=1,51 Комплексная задача №3 При проектировании цеха по производству химического вещества (Х) в промышленных масштабах необходимо указать расположение вентиляционных шахт для вывода людей из рабочей зоны, в которой возможно возникновение чрезвычайной ситуации. Задания (вещество Х определяется вариантом): 1. Рассчитать молярную массу газообразного вещества (Х) по указанной относительной плотности газа; 2. Используя состав вещества (Х) в массовых процентах, определить формулу вещества (Х); 3. Определите порядковые номера, число нейтронов, число протонов, число электронов, номер периода и номер группы периодической системы химических элементов, в которых находятся атомы элементов, входящих в состав молекулы. 4. Напишите электронную формулу атомов химических элементов, входящих в состав молекулы. Определите электронные семейства, к которым относятся элементы. 5. Определите квантовые числа валентных электронов в наиболее электроотрицательном атоме, входящем в состав молекулы. 6. Используя метод валентных связей, показать образование молекулы (Х); 7. Определите степени окисления атомов в молекуле. 6.Сравните окислительно-восстановительные, кислотно-основные свойства атомов химических элементов, входящих в состав молекулы, проанализировав их положение в периодической таблице Д.И. Менделеева. 8. Определите тип химической связи в молекуле (Х) на основании разности электроотрицательностей атомов (электроотрицательности приведены в Приложении 2 табл. 1). 9. Оценить пожарную опасность (горючее вещество или окислитель) химического вещества (Х), используя справочник [4] Решения:  M(x)=D(Cl2)‧M(Cl2)=1,14‧71=80,94 v(H)=2,49 моль v(Se)=97,51:79=1,2 моль v(H):v(Se)=2:1 Простейшая формула H2Se Делим молярную массу H2Se на молярную массу вещества x и получаем 1, следовательно H2Se истинная формула. H-1 электрон и протон, 1 нейтрон, 1 группа и период N-7 протона и электрона, 7 нейтронов, 2 период и 5 группа. Электронная формула азота- 1s2 2s2 2p3 Электронная формула водорода- 1s1 Водород-s элемент Азот-p элемент Валентные электроны водорода-1 Количество валентных электронов в атоме водорода - 1. Ниже приведены их квантовые числа (N - главное, L - орбитальное, M - магнитное, S - спин) Количество валентных электронов в атоме азота - 5. Ниже приведены их квантовые числа (N - главное, L - орбитальное, M - магнитное, S - спин) 6)  7) CO в NH3= H+1, N-3 8) Ковалентная полярная 9) Водород (H, лат. hydrogenium) — химический элемент периодической системы с обозначением H и атомным номером 1, самый лёгкий из элементов периодической таблицы. Его одноатомная форма — самое распространённое химическое вещество во Вселенной, составляющее примерно 75 % всей барионной массы. Звёзды, кроме компактных, в основном состоят из водородной плазмы. Три изотопа водорода имеют собственные названия: 1H — протий, 2H — дейтерий и 3H — тритий (радиоактивен). Ядро самого распространённого изотопа, протия, состоит из одного только протона и не содержит нейтронов. При стандартных температуре и давлении водород — бесцветный, не имеющий запаха и вкуса, нетоксичный двухатомный газ с химической формулой H2, который в смеси с воздухом или кислородом горюч и крайне пожаро- и взрывоопасен. В присутствии других окисляющих газов, например фтора или хлора, водород также взрывоопасен. Поскольку водород охотно формирует ковалентные связи с большинством неметаллов, большая часть водорода на Земле существует в молекулярных соединениях, таких как вода или органические вещества. Водород играет особенно важную роль в кислотно-основных реакциях. Растворим в этаноле и ряде металлов: железе, никеле, палладии, титане, платине, ниобии. Итог: пожароопасен Азот (N, лат. nitrogenium) — химический элемент 15-й группы (по устаревшей короткой форме периодической системы принадлежит к главной подгруппе V группы, или к группе VA), второго периода периодической системы с атомным номером 7. Относится к пниктогенам. Как простое вещество представляет собой двухатомный газ без цвета, вкуса и запаха. Один из самых распространённых элементов на Земле. Химически весьма инертен, однако реагирует с комплексными соединениями переходных металлов. Основной компонент воздуха (78,09 % объёма), разделением которого получают промышленный азот (более ¾ идёт на синтез аммиака). Применяется как инертная среда для множества технологических процессов; жидкий азот — хладагент. Азот — один из основных биогенных элементов, входящих в состав белков и нуклеиновых кислот. Комплексная задача № 4 На складе химических реактивов был обнаружен ряд склянок без этикеток. Задания: 1.К какому классу неорганических соединений по традиционной классификации относятся указанные вещества. Назовите эти вещества. 2.Определите степень окисления атомов элементов, входящих в состав предложенных соединений. 3.Оцените растворимость веществ в воде. 4.Оцените возможность протекания реакций при смешении веществ, если в склянках находятся реактивы, указанные в варианте комплексной задачи. Назовите продукты реакций. 5.Оценить по справочнику [4], какая реакция представляет собой наибольшую пожарную опасность. Сделать вывод, какие вещества несовместимы при хранении друг с другом.  HI(йодовородная кислота)- класс бескислородныз кислот NaOH(гидроксид натрия)- класс оснований СО в HI= H+1, I-1 CO в NaOH= Na+1,O-2,H+1 Оба вещества хорошо растворимы в воде Вступают в реакцию нейтрализации: NaOH+HI=NaI+H2O При взаимодействии данных веществ взрывоопасность и пожароопасность является минимальной, но это возможно так как гидроксид- пожароопасен Комплексная задача (растворы электролитов) № 5 При очистке реактора установки по производству соли (определяется номером варианта, столбец 2) часть продукта осталась не изъятой. Определить: 1. Концентрацию (СМ, Сm, Х, ω) раствора соли, если в реакторе её осталось 5 кг, а объём воды, необходимый для первичной отмывки реактора в 10 раз больше, чем для образования насыщенного раствора этой соли (S, г на 100 г воды, столбец 3). 2. При растворении соли в воде возможен её гидролиз. Запишите соответствующие уравнения процесса. Определите pH образовавшегося раствора (рН < 7, pH > 7, pH ≈ 7)  S(CoCl2)=55,3 г/100 г воды 100 г воды-52,9(CoCl2) 1000 г воды- х г (CoCl2) m(CoCl2)=529 г 1000 г воды-529 г Х- 5000 г m(H2O)=9452 m р-ра= 9452+5000=14452 г w= 5000:14452‧100=34,60% CM=v/Vр-ра v=m/M=5000:130=38,46 Vр-ра=14452 мл CM=38,46/моль:14452мл=0,002 моль/мл Сm=0,002 моль/мл‧1000мл=2,4моль CoCl2 — соль образованная слабым основанием и сильной кислотой, поэтому реакция гидролиза протекает по катиону. ПЕРВАЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА Молекулярное уравнение CoCl2 + HOH ⇄ CoOHCl + HCl Полное ионное уравнение Co2+ + 2Cl- + HOH ⇄ CoOH+ + Cl- + H+ + Cl- Сокращенное (краткое) ионное уравнение Co2+ + HOH ⇄ CoOH+ + H+ ВТОРАЯ СТАДИЯ (СТУПЕНЬ) ГИДРОЛИЗА Молекулярное уравнение CoOHCl + HOH ⇄ Co(OH)2 + HCl Полное ионное уравнение CoOH+ + Cl- + HOH ⇄ Co(OH)2 + H+ + Cl- Сокращенное (краткое) ионное уравнение CoOH+ + HOH ⇄ Co(OH)2 + H+ СРЕДА И PH РАСТВОРА ХЛОРИДА КОБАЛЬТА (II) В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7). Комплексная задача (растворы неэлектролитов) № 6 В технологическом процессе завода химического синтеза первичный подогрев вещества Х (столбец 2) осуществляется в трубчатых змеевиках, а для повышения производительности установки в Х вводят вещество Y. Определить температуру кипения и замерзания раствора, содержащего m 7 (кг) вещества Х и n (моль) вещества Y (столбец 3, 4), если для Х Кк = а моль С кг о (столбец 5), Кэ = b моль С кг о (столбец 6), t зам = с 0С (столбец 7), t кип = d 0С (столбец 8). 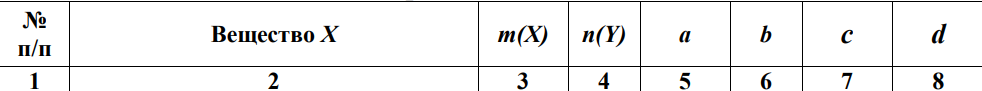  m(X)- масса растворителя по условия она равна 5 кг n(Y)=m/M=31:160=19 моль Тогда повышение температуры кипения составит: Соответственно температура кипения равна: 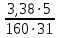 =0,003 °C =0,003 °CНайдем температуру замерзания по формуле:  = Кэ‧m(x)=3,38 = Кэ‧m(x)=3,38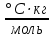 ‧5 кг=16,9 °C. ‧5 кг=16,9 °C.Комплексная задача № 8 В гальваническом цехе завода «Точ прибор» происходит нанесение металлических покрытий металлом У на детали машин, сделанных из металла Х. Определить (используя приложение 6, табл.1.): 1.ЭДС концентрационного гальванического элемента, электродами которого являются металлы Х (столбец 2) и У (столбец 3) (электроды погружены в растворы своих солей), а концентрация растворимых солей Х и У составляют значения согласно варианту задания (столбец 6, 7). 2.В процессе электролитического нанесения покрытия детали из металла Х, на её поверхности осаждается (m, г) металла У. Вычислить массу металла У, если электролитический процесс протекает при силе тока, равной I, А (столбец 5), в течение секунд (столбец 4).  Гальвинический элемент образован цинковым и магниевым электродами погруженные в растворы солей При сравнении стандартных электродных потенциалов Е0Zr≥ Е0Fe Стандартные электронные потенциалы:
Концентрация ионов циркония=1.53 Концентрация ионов железа=0.44 По уравнению Нернста 𝐸 = 𝐸 0 + 𝑅 ∙ 𝑇 𝑛 ∙ 𝐹 ∙ 𝑙𝑛𝐶𝑀 = 𝐸 0 + 0,059 𝑛 ∙ 𝑙𝑔𝐶𝑀 где E0 – стандартный электродный потенциал, В; R=8,314 кДж/(моль К) – универсальная газовая постоянная; Т – температура процесса, К; F=96500 - число Фарадея; n – число переходящих электронов. Е0 Zn+4/Zn = Е0 Zr+4/Zr +0,059:n‧𝑙𝑛𝐶 Е0 Zr+4/Zr =-1,538B Е0 Fe+2/W = Е0 Fe+2/Fe+0,059:n‧𝑙𝑛𝐶 Е0 Fe+2/Fe =-0,446B Законы электролиза: Связь между количеством выделившегося при электролизе вещества и количеством прошедшего через электролит электричества выражается законом Фарадея: Масса вещества, выделившегося на электродах при электролизе, прямо пропорциональна количеству электричества, прошедшего через электролит. 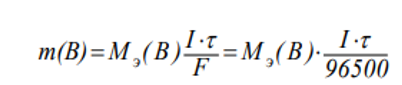  m(B)=59‧ 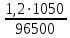 =0,73 г =0,73 гТип покрытия-химический Горячий метод — защищаемое изделие погружают в расплавленный металл. Покрытие (например, из Zn, Sn, Pb и др.) образуется после извлечения его из ванны. Комплексная задача № 9 В полом технологическом аппарате ёмкостью V1 л (столбец 3), рассчитанном на максимальное давление p1 атм. (столбец 4) проводят исследования по определению пожаровзрывоопасных показателей взрывчатого вещества. Задания: 1.Определить максимальную массу вещества, которую можно подавать в технологический аппарат, если разложение этого вещества при взрыве протекает по реакции, указанной в варианте задания (температура взрыва t oC – столбец 5)? 2.Определить объем газа (приведенный к н.у.), который получается при взрыве 1 кг взрывчатого вещества. 3.Определить теплоту взрывчатого разложения вещества (∆H х. р.), оцентите не прибегая к расчётам ΔS 0 х.р.. 4.Какие процессы окисления и восстановления соответствуют уравнению реакции.  V=P0V0T:T0P=101,3‧22,4‧4273:273‧2026=17,5 л X=0,1:17,5=0,01 Согласно уравнению реакции 1 моль гексогена образует 1 моль газовой смеси не более 0,01 моль 1 моль нитрометана=61 г/моль Х=61г/моль‧0,01моль=0,61 г V=P0V0T:T0P=101,3‧22,4‧4273:273‧2026=17,5 л Определить объем продуктов взрыва 1 кг нитрометана Взрывчатое разложение: V0= 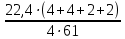 =1,47 м3/кг. =1,47 м3/кг.Нитрометан- восстановителем процесс окисления Комплексная задача № 10 В замкнутом технологическом режиме протекает процесс, указанный в варианте задания (табл. 24). Для указанного процесса записать и рассчитать: 1. Математическое выражение для скорости прямой и обратной реакции; 2. Вычислить, используя правило Вант-Гоффа, на сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 50 раз. Температурный коэффициент скорости реакции равен 2,5. 3. Выражение для расчета Кр указанной реакции в общем виде.  Из закона действующих масс известно, что при постоянной температуре скорость химической реакции (V) зависит от природы вещества, выражаемой через константу скорости (k), и концентрации реагирующих веществ, возведенные в степень, равную числу молей веществ в уравнении химической реакции ([A]a). Для газообразных веществ вместо концентраций можно использовать парциальные давления газов (РаА). Если вещества твердые, то их концентрация остается постоянной и принимается равной единице. В кинетическом уравнении концентрация твердых веществ не учитывается. Таким образом, для первой реакции а), которая является гомогенной, закон действующих масс выражается следующими уравнениями: для прямого направления Vпр. = kпр. [O2]·[O3], если концентрации веществ выразить через парциальные давления, то Vпр. = kпр.·РO2 PO3 ; для обратного направления Vобр. = kобр. [O3]·[O2], или Vобр. = kобр.Р(О3) P(O2) . Число молекул реагентов, принимающих участие в простейшей (элементарной) стадии, называется ее молекулярностью (М). Элементарный акт представлен уравнением химической реакции.
Порядок реакции показывает, как природа вещества влияет на зависимость скорости реакции от концентрации (или парциального давления) реагирующих веществ. Порядок реакции (П) определяется суммой величин показателей степеней при значениях концентрации (парциального давления) реагирующих веществ. Порядок рассчитывается с использованием
Ппр.= 1 + 1= 2; Побр. = 1 + 1 = 2 Влияние температуры на скорость химической реакции определяется законом Вант-Гоффа: При повышении температуры на каждые 10 0С скорость гомогенной химической реакции увеличивается в 2-4 раза. Закон Вант-Гоффа выражается соотношением: 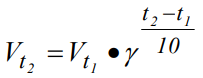 скорость реакции при температуре t1, vt2 скорость реакции при температуре t2, коэффициент Вант-Гоффа, показывающий во сколько раз увеличится скорость реакции при увеличении температуры на 10 градусов. скорость реакции при температуре t1, vt2 скорость реакции при температуре t2, коэффициент Вант-Гоффа, показывающий во сколько раз увеличится скорость реакции при увеличении температуры на 10 градусов.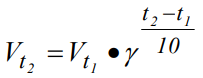 50= 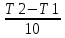 , , 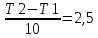 Температуру нужно повысит на 25 градусов. Для гомогенной газовой реакции константу равновесия удобнее выразить через парциальные давления веществ: Vпр. = kпр. [O2]·[O3], если концентрации веществ выразить через парциальные давления, то Vпр. = kпр.·РO2 PO3 ; для обратного направления Vобр. = kобр. [O3]·[O2], или Vобр. = kобр.Р(О3) P(O2) . |
