Конспект урока по теме Неметаллы Цель обобщить и систематизировать знания учащихся о свойствах и применении неметаллов с использованием методов социальных технологий. Задачи
 Скачать 101.5 Kb. Скачать 101.5 Kb.
|
|
План-конспект урока по теме: «Неметаллы» Цель: обобщить и систематизировать знания учащихся о свойствах и применении неметаллов с использованием методов социальных технологий. Задачи: 1. Обобщить и систематизировать знания учащихся о положении неметаллов в периодической системе, строении их атомов, о физических и химических свойствах, о важнейших отраслях их применения. 2. Продолжить развивать умение применять полученные знания на практике при решении расчетных и качественных задач, умение использовать химическую терминологию, умение проводить, наблюдать и описывать химический эксперимент, совершенствовать коммуникативные умения (умение совместно принимать решения, умение отстаивать свою точку зрения и уважать мнение другого человека), совершенствовать навыки устной и письменной речи. 3. Расширить кругозор учащихся, развить познавательный интерес учащихся к предмету. Тип урока: повторение и обобщение знаний. Методы обучения: - словесный (беседа); - наглядный (наблюдение при проведении опытов); - практический (тестирование, выполнение расчетных задач, проведение опытов). Ход урока: I. Организационный момент. (2 мин). Приветствие класса. Проверка готовности учащихся к уроку. II. Знакомство учащихся с планом урока. (2 мин). Учитель. Ребята, сегодня у нас с вами заключительный урок по теме: «Неметаллы». Вы должны будете показать свои знания о неметаллах, умения решать расчетные и качественные задачи. Работать вы будете в группах. Каждой из групп будут даны свои задания, а этапы для всех команд одинаковые. Вот эти этапы: 1) Разминка, 2) Удивительные вещества и элементы, 3) Расчетная задача, 4) Распознавание, 5) Химический кроссворд. Затем мы с вами подведём итоги и выясним, какая же команда больше всех знает о неметаллах. А теперь познакомимся с нашими командами (команды представляют себя). Оценивать вашу работу будут жюри (см. приложение №1). III.Выполнение учащимися заданий обобщающего и систематизирующего характера (29 мин). 1) Учитель. Первое задание - разминка. Предлагаю вам выполнить тест, каждый правильный ответ принесёт вашей команде 1 балл. Время на задание -5 мин. (Тесты команды сдают жюри). Вариант I Выберите правильный ответ. Наиболее ярко выраженные неметаллические свойства проявляет: а) Si, б) C, в) Sn, г)Ge. 2. Химическая связь в молекуле аммиака: а) ионная, б) ковалентная полярная, в) металлическая, г) ковалентная неполярная. 3. Оксид азота (V) может взаимодействовать: a) c H2O, б) H2SO4 , в) NaOH, г) CaO 4. Химическое равновесие в системе: FeO (k) + H2 (г) ↔ Fe (k) + H2O-Q смещается в сторону исходных веществ: а) при повышении давления, б) повышения температуры, в) при понижении давления, г) понижения температуры. 5. Формула вещества, обозначенного Х в схеме превращений веществ: P → X → H3PO4, а) PH3 , б)P2O3, в) P2O5 . 6. Оксид серы (IV) реагирует с обоими веществами пары: а) кислородом и водой, б) оксидами кальция и углерода (IV), в) медью и серной кислотой. 7. Массовая доля азота в азотной кислоте равна: а) 20, б) 22,2 , в) 14,0, г) 76,2. 8. Электронная формула атома фосфора: а) 1s²2s²2p³, б) 1s²2s²2p63s² 3p³, в) 1s²2s²2p5, г) 1s²2s²2p63s² 3p5. 9. Высшая валентность азот проявляет в соединении: а) N2O, б) NO, в) N2O3, г) N2O5. 10. Коэффициент перед формулой окислителя в уравнении реакции, схема которой H2S + O2 → H2O + SO2 равен: а) 1, б)2, в) 3, г) 4. Вариант II Выберите правильный ответ. Электронная формула внешнего энергетического уровня атома Si : а) 3s² 3p² , б) 3s² 3p4, в) 4s² 4p2 ,г) 4s² 4p4 . 2. В ряду химических элементов P → As → Sb → Bi металлические свойства: а) усиливаются, б) не изменяются, в) ослабевают, г) изменяются периодически. 3. При пропускании CO2 через водный раствор карбоната натрия: а) образуется гидроксид натрия, б) выпадает осадок карбоната натрия, в) образуется гидрокарбонат натрия, г) образуется угольная кислота. 4. Валентность азота в соединениях NO2 и NH3 соответственно равна: а) IV и III, б)V и III, в) II и III , г) V и I. 5. Оксид серы (VI) реагирует: а) с водой, б) азотной кислотой, в) кислородом, г) оксидом алюминия, д) гидроксидом калия. 6. Формула вещества с ковалентной неполярной связью: а) HCl, б)F2 , в)Na2O , г) H2S. 7. Химическое равновесие в системе 2SO2 +O2 ↔ 2SO3 + Q смещается в сторону продукта реакции: а) при использовании катализатора, б) повышение температуры, в) понижении давления, г) понижении температуры. 8. Кремниевая кислота образуется при взаимодействии: а) кремния с водой, б) оксида кремния с водой, в) силиката натрия с соляной кислотой, г) оксида кремния со щелочью. 9. Массовая доля серы в серной кислоте равна: а) 14,3, б) 32, в) 32, 6, г) 65,3. 10. Коэффициент перед формулой восстановителя в уравнении реакции магния с азотом равен: а) 1, б) 2, в) 3, г)4. 2) Учитель. Жюри подводит итоги первого задания, а мы с вами переходим к следующему этапу: «Удивительные вещества и элементы». Каждой команде будут задаваться вопросы, правильный ответ оценивается в 1 балл. «УДИВИТЕЛЬНЫЕ ВЕЩЕСТВА И ЭЛЕМЕНТЫ». (БЛИЦ-ВОПРОС) В какой капусте много йода? (В морской). Какой элемент считают «царем живой природы»? (Углерод). Какая кислота входит в состав желудочного сока? (Соляная). Какое вещество составляет основу карандаша? (Графит). Он безжизненным зовется, но жизнь без него не создается. (Азот). О каких веществах можно сказать, что один сверкал в короне царской, а брат его чумазый трубочист? (Об алмазе и аморфном угле). Как называются соли угольной кислоты? ( Карбонаты). Белый воздуха боится, покраснел, чтоб сохраниться. ( Белый и красный фосфор). Используется она в производстве спичек, бумаги, взрывчатых веществ, лекарств, но основной ее потребитель – химическая промышленность. Назовите этот неметалл. (Сера). Назовите сильнейший окислитель. (Фтор). Какова массовая доля кислорода в воздухе? (21%) Какой элемент сыграл роковую роль в жизни Наполеона? ( Мышьяк). Какова формула озона? (О3). Как называется семейство элементов 7 группы главной подгруппы? (Галогены). Этот оксид выдыхают животные и человек? ( Углекислый газ). Это вещество встречается в отбеливателях, чистящих средствах, оно способно возвращать белизну белым тканям, дезинфицирует. ( Хлор). Какой элемент называют «элементом жизни и мысли?» ( Фосфор). Как называется семейство элементов 6 группы главной подгруппы? (Халькогены). Как называются соли серной кислоты? (Сульфаты). В состав зубных паст входит именно этот химический элемент (Фтор). Благодаря какому процессу масса кислорода в воздухе почти не меняется? (Фотосинтезу). Недостаток, какого элемента вызывает заболевание щитовидной железы? (Йода). При недостатке этого элемента в организме наблюдается хрупкость и ломкость костей, и выпадение волос? (Серы). Соединения этого галогена регулируют процессы возбуждения и торможения центральной нервной системы. Что это за галоген? (Бром). Темно- фиолетовые кристаллы этой соли хорошо растворяются в воде, используется в лаборатории для получения кислорода. (KMnO4) 3) Учитель. А какой же любитель химии не умеет решать задачи? Следующий этап: «Расчётная задача». Вам необходимо решить задачи, а уровень, какой вы выберите, зависит от вас, от этого зависит и количество баллов. Время на решение задач- 8 мин. (см. приложение №2). 4) Учитель. Этап «Распознавание». Ребята, вам необходимо выполнить практическое задание, объяснить и составить уравнения химических реакций. Максимальное количество баллов за это задание - 4. Время на подготовку 3 мин. Задание: Распознайте с помощью реактивов растворы следующих веществ: Задание команде №1: Na2CO3 , Na2SiO3 , NaNO3. Задание команде №2: NaCl, Na2SO4, NaNO3. Задание команде №3: Na2CO3, Na2SO4 , NaNO3. Задание команде №4: AlCl3, Na2SO4, NaNO3. Учитель. Проверяем задание каждой команды. ( Команды описывают ход эксперимента и делают выводы.) 5) Учитель: А теперь ребята, давайте немного отдохнем и отгадаем кроссворд. Та команда, которая первая справится, получает 5 баллов, вторая-4 и т.д. Время на выполнение-5 мин. Химический кроссворд 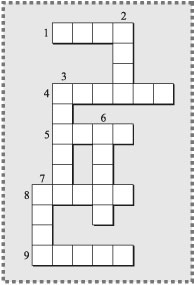 По горизонтали: 1. Жидкость красно-бурого цвета с резким зловонным запахом. 4. Это вставляют в воронку при фильтровании. 5. Неметалл, твердый, желтого цвета. 8. Инертный газ. 9. Металл, названный в честь могучих сыновей богини земли Геи (греческая мифология). По вертикали: 2. Количество вещества. 3. Неметалл красного цвета, применяется в производстве спичек. 6. Инертный газ, в переводе с латинского «блестящий, светящийся». 7. Составная часть воздуха. IV. Проверка выполнения заданий (2 мин). Учитель. Жюри сейчас подводит итоги всех конкурсов. А вам, ребята, я предлагаю оценить работу каждого ученика вашей команды за урок. (Рефлексия). V. Подведение итогов и оценка результатов урока (3 мин). Учитель. Предоставляем слово жюри. (Жюри подводит итоги всех этапов, определяет команду – победитель) Учитель. Ребята, сегодня на уроке вы показали все свои знания, умения решать расчётные и качественные задачи по теме: «Неметаллы». VI. Домашнее задание (2 мин). Подготовиться к контрольной работе по теме: «Неметаллы». Спасибо за урок. Приложение №1 ПРОТОКОЛ
БЛАНК ОТВЕТОВ НА ТЕСТ Команда: Вариант:
БЛАНК ОТВЕТОВ НА ЗАДАЧУ Команда: Уровень: Приложение №2 Этап «Расчетная задача» Вариант I Первый уровень (3 балла). 1. Сколько граммов гидроксида кальция потребуется для нейтрализации 5,6 л хлороводовода? 2.Сколько литров аммиака нужно взять для получения 4,9 г бромида аммония? 3. При взаимодействии 0,1 моль магния с разбавленной серной кислотой получается сульфат магния. Определите его массу. Второй уровень (4 балла). 1. Сколько граммов 10 % раствора гидроксида натрия потребуется для нейтрализации 8,96 л соляной кислоты. 2. Сколько граммов хлорида аммония получится при взаимодействии 8 г хлороводорода с 3г аммиака. Третий уровень (5 баллов). Сколько граммов осадка образуется при пропускании 11,2 л углекислого газа через 900 г 10 % раствора гидроксида бария Ba(OH)2? Вариант II Первый уровень (3 балла). 1. Сколько л углекислого газа получится при сжигании 3,2 г метана CH4? 2. Определите массу серы, вступившей в реакцию с алюминием количеством вещества 3 моль, если образуется сульфид алюминия Al2S3. 3. Определите количество вещества сульфата магния, образовавшегося при взаимодействии 6 г магния с разбавленной серной кислотой. Второй уровень (4 балла). 1. Какой объем раствора с массовой долей серной кислоты 10 % (плотностью 1,07 г/мл) потребуется для нейтрализации раствора, содержащего 16 г гидроксида натрия? 2. Оксид углерода (IV), полученный действием избытка соляной кислоты на карбонат кальция массой 4 г растворили в воде массой 2 кг. Рассчитайте массовую долю оксид углерода (IV) в полученном растворе. Третий уровень (5 баллов). На смесь меди и оксида меди (II) массой 75 г подействовали избытком концентрированной азотной кислоты. При этом выделился газ объемом 26,88 л (н.у.). Определите массовую долю оксида меди (II) в исходной смеси. Вариант III Первый уровень (3 балла). 1. Сколько граммов оксида фосфора(V) образуется при сжигании 3,1 г фосфора. 2. При пропускании углекислого газа через раствор, содержащий 28 г гидроксида калия KOH, получили после выпаривания соль- K2CO3. Определите массу этой соли. 3. Определите массовую долю меди в сульфате меди (II) CuSO4. Второй уровень (4 балла). 1. В лаборатории имеется раствор с массовой долей H2SO4 10 % . Какая масса этого раствора потребуется для растворения 1,8 г магния? 2. Вычислите объем водорода, выделившегося при взаимодействии цинка массой 13 г с раствором, содержащим серную кислоту массой 30 г (н. у.). Третий уровень (5 баллов). К раствору объемом 153,5 мл с массовой долей гидроксида калия 16 % и плотностью 1,14 г/мл прилили раствор объемом 86,8 мл с массовой долей серной кислоты 20 % и плотностью 1,14 г/мл. Определите массу образовавшейся соли - K2SO4. Вариант IV Первый уровень (3 балла). 1. Через раствор, содержащий 30,9 г бромида натрия, пропустили избыток хлора, а выделившееся вещество красно-бурого цвета собрали. Определите массу этого вещества. 2. Какой объем водорода (н. у.) потребуется для полного восстановления 20 г оксида меди (II). 3. Определите массовую долю углерода в карбонате кальция. Второй уровень (4 балла). 1. Какой объем раствора с массовой долей серной кислоты 10 % (плотностью 1,07 г/мл) потребуется для нейтрализации раствора, содержащего 16 г гидроксида натрия? 2. Смешали хлороводород массой 7,3 г с аммиаком массой 4 г. Определите массу образовавшейся соли и оставшегося после реакции газа. Третий уровень (5 баллов). К раствору, содержащему гидроксид кальция массой 1,48 г, прилили раствор массой 150 г с массовой долей карбоната натрия 5 %. Определите массу образовавшегося гидроксида натрия. Приложение№3 Ответы на расчётные задачи: Вариант I Первый уровень: 9, 25 г 1,12 л. 12 г. Второй уровень:1. 160 г. 2. 9,44 г. Третий уровень: 98, 5 г. Вариант II Первый уровень: 4,48 л. 144 г. 0,25 моль. Второй уровень:1.183 мл. 2.0,088 %. Третий уровень: 48,8 %. Вариант III Первый уровень: 7,1 г. 34, 5 г. 40 %. Второй уровень: 1. 73,5 г. 2. 4,48 л Третий уровень: 34, 8 г. Вариант IV Первый уровень: 24 г. 5,6 л 12 %. Второй уровень: 1.183 мл. 2.10,7 г NH4Cl , 0,6 г NH3. Третий уровень: 1,6 г. ПРАВИЛЬНЫЕ ОТВЕТЫ НА ТЕСТ: ВАРИАНТ №1
Вариант№2
ОТВЕТЫ НА КРОССВОРД: По горизонтали: 1. Бром. 4. Фильтр. 5. Сера. 8. Аргон. 9. Титан. По вертикали: 2. Моль. 3. Фосфор. 6. Радон. 7. Азот. |

 этап
этап 