КИМ- химия. Контрольно ИМ. Контрольная работа 1 Первоначальные химические понятия вариант i определите валентность химических элементов по формулам соединений
 Скачать 0.51 Mb. Скачать 0.51 Mb.
|
|
Контрольно-измерительные материалы по химии для 8 классов Контрольная работа №1 «Первоначальные химические понятия» вариант I 1. Определите валентность химических элементов по формулам соединений: BaBr2, NaH, N2O, P2O5. 2. Составить формулы соединений, в состав которых входят следующие элементы: водород и селен; углерод и кислород; кальций и азот. 3. Расставьте коэффициенты в уравнении химических реакций: Fe + F2 → FeF3 Zn + HCl → ZnCl2 + H2↑ Для последнего уравнения рассчитать массу цинка необходимую для получения 6 г водорода. 4. Допишите уравнение реакции: Rb + O2 → ? H2 + Cl2 → ? 5. Вычислить массу 6 моль сероводорода H2S. Сколько молекул H2S содержится в этом количестве вещества? Сколько атомов водорода и серы содержится в этом же количестве? Чему равна массовая доля серы в H2S. вариант II 1. Определите валентность химических элементов по формулам соединений: FeBr2, CH4, N2O3, SO3. 2. Составить формулы соединений, в состав которых входят следующие элементы: водород и кальций; железо (II) и кислород; натрий и азот. 3. Расставьте коэффициенты в уравнении химических реакций: Li + O2 → Li2O Al + HCl → AlCl3 + H2↑ Для последнего уравнения рассчитать массу алюминия, израсходованную на получение 1 г водорода. 4. Допишите уравнение реакции: Mg + O2 → ? Ba + S → ? 5. Вычислите массу 7 моль дисульфида железа FeS2. Сколько молекул в FeS2 содержится в этом количестве вещества? Сколько атомов железа и серы содержится в этом же количестве? Чему равна массовая доля железа в дисульфиде железа? Контрольная работа № 2 по темам «Кислород», «Водород», «Вода. Растворы» Вариант № 1 1. Напиши схему применения кислорода 2. 2.Выпишите из каждой строчки физические свойства, которые принадлежат водороду. Ответ запишите в виде цифр и букв. при обычных условиях 1) а) жидкий, б) газообразный; 2) а) белый, б)голубой, в)бесцветный; 3) а) с резким запахом, б) удушливый, в)без запаха; 4) а)хорошо растворим в воде, б)почти не растворяется в воде; 5) а)тяжелее воздуха, б)легче воздуха. 6) а)сложное вещество; б)простое вещество; 7) входит в состав гремучего газа; 8) образуется в результате фотосинтеза; 9) поддерживает горение, 10) является составной частью Солнца; 11) без примеси горит спокойно; 12) плотность при 40С равна 1г/см3 13) обладает высокой электропроводностью 3. 3.В промышленности кислород можно получить из: а) перекиси водорода б) воздуха в) перманганата калия г) соли 4.Вещество, являющееся оксидом: А) Н2SO4 Б) H2O В) HCl Г) NaOH 5. Решите задачу. Сколько граммов поваренной соли и воды нужно взять для приготовления 120 г 20% раствора. 6.Сложные вещества, которые состоят из двух элементов, один из которых кислород, называются ______________, при этом кислород имеет валентность ________________ . 7.Однородные системы, состоящие из двух и более веществ называются _______. 8.Составьте уравнение горения магния в кислороде 9.Как называется данный прибор.  10.Напишите уравнение данной реакции 10.Напишите уравнение данной реакции 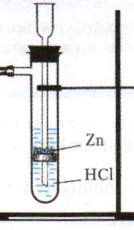 11.Для горения вещества необходим доступ____________ 12.Раствор, в котором данное вещество при данной температуре ещё может растворяться, называют __________. 13 Закончите уравнения реакций, расставьте коэффициенты, назовите получившиеся вещества. а) P + O2 → б) Zn + O2 → в) Н2 + CI2 → г) H2 + O2 14 **. Закончите уравнения реакций: A) Na + H2O = ? + H2 B) ? + O2 = MgO C) FeO + ? = Fe + H2O D) H2O = ? + ? E) C + ? = CO2 Вариант № 2 1.Напиши схему применения водорода 2.Выпишите из каждой строчки физические свойства, которые принадлежат кислороду. Ответ запишите в виде цифр и букв. при обычных условиях 1): а) жидкий, б) газообразный; 2) а) белый, б)голубой, в)бесцветный; 3) а) с резким запахом, б) удушливый, в)без запаха; 4) а)хорошо растворим в воде, б)почти не растворяется в воде; 5) а)тяжелее воздуха, б)легче воздуха. 6) а)сложное вещество; б)простое вещество; 7) входит в состав гремучего газа; 8) образуется в результате фотосинтеза; 9) поддерживает горение, 10) является составной частью Солнца; 11) без примеси горит спокойно; 12) плотность при 40С равна 1г/см3 13) обладает высокой электропроводностью 3.Кислород в лаборатории получают: 1) из воздуха 2) разложением перекиси водорода; 3) из мела 4) разложением углекислого 4.Вещество, не являющееся оксидом имеет химическую формулу: А) CO2 Б) H2O В) Al2O3 Г) Н2SO4 5. Решите задачу. Сколько граммов поваренной соли и воды нужно взять для приготовления 370 г 10% раствора. 6Сложное вещество, которое состоит из двух элементов, кислорода и водорода _______________, назвать основные физические свойства. 7.Раствор, в котором мало растворенного вещества называют __________. 8.Составьте уравнение горения угля в кислороде 9.Как называется данный прибор? 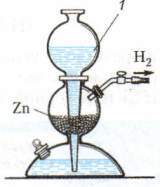 10.Напишите уравнение данной реакции 10.Напишите уравнение данной реакции 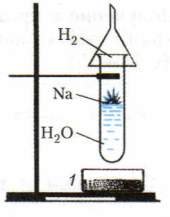 11. Смеси, в которых мелкие капельки какой-либо жидкости равномерно распределены между молекулами другой жидкости, называют ___________. 12.Для горения вещества необходим доступ____________ 13 Закончите уравнения реакций, расставьте коэффициенты, назовите получившиеся вещества. а)C + O2 → б) Zn + O2 → в) Н2 + FeО → г) H2 + O2 = 14 **. Закончите уравнения реакций: A) Na + H2O = ? + H2 B) ? + O2 = MgO C) FeO + ? = Fe + H2O D) H2O = ? + ? E) C + ? = CO2 Контрольная работа №3 Основные классы неорганических соединений. Вариант №1 Тест К кислотам относится каждое из 2-х веществ: а) H2S и Na2CO3 б) K2SO4 и Na2SO4 в) H3PO4 и HNO3 г) KOH и HCl Гидроксиду меди (II) соответствует формула: а) Cu2O б) Cu(OH)2 в) CuOH г) CuO Формула сульфида натрия: а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3 Среди перечисленных веществ кислой солью является а) гидрид магния б) гидрокарбонат натрия в) гидроксид кальция г) гидроксохлорид меди Какой из элементов образует кислотный оксид? а) стронций б) сера в) кальций г) магний К основным оксидам относится: а) Н2O б) SiO2 в) BaO г) СО2 Установите соответствие между формулой исходных веществ и продуктами реакций , уравнять уравнения
Назовите следующие соединения: Сu(OH)2 _________________________________________ Na2O _______________________________________ H2SO4 ________________________________________ Осуществите цепочку следующих превращений: а) Zn → ZnO→ Zn SO4→ Zn(OH)2 → ZnO Какая масса сульфата магния образуется при взаимодействии 49 г серной кислоты с оксида магния? Вариант №21.К основаниям относится каждое из 2-х веществ: а) H2O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, NaCl Оксиду меди (II) соответствует формула: а) Cu2O б) Cu(OH)2 в) CuOH г) CuO Формула сульфита натрия: а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3 Среди перечисленных веществ кислой солью является а) гидроксид бария б) гидроксокарбонат калия в) гидрокарбонат меди г) гидрид кальция; Какой из элементов может образовать амфотерный оксид? а) натрий б) сера в) фосфор г) алюминий К основным оксидам относится: а) MgO б) SO2 в) B2O3 г) SО3 Установите соответствие между формулой исходных веществ и продуктами реакций, уравнять уравнения
Осуществите цепочку следующих превращений: а) Mg → MgO→MgCl2→Mg(OH)2 → MgO Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты? Контрольная работа №4Периодический закон и периодическая система химических элементов. Строение атома. Вариант №1При выполнении заданий А1-А9 выберите один правильный ответ. А1. Каков физический смысл порядкового номера химического элемента? А. это число нейтронов в атоме Б. это относительная атомная масса В. это число энергетических уровней в атоме Г. это число протонов в ядре А2. В малом периоде находится: А. кальций Б. золото В. Хлор Г. железо А3. В ряду Na →K → Rb металлические свойства: А. уменьшаются Б. увеличиваются В. не изменяются Г. сначала увеличиваются, а затем уменьшаются А4. Заряд ядра и нуклонное число атома Mg равны соответственно: А. +12 и 24 Б. +3 и 24 В. +24 и 12 Г. +12 и 20 А5. Атом фосфора имеет следующее распределение электронов по энергетическим уровням: А. 1е,8е,5е Б. 2е,6е,5е В. 2е,8е,3е Г. 2е,8е,5е А6. Сферическую форму имеют орбитали: А. s- элекронов Б. d- элекронов В. p- элекронов Г. f- элекронов А7. Химический элемент, который имеет 14 электронов это: А. Азот Б. Кремний В. Алюминий В. Кислород А8. В подгруппе А II находится химический элемент: А. Li Б. Be В. Zn А9. Заряд ядра атома рассчитал: А. Н. Бор Б. Э. Резерфорд В. Г. Мозли При выполнении заданий А10-А12 выберите несколько правильных ответов. А10. Установите соответствие электронная формула частицы химический элемент А. 1s2 1. Углерод Б. 1s2 2s22p6 2. Азот В. 1s2 2s22p3 3. Гелий Г. 1s2 2s2 4. Неон А11. Установите соответствие Неорганическое вещество Химическое соединение А. Соль 1. N2O5 Б. Кислотный оксид 2. CaCl2 В. Основный оксид 3. ZnО Г. Амфотерный оксид 4. ВаO А12. Установите соответствие Химический элемент Количество энергетических уровней А. Фтор 1. Один Б. Сера 2. Два В. Водород 3. Три Г. Калий 4. Четыре При выполнении заданий В1 и В2 подробно запишите ход его решений и полученный Результат Часть 2 В1. Дать характеристику химическому элементу №6 по плану. В2. Дать определение терминам: химический элемент, период, изотопы, дать формулировку периодического закона (Менделеевская). Вариант №2При выполнении заданий А1-А9 выберите один правильный ответ. А1. Каков физический смысл порядкового номера химического элемента? А. это число энергетических уровней Б. это заряд атома В. это относительная атомная масса Г. это число нейтронов в ядре А2. В большом периоде находится: А. кальций Б. натрий В. Хлор Г. Азот А3. В ряду С → N→ O металлические свойства: А. уменьшаются Б. увеличиваются В. не изменяются Г. сначала увеличиваются, а затем уменьшаются А4. Заряд ядра и массовое число атома Br равны соответственно: А. +12 и 80 Б. +35 и 80 В. +35 и 12 Г . +12 и 35 А5. Атом алюминия имеет следующее распределение электронов по энергетическим уровням: А. 1е,8е,5е Б. 2е,6е,5е В. 2е,8е,3е Г. 2е,8е,5е А6. Гантелеобразную форму имеют орбитали: А. s- элекронов Б. d- элекронов В. p- элекронов Г. f- элекронов А7. Химический элемент, который имеет 12 электронов это: А. Углерод Б. Магний В. Алюминий В. Кремний А8. В подгруппе IIБ находится химический элемент: А. Li Б. Be В. Zn А9. Ядерную модель атома предложил: А. Н. Бор Б. Э. Резерфорд В. Г. Мозли При выполнении заданий А10-А12 выберите несколько правильных ответов. А10. Установите соответствие электронная формула частицы химический элемент А. 1s22s22p1 1. Фтор Б. 1s2 2s22p63s23p6 2. Бор В. 1s2 2s22p5 3. Аргон Г. 1s2 2s22p2 4. Углерод А11. Установите соответствие Неорганическое вещество Химическое соединение А. Соль 1. SO3 Б. Кислотный оксид 2. ВаCl2 В. Основный оксид 3. AI2О3 Г. Амфотерный оксид 4. CаO А12. Установите соответствие Химический элемент Количество энергетических уровней А. Азот 1. Один Б. Фосфор 2. Два В. Гелий 3. Три Г. Кальций 4. Четыре Контрольно-измерительные материалы по химии для 9 классов К  онтрольная работа по темам «Классификация химических реакций» и «Электролитическая диссоциация» онтрольная работа по темам «Классификация химических реакций» и «Электролитическая диссоциация»В а р и а н т I Объясните на основе знаний об электролитической диссоциации, почему растворы кислот имеют общие свойства. Допишите уравнения практически осуществимых хими-ческих реакций и рассмотрите их в свете представлений об окислительно-восстановительных процессах и электролитической диссоциации. Zn + H2SO4 Cu + HCl Na2SO4 + BaCl2 Даны вещества: хлорид железа(III), бромид натрия, бромоводород, карбонат кальция, оксид серы(VI). К каждому из них добавили гидроксид натрия. В каких случаях произойдут химические реакции? Каковы их признаки? Запишите уравнения этих химических реакций в полной и сокращённой ионной форме. Приведите два примера реакций ионного обмена, суть которых может быть выражена одним и тем же сокращённым ионным уравнением реакции Pb2+ + 2OH– = Pb(OH)2 Приведите два примера реакций соединения, одна из которых относится к окислительно-восстановительным реакциям, а другая не относится. Составьте термохимическое уравнение реакции горения метана в кислороде, если при сжигании 21 л метана (н. у.) выделилось 837 кДж теплоты. В а р и а н т II Объясните на основе знаний об электролитической диссоциации, почему растворы щелочей имеют общие свойства. Допишите уравнения практически осуществимых хими-ческих реакций и рассмотрите их в свете представлений об окислительно-восстановительных процессах и электролитической диссоциации. K2CO3 + HNO3 Mg + FeSO4 Na2CO3 + Cu Даны вещества: сульфат натрия, оксид меди(II), карбо-нат калия, гидроксид калия. К каждому из них добавили разбавленную серную кислоту. В каких случаях произойдут химические реакции? Каковы их признаки? Запишите уравнения этих химических реакций в полной и сокращённой ионной форме. Приведите два примера реакций ионного обмена, суть которых может быть выражена одним и тем же сокращённым ионным уравнением реакции CO32– + 2H = H2 O + CO2+ Приведите два примера реакций разложения, одна из которых относится к окислительно-восстановительным реакциям, а другая не относится. Используя термохимическое уравнение CaCO3(тв) + CO2(г) – 177,65 кДж, рассчитайте количество теплоты, которая потребуется для разложения 50 кг карбоната кальция. Контрольная работа «Кислород и сера». Вариант I А-1. Символ элемента, образующего простое вещество — неметалл: 1. Сu. 2. Мg. 3. Fе. 4. N. А-2. Положительную степень окисления фосфор не проявляет в соединении 1) Р205 2) РС15 3) НЗР 4) Р20з А-3. Кислотные свойства высших оксидов химических элементов VА-группы периодической таблицы Д. И. Менделеева в ряду N205 → Р205→ Аs2О5→ Sb205 1) усиливаются 2) ослабевают 3) не изменяются 4) сначала усиливаются, затем ослабевают А-4. Аммиак не вступает в химическую реакцию с кислородом 3) с соляной кислотой с водородом 4) с водой А-5. Соединения серы с металлами называют сульфатами 3) сульфидами сульфитами 4) сернистыми металлами А-6. В результате окисления аммиака в присутствии катализатора образуются оксид азота(II) и вода 3) азот и вода оксид азота(IV) и вода 4) оксид азота(II) и водород А-7. Сокращенному ионному уравнению СO2 + 2OН- = Н2О + CO3 -2 соответствует химическая реакция между соляной кислотой и карбонатом кальция между гидроксидом натрия и оксидом углерода(IV) между кремниевой кислотой и карбонатом калия между карбонатом натрия и оксидом кремния(IV) А-8. Из приведенных уравнений химических реакций реакцией ионного обмена не является 2NH4 OH + СO2 = (NН4)2СО3 + Н2О 2)(NН4)2СОЗ = 2NНз + СO 2 + Н2О 3) NH4 OH + НNОз = NН4NОз + Н2О 4) 2NH4 OH + CuCl2 = 2NH4Cl + Сu (ОН)2 B-l. Установите соответствие между исходными (исходным) и полученными веществами в уравнениях химических реакций, характеризующих свойства ортофосфорной кислоты. 1)НзРО4 + Са→ А) Р205 + Н2О 2)НЗРО4 + Са(ОН)2→ Б) Саз(Р04)2 + HCl 3) НЗРО4 + CaC12 → В) Р + Н2О 4) НзРО4 + СаО→ Г) Саз(Р04)2 + Н2 Д) Саз(Р04)2 + Н2О В-2. Установите соответствие между реактивом и группой веществ, которые можно обнаружить с помощью этого реактива. растворимые соли бария растворимые соли серебра 3)летучие кислоты (соляная, азотная, уксусная) 4) растворимые соли меди А) карбонаты Б) сероводородная кислота и растворимые в воде сульфиды В) галогеноводородные кислоты и их соли, кроме фтористоводородной кислоты Г) соли железа в степенях окисления +2 и +3 или соли свинца Д) серная кислота и ее соли - сульфаты В-3. Установите соответствие между схемой перехода электронов в химической реакции и примером, иллюстрирующим ее. 1)N0 →N+2 2)N-3→ N+2 3)N+5→ N+2 4)N+5→ N+4 А) НNОз + Сu→ Cu(NОЗ)2 + NO + Н2О Б) NO + О2→ NО2 В) N2 + О2 → NO Г) NНз + О2→ NO + Н2О Д) НNОз + Сu→ Cu(NОЗ)2 + NО2 + Н2О В-4. Концентрированная серная кислота является окислителем в химических реакциях Сu + H2SO4→ CuSO4 + Н2О + SO2 СuО + H2SO4→ CuS04 + Н2О NaCl + H2SO4 → Na2S04 + HCl С + H2S04→ СО2 + Н2О + S02 C12H22011 + H2S04 →СО2 + Н2О + S02 Ответ: __ В-5. Напишите полные и сокращенные ионные уравнения химических реакций, в которых оксид cеры(IV) будет взаимодействовать с гидроксидом лития, гидроксидом железа(III), оксидом кальция, водой, хлоридом меди(П). Ответ: _______________________________________________________ C-l. Какая из приведенных схем показывает, что азот может быть восстановителем? Ответ поясните соответствующими уравнениями химических реакций. 1)N0+3е→ N-3 2) N-3 – 5е→N+2 С-2. Напишите в приведенной схеме над стрелками формулы веществ, с помощью которых можно осуществить указанные превращения, составить уравнения реакций, расставить коэффициенты. Са→ Са(ОН)2→ Са(NОз)2→ СаO Вариант II А-1. . Символ элемента, образующего простое вещество — неметалл: 1. Са. 2. Сu. 3. С. 4. Zп. А-2. Положительную степень окисления азот не проявляет в соединении 1) N20 2) NO 3) N02 4) СазN2 А-3. В ряду Si02→ Р205→SОЗ→ Cl207 с увеличением относительной молекулярной массы оксидов усиливаются основные свойства веществ усиливаются кислотные свойства веществ усиливаются амфотерные свойства веществ 4) свойства веществ практически не изменяются А-4. Сера не вступает в химическую реакцию 1) с водородом 2) с кислородом 3) с металлами 4) с водой А-5. Соединения азота с металлами называют 1) нитратами 2) нитритами 3) нитридами 4) азотистыми металлами А-6. В результате сгорания метана образуются углекислый газ и водород 3) углекислый газ и вода углерод (сажа) и вода 4) угарный газ и вода А- 7. Сокращенному ионному уравнению PO4-3+ 3Ag + = AgЗРО4 соответствует химическая реакция между фосфатом натрия и хлоридом серебра между фосфатом натрия и нитратом серебра между фосфатом натрия и оксидом серебра между фосфатом натрия и серебром А-8. Из приведенных уравнений химических реакций реакцией обмена является (NН4)2СОЗ = 2NНз + С02 + Н2О НзР04 + 3NaOH = NаЗРО4 + ЗН2О Сu + 4НNОз = Cu(NОЗ)2 + 2N02 + 2Н2О 4Р + 502 = 2P205 B-l. Установите соответствие между исходными и полученными веществами в уравнениях химических реакций, характеризующих свойства аммиака. NНз + H20 → NНз + H2S04 → NНз + 02(недостаток) → 4) NНз + 02(избыток) → А) N2 + Н2О Б) N02 + Н2О В) NH4HS04 + Н2О Г) NO + Н2О Д) NH4 ОH В-2. Установите соответствие между ионом и способом его обнаружения в растворах. I- 2)S04-2 3) NОз- 4) NH4+ А) при добавлении щелочи образуется газ с характерным запахом Б) при добавлении нитрата серебра образуется желтый творожистый осадок, нерастворимый в азотной кислоте В) при нагревании с медью и концентрированной серной кислотой образуется голубой раствор и выделяется бурый газ Г) при добавлении нитрата бария образуется мелкокристаллический осадок, нерастворимый в азотной кислоте В-3. Установите соответствие между схемой перехода электронов в химической реакции и примером, иллюстрирующем ее. S 0→ S-2 2)S -2→ S+4 3)S +4→ S0 4)S +4→ S+6 А) S02 + H2S→ S + Н2О Б) S + 02→ S02 В) S + Н2 → H2S Г) H2S + 02 → S02 + Н2О Д) S02 +02→SОз В-4. Сероводород проявляет свойства восстановителя в химических реакциях 1) H2S + 02→S + Н2О 2) H2S + NaOH→ Na2S + Н2О 3) H2S + S02 → S + Н2О 4)H2S + РЬ(NОЗ)2 →PbS + НNОз 5)H2S + 02→ S02 + Н2О Ответ: _________ В-5. Напишите полные и сокращенные ионные уравнения химичecкиx реакций в тех случаях, где возможно взаимодействие между следующими парами веществ: SiО2 + О2 → (NН4)2СОЗ + НNОз → SiО2 + Н2О → Са(ОН)2 + СО2 → SiО2 + НСI→ Ответ: ___________________________________ С-l. Какая из приведенных схем показывает, что азот может быть восстановителем? Ответ поясните соответствующими уравнениями химических реакций. N+5 + е→ N+4 2)N0 - 2е → N+2 С-2. Напишите в приведенной схеме над стрелками формулы веществ, или условия, с помощью которых можно осуществить указанные превращения. Составить уравнения реакций, расставить коэффициенты. КNОз→О2→ Р2О5→ Саз(Р04)2 Контрольная работа «Металлы и их соединения». Вариант №1 Часть А. Выполните тестовые задания. А 1. Электронная формула атома железа: 1) 1s2 2s2 2) 1s2 2s2 2p6 3s1 3) 1s2 2s2 2p6 3s2 3p6 3d 6 4s2 4) 1s2 2s2 2p6 3s2 А 2. Простое вещество с наиболее ярко выраженными металлическими свойствами: 1) литий 2) железо 3) рубидий 4) алюминий А 3. Наиболее энергично взаимодействует с водой металл: 1) натрий 2) кальций 3) литий 4) калий А 4. С разбавленной серной кислотой не взаимодействует: 1) железо 2) медь 3) магний 4) цинк А 5. Тип химической связи в простом веществе натрия: 1) ионная 2) металлическая 3) ковалентная полярная 4) ковалентная неполярная А6. Оксид алюминия НЕ взаимодействует с 1) NaOH 2) HCI 3) SO3 4) H2O A7. И натрий, и магний при взаимодействии с галогенами образуют 1) нерастворимые основания 2) щелочи 3) оксиды 4) соли А 8. Верны ли следующие суждения о щелочных металлах? А. Во всех соединениях щелочные металлы имеют степень окисления + 1. Б. Щелочные металлы хранят под слоем керосина, либо вазелина 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения не верны Часть В. В1. Заполните таблицу:
В 2. Установите соответствие между исходными веществами и продуктами реакции Исходные вещества Продукты реакции А) NaOH + SO2 1) Na [Al (OH)4 ] Б) Al2O3 + NaOH (тв) 2) Ca(OH)2 + H2 В) Al(OH)3 + NaOH (р-р) 3) Na2SO3 + H2O Г) Ca + H2O 4) NaAlO2 + H2O 5) Na2SO4 + H2O Ответ:
Часть С. Дайте развернутый ответ на вопрос. С1. Осуществите цепочку превращений и назовите продукты реакций: 1 2 3 4 Вa(OH)2 ← Вa → ВaO → Вa (OH)2 → ВaSO4 Для четвертого превращения составьте молекулярное и ионное уравнения реакции. С2. Решите задачу. 12 г смеси, состоящей из порошка алюминия и меди обработали избытком соляной кислоты, при этом выделилось 7,4 л водорода . Вычислите массовую долю (процентах) каждого металла в смеси. Вариант №2 Часть А. Выполните тестовые задания. А 1. Электронная формула атома алюминия: 1) 1s2 2s2 2) 1s2 2s2 2p1 3) 1s2 2s2 2p6 3s1 4) 1s2 2s2 2p6 3s2 3p1 А 2. Простое вещество с наиболее ярко выраженными металлическими свойствами: 1) железо 2) литий 3) калий 4) алюминий А 3. Менее энергично реагирует с водой: 1) калий 2) натрий 3) цезий 4) литий А 4. С концентрированной серной кислотой не взаимодействует металл (то есть пассивируется): 1) медь 2) железо 3) магний 4) цинк А 5. При взаимодействии щелочных металлов с неметаллами 7 группы (А) образуются вещества с типом химической связи: 1) ионной 2) металлической 3) ковалентной полярной 4) ковалентной неполярной А6. И магний, и кальций при взаимодействии с кислородом образуют 1) нерастворимые основания 2) щелочи 3) оксиды 4) средние соли 7. Оксид алюминия взаимодействует с 1) Cu(OH)2 2) SO3 3) H2O 4) Na2SO4 А 8. Верны ли следующие суждения об алюминии? А. Во всех соединениях алюминий имеет степень окисления + 2. Б. Оксид и гидроксид алюминия проявляют амфотерные свойства. 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения не верны Часть В. В1. Заполните таблицу:
В2. Установите соответствие между исходными веществами и продуктами реакции Исходные вещества Продукты реакции А) NaOH + CO2 1) Na [Al (OH)4 ] Б) BaO + SO3 2) KOH + H2 В) Al(OH)3 + NaOH 3) BaSO4 + H2O Г) K + H2O 4) Na2CO3 + H2O 5) BaSO4 Часть С. Дайте развернутый ответ на вопрос. C1. Осуществите цепочку превращений и назовите продукты реакций: 1 2 3 4 Al → Al 2O3 → AlCl3 → Al(OН)3 → Al 2O3 Для третьего превращения составьте молекулярное и ионные уравнения реакции. С2. Решите задачу. 6 г смеси, состоящей из порошка алюминия и меди обработали избытком соляной кислоты, при этом выделилось 3,7 л водорода . Вычислите массовую долю (процентах) каждого металла в смеси. Контрольная работа по теме «Органические соединения» В а р и а н т I А-1. Общая формула одноатомных предельных спиртов 1) CnH2n 2) CnH2n + 2 3) CnH2n – 2 4) CnH2n + 1OH А-2. Ряд, в котором находятся формулы только карбоновых кислот, — это C2H4, C2H5OH, C2H5COOH C2H5COOH, C3H7COOH, CH3COOH C2H5OH, CH3COOH, C2H5COOH 4) CH3COOH, C2H5OH, C3H7OH А-3. Гомологи — это 1) этан и этилен 2)метан и ацетилен пропан и пропанол 4)муравьиная кислота и уксусная кислота А-4. Сжигание природного газа при недостатке воздуха приводит к образованию ядовитого газа 1) CO2 2) CO 3) H2O 4) N2 А-5. Реактивом на ацетилен является Br2 (р-р) 3) иод соляная кислота 4) гидроксид меди(II) А-6. Впишите нужную формулу органического вещества в схему химической реакции … + Mg (CH3COO)2Mg + H2 CH3OH 3) CH3CH2COOH CH3COOH 4) CH3CH2OH А-7. Полиэтилен получают полимеризацией этилена. В этой реакции этилен — мономер, а полиэтилен — полимер этилен — полимер, а полиэтилен — мономер этилен и полиэтилен — полимеры этилен и полиэтилен — мономеры В-1. Укажите, какие из представленных формул веществ выражают состав гомологов.  В-2. Установите соответствие между названием органического вещества и классом органических соединений, к которому оно принадлежит. этан А. спирты метанол Б. углеводы глюкоза В. аминокислоты глицин Г. алканы В-3. Вставьте в схемы химических реакций недостающие формулы веществ. … + … HCOONa + H2O 2)… + … (HCOO)2Mg + H2 … + … HCOOCH3 + H2O 4)… + … CH3COOC2H5 + H2O C-1. При гидрировании этилена объёмом 22 л получено 20 л этана (н. у.). Рассчитайте объёмную долю выхода этана. В а р и а н т II А-1. Общая формула одноосновных предельных карбоновых кислот CnH2n 3) CnH2n – 2 CnH2n + 1 4) CnH2n + 1COOH А-2. Ряд, в котором находятся формулы только карбоновых кислот, — это 1) C2H4, C2H5OH, C2H2 C2H5OH, C3H7OH, CH3OH C2H5OH, CH3OH, C2H6 CH3COOH, C2H5СОOH, C3H7СОOH А-3. Гомологи — это этан и этилен 3) метанол и пропанол метан и ацетилен 4) этилен и этанол А-4. Реактивом на крахмал является Br2(р-р) 3) иод раствор перманганата калия 4) гидроксид калия А-5. Впишите нужную формулу органического вещества в схему химической реакции … + Na C2H5ONa + H2 1) CH3OH 2) C2H6O 3) C2H5OH 4) C3H7OH А-6. При горении метанола образуются СО и Н2 3) СО2 и Н2 СО2 и Н2О 4) СО и Н2О А-7. Реакции полимеризации соответствует уравнение C   H2 CH2 + H2 CH3 CH3 H2 CH2 + H2 CH3 CH3 CH3 CH3 + Cl2 CH3 CH2Cl + HCl C   H2 CH2 + HCl CH3 CH2Cl H2 CH2 + HCl CH3 CH2Cl 4) nCH2 CH2 ( CH2 CH2 )n В 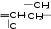 -1. Укажите, какие из представленных формул веществ выражают состав гомологов. -1. Укажите, какие из представленных формул веществ выражают состав гомологов.H  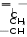 2C CH2 5) H2C CH3 2C CH2 5) H2C CH3H2C CH CH3 6) H2C CH3 CH3 H  2C= CH3 2C= CH3H3CCH CH Ответ: гомологи . В-2. Установите соответствие между названием органического вещества и классом органических соединений, к которому оно принадлежит. уксусная кислота А. сложные эфиры этилацетат Б. углеводы крахмал В. аминокислоты глицин Г. карбоновые кислоты В-3. Вставьте в схемы химических реакций недостающие формулы веществ. … + … CH3COONa + H2O … + … (CH3COO)2Ca + H2 … + … CH3COOCH3 + H2O … + … HCOOC2H5 + H2O C-1. Вычислите объёмы (н. у.) кислорода и воздуха, которые потребуются для полного сжигания 1 м3 природного газа, содержащего 5 % этилена. |
