Контрольная работа по химии 1 курс. Контрольная 1 ТулГУ. Контрольная работа 1 по дисциплине Химия Семестр 1 Вариант 69 Проверил Тула
 Скачать 44.44 Kb. Скачать 44.44 Kb.
|
|
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего образования «Тульский государственный университет» Интернет-институт КОНТРОЛЬНАЯ РАБОТА №1 по дисциплине «Химия» Семестр 1 Вариант 69 Выполнил: Проверил: Тула 7. Вычислите количество вещества эквивалента и молярную массу эквивалента Н3РО4 в реакциях образования: а) гидроортофосфата; б) дигидроортофосфата; в) ортофосфата, если масса ортофосфорной кислоты во всех реакциях 12,38 г. Решение: а) H3PO4 + 2КOH → К2HPO4+2H2O fэкв. = 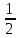 Молярная масса эквивалента: Mэкв.(H3PO4) = 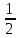 × 98 = 49 (г/моль) × 98 = 49 (г/моль)Количество вещества эквивалента: nэкв (H3PO4) = m/ Mэкв.(H3PO4) = 0,253(моль) б) H3PO4 + КOH → КH2PO4+H2O fэкв. = 1 Mэкв.(H3PO4) = 1 × 98 = 98 (г/моль) nэкв (H3PO4) = 0,126(моль) в) H3PO4 + 3КOH → К3PO4+3H2O fэкв. = 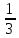 Mэкв.(H3PO4) = 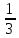 ×98 = 32,67 (г/моль) ×98 = 32,67 (г/моль)nэкв (H3PO4) = 0,379 (моль) Ответ: а) 49 г/моль 0,253 моль; б) 98 г/моль, 0,126 моль; в) 32,67 г/моль, 0,379 моль. 22. При сгорании металла массой 3 г образуется его оксид массой 5,67 г. Степень окисления металла в оксиде равна +3. Что это за металл?
Ответ: M(Me) = 27 г/моль у алюминия. 34. Напишите электронные формулы атомов элементов с порядковыми номерами 16 и 26. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? Решение: Сера относится к p-элементам 16S 1s2 2s2 2p6 3s2 3p4
Железо относится к d-элементам. 26Fe 1s2 2s2 2p6 3s2 3p6 4s2 3d6
81. Какую низшую и высшую степени окисления проявляют кремний, мышьяк, селен и хлор? Почему? Составьте формулы соединений данных элементов, отвечающих этим степеням окисления. Решение: Низшая степень окисления кремния мышьяка, селена и хлора равна соответственно -4, -5, -6 и -7. Формулы соединений данных элементов, отвечающих этим степеням окисления: H4Si, H3As, H2Se, HCl. Электронная конфигурация кремния в основном состоянии: 14Si 1s2 2s2 2p6 3s2 3p2
Кремнию, для завершения внешнего энергетического уровня, не хватает четырёх электронов, поэтому его низшая степень окисления равна -4. Соединения в низшей степени окисления: силан SiH4, силицид кальция CaSi2, силицид алюминия Al4Si3. Высшую степень окисления элемента определяет, как правило, номер группы периодической системы Д. И. Менделеева, в которой он находится. Кремний находится IVА- группах и имеют структуру внешнего энергетического уровня 3s2 3p2. Таким образом, высшая степень окисления кремния +4. Типичные соединения: оксид кремния (IV) SiO2, кремниевая кислота H2SiO3, силикаты MeSiO3, карбид кремния SiC. Электронная конфигурация мышьяка в основном состоянии:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p3 Мышьяку, для завершения внешнего энергетического уровня, не хватает трёх электронов, поэтому его низшая степень окисления равна -3. Соединения в низшей степени окисления: арсенид водорода (арсин) AsH3, арсенид тринатрия Na3As. Мышьяк находится в, VА-группе и имеет структуру внешнего энергетического уровня 4s24p3. Высшая степень окисления мышьяка, соответственно, +5. Соединения в высшей степени окисления: мышьяковая кислота Н3AsO4, сульфид мышьяка (V) As2S5. Электронная конфигурация селена в основном состоянии:
34Se 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4 Селену, для завершения внешнего энергетического уровня, не хватает двух электронов, поэтому его низшая степень окисления равна -2. Соединения в низшей степени окисления: cеленоводоро́д (селан) SeH2, cеленид магния MgSe, cеленид алюминия Al2Se3. Селен находится в VIа-группе и имеет структуру внешнего энергетического уровня соответственно 4s24p4. Таким образом, высшая степень окисления селена равна +6. Соединения в высшей степени окисления: селеновая кислота H2SeO4 оксид селена (VI) SeO3. Электронная конфигурация селена в основном состоянии:
17Cl 1s2 2s2 2p6 3s2 3p5 Хлору, для завершения внешнего энергетического уровня, не хватает одного электрона, поэтому его низшая степень окисления равна -1. Соединения в низшей степени окисления: хлороводород (соляная кислота) HCl, натрия хлорид NaCl, бария хлорид BaCl2. Хлор находится соответственно в VIIА- группе и имеет структуру внешнего энергетического уровня s2p5. Таким образом, высшая степень окисления хлора равна +7. Формулы соединений: хлорная кислота HClO4, оксид хлора (VII) Cl2O7 107. Какой способ образования ковалентной связи называют донорно-акцепторным? Какие химические связи имеются в ионах NH4+ и BF4- ? Укажите донор и акцептор. Донорно-акцепторная связь - это тип ковалентной связи. При образовании донорно-акцепторной связи один из атомов – донор, предоставляет орбиталь с неподеленной парой электронов, а другой атом – акцептор, предоставляет вакантную орбиталь. Образование иона аммония:
Образование тетрафтороборат-иона:
126. Произведите приблизительную оценку длины связей в молекулах NO и SO, если межъядерные расстояния в молекулах N2, O2 и S2 соответственно равны: 1,09·10-10 м, 1,20·10-10 м и 1,92·10-10 м.
Ответ: 1,145·10-10 м, 1,56·10-10 м. 156. Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция Н2(г) + СО2(г) = СО(г) + Н2О(ж); ΔН = -2,85 кДж. Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите ΔG0298 этой реакции.
Ответ: +19,91 кДж, так как ΔG0298 > 0, при стандартных условиях данная реакция невозможна. 181. Вычислите ΔS0 в ходе реакции: 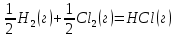 . .
Ответ: 10,04 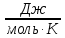 . .189. Установлено, что газовая реакция, протекающая по уравнению А + 2В→ D имеет первый порядок по веществу А и первый - по веществу В. Как изменится скорость реакции при снижении давления в системе в 3 раза?
Ответ: скорость реакции уменьшится в 9 раз. 217. Равновесие гомогенной системы 4НСl (г) + О2(г) ↔ 2Н2О(г) + 2Сl2(г) установилось при следующих концентрациях реагирующих веществ (моль/л): [Н2О]р = 0,14; [Cl2]р = 0,14; [НCl]р = 0,20; [О2]р = 0,32. Вычислите исходные концентрации хлороводорода и кислорода.
Ответ:  0,48 моль/л, 0,39 моль/л. 0,48 моль/л, 0,39 моль/л. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

 H+ +
H+ +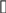
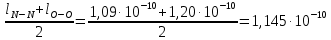
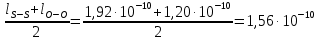
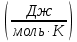
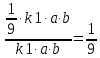
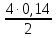 =0,48 (моль/л)
=0,48 (моль/л)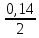 =0,39 (моль/л)
=0,39 (моль/л)