контрольная работа по химии 1 вариант. Химия. Контрольная работа 1 Выполнил Кузнецов Денис Владимирович Группа тбт12
 Скачать 29.91 Kb. Скачать 29.91 Kb.
|
|
Федеральное агентство связи Сибирский государственный университет телекоммуникаций и информатики Межрегиональный учебный центр переподготовки специалистов Контрольная работа по дисциплине: Химия Контрольная работа №1 Выполнил: Кузнецов Денис Владимирович Группа: ТБТ-12 Вариант: 1 Проверила: Гришина Ирина Владимировна Новосибирск, 2021 Рассчитайте количество вещества: а) азота массой 14 г; б) кислорода массой 48 г; в) железа массой 112 г; г) фосфора массой 31 г. Решение: А) n( 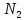 ) = ) =  = =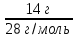 =0,5 моль. =0,5 моль.Б) n(  ) = ) = 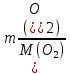 = = 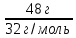 = 1,5 моль. = 1,5 моль.В) n(P) =  = =  = 1 моль. = 1 моль.Напишите электронные формулы атомов элементов с порядковыми номерами 9 и 28. Распределите электроны этих атомов по квантовым ячейкам. К какому электронному семейству относится каждый из этих элементов? Решение: Электронные формулы изображают распределение электронов в атоме по энергетическим уровням и подуровням (атомным орбиталям). Электронная конфигурация обозначается группами символов nlХ, где n - главное квантовое число, l - орбитальное квантовое число (вместо него указывают соответствующее буквенное обозначение - s, p, d. f), х - число электронов в данном подуровне (орбитали). При этом следует учитывать, что электрон занимает тот энергетический подуровень, на котором он будет обладать наименьшей энергией - меньшая сумма n+l . Заполнение энергетических уровней и подуровней идет в такой последовательности: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 5d1 4f14 5d2-10 6p6 7s2 6d1 5f14 Так как число электронов в атоме того или иного элемента равно его порядковому номеру в таблице Д.И.Менделеева, то для элементов №9 (Фтор) и №28 (Никель) электронные формулы имеют вид: 9F 1s2 2s2 2p5. 9F ↑↓ ↑↓ ↑↓ ↑↓ ↑ 1s 2s 2p Фтор относится к p-элементам. 1s2 2s2 2p6 3s2 3p6 3d8 4s2. 28Ni ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑↓ ↑ ↑ ↑↓ 1s 2s 2p 3s 3p 3d 4s Никель относится к d-элементам. 21.Вычислить тепловой эффект реакции восстановления 1 моль Fe2O3 металлическим алюминием. Решение: n(  ) = 1 моль. ) = 1 моль.∆ 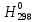 (Fe) = 0, ∆ (Fe) = 0, ∆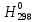 (Al)=0 (Al)=0∆ 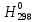 ( ( ) = -822,16 кДж/моль ) = -822,16 кДж/моль∆ 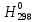 ( (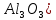 = -1675,69 кДж/моль = -1675,69 кДж/моль 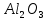 + 2Fe + 2Fe∆ 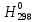 = ∆ = ∆ + 2∆ + 2∆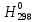 (Fe) – (Fe) – ∆ 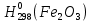 – 2∆ – 2∆ = -1675,69 + 822,16 = -853,53 кДж/моль = -1675,69 + 822,16 = -853,53 кДж/мольQ = -∆ 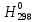 *v = 853,53 кДж/моль * 1 моль = 853,53 кДж. *v = 853,53 кДж/моль * 1 моль = 853,53 кДж.Ответ: Q = 853,53 кДж. 31. Теплоты образования  оксида (II) и оксида (IV) азота соответственно равны +90,37 кДж и +33,85 кДж. Определите оксида (II) и оксида (IV) азота соответственно равны +90,37 кДж и +33,85 кДж. Определите  и и  для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему? для реакций получения NO и NO2 из простых веществ. Можно ли получить эти оксиды при стандартных условиях? Какой из оксидов образуется при высокой температуре? Почему?Решение:  = 2NO = 2NO∆  ∆ 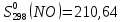 Дж/моль*К Дж/моль*К∆ 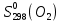 = 205,04 Дж/моль*К = 205,04 Дж/моль*К∆  = 191,50 Дж/моль*К = 191,50 Дж/моль*К∆  = 2*210,64 – 205,04 – 191,50 = 24,74 = 2*210,64 – 205,04 – 191,50 = 24,74∆ 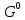 (NO) = ∆ (NO) = ∆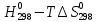 ∆ 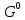 (NO) = 90,37 – 0,02474*298 = 82,997 кДж/моль (NO) = 90,37 – 0,02474*298 = 82,997 кДж/моль = =  ∆  = 240,06 Дж\моль = 240,06 Дж\моль∆  = ∆ = ∆ - 2∆ - 2∆ - ∆ - ∆ = 240,06 – 205,04*2 – 191,50 = - 361,52 Дж/моль = 240,06 – 205,04*2 – 191,50 = - 361,52 Дж/моль∆ 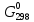 = 33,85 Дж/моль – 298К* (-361,52* = 33,85 Дж/моль – 298К* (-361,52*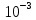 кДж/моль*К) = 141,58 кДж/моль кДж/моль*К) = 141,58 кДж/моль Т.к. в обоих случаях ∆ 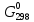 > 0, то оксиды нельзя получить в стандартных условиях. Т.к. ∆ > 0, то оксиды нельзя получить в стандартных условиях. Т.к. ∆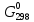 больше для NO, а - больше для NO, а -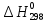 = Q, то эта реакция будет идти с большим поглощением тепла. = Q, то эта реакция будет идти с большим поглощением тепла. Реакция образования NO протекает при более высокой температуре, чем реакция образования NO2. Окисление серы и ее диоксида протекает по уравнениях: а) S(К)+O2(Г)=SO2(Г) ; б) 2SO2(Г)+O2(Г)=2SO3(Г). Как изменятся скорости этих реакций, если объемы каждой из систем уменьшить в четыре раза? Решение: 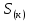 + + 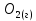 = =  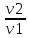 = = 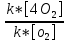 = 16 = 16При уменьшении объема в 4 раза, скорость окисления серы увеличится в 16 раз. 2  + + 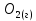 = = 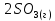 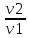 = =  = 64 = 64При уменьшении объема в 4 раза, скорость окисления диоксида серы увеличится в 64 раза. Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция, плотность которого 1,178 г/см3. Решение: m(p-pa) = ρ(p-pa) * V(p-pa) = 1,178 * 100 = 117,8 г m(Ca  ) = ) = 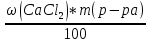 = = 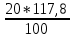 = 23,56 г = 23,56 гn(Ca  ) = ) = 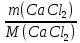 = =  = 0,212 моль = 0,212 моль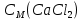 = = 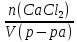 = =  = 2,12 моль/л = 2,12 моль/л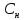 (Ca (Ca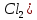 = z(Ca = z(Ca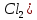 * *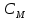 (Ca (Ca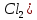 = 2*2,12 = 4,24 моль/л = 2*2,12 = 4,24 моль/лОтвет: 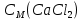 = 2,12 моль/л = 2,12 моль/л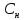 (Ca (Ca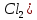 = 4,24 моль/л = 4,24 моль/л61. Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная температуру кристаллизации раствора (-0,930С). Криоскопическая константа воды 1,86 град Решение: ∆t =  ( (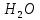 ) – ) –  (p-pa) (p-pa)∆t = 0 – (-0,93) = 0,93℃ 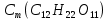 = = 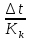 = = 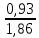 = 0,5 моль/кг = 0,5 моль/кг ( ( ) = ) = 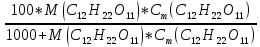 = =  = 14,6% = 14,6%Ответ:  ( ( ) = 14,6% ) = 14,6%71. Реакции выражаются схемами: P + HIO3 + H2O H3PO4 + HI H2S + Cl2 + H2O H2SO4 + HCl Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанавливается. Решение: 6P + 5Hl 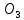 + 9 + 9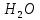 → 6 → 6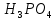 + 5Hl + 5Hl → →  | 5 | 30 | 6 | восстановитель (окисление) | 5 | 30 | 6 | восстановитель (окисление)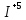 + 6e → + 6e → 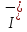 | 6 | 30 | 5 | окислитель (восстановление) | 6 | 30 | 5 | окислитель (восстановление)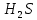 + 4 + 4 + 4 + 4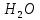 → →  + 8HCl + 8HCl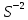 – 8e → – 8e →  | 8 | 8 | 1 | восстановитель (окисление) | 8 | 8 | 1 | восстановитель (окисление)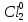 + 2e → 2 + 2e → 2 | 2 | 8 | 4 | окислитель (восстановление) 3 | 2 | 8 | 4 | окислитель (восстановление) 3СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ 1. Глубоков, Ю.М. Аналитическая химия: Учебник для студентов учреждений среднего профессионального образования / Ю.М. Глубоков, В.А. Головачева, Ю.А. Ефимова; Под ред. А.А. Ищенко. - М.: ИЦ Академия, 2016. 2. Артемов, А.В. Физическая химия: Учебник для студентов учреждений высшего профессионального образования / А.В. Артемов. - М.: ИЦ Академия, 2016. 3. Общая химия. Учебник / Под ред. Дунаева С.Ф.. - М.: Academia, 2017. 4. Ахметов Н.С. Общая и неорганическая химия. – М.: Высшая школа, 2004. 5. Глинка Н.Л. Общая химия. – Л.: Химия, 2003. |
