Контрольная работа. Контрольная работа Какую массу имеют 30 дм3 азота при нормальных условиях
 Скачать 199.8 Kb. Скачать 199.8 Kb.
|
|
Контрольная работа 5.Какую массу имеют 30 дм3 азота при нормальных условиях? Масса азота рассчитывается из формулы: m(N2) = n * M(N2), Количество вещества: n = V(N2): VA n = 30 : 22,4= 1,3 Моль, m(N2) = 1,3 * 28 = 36,4 г. Ответ: m(N2)= 36,4 грамма. 20. Для подчеркнутого вещества определите в указанных реакциях молярную массу, факторы эквивалентности, молярные массы эквивалентов. Fe(OH)3 + H2SO4  Fe(OH)3 + 3KOH  Fe(OH)3 + H2SO4 = FeOHSO4 + 2H2O fэ(Fe(OH)3) = 1 Mэ(Fe(OH)3) = fэ(Fe(OH)3)*M(Fe(OH)3) = 107/1 = 107 г/моль-экв Fe(OH)3 + 3KOH  K3[Fe(OH)6] K3[Fe(OH)6]Так как в одной молекуле тригидроксида железа (Fe(OH)3) замещается 3 гидроксильные группы (OH), следовательно, фактор эквивалентности (fэкв) тригидроксида железа (Fe(OH)3) равен 1/3: f экв. (Fe(OH)3) = 1/3 Учитывая, что молярная масса тригидроксида железа (Fe(OH)3) равна 107 г/моль, вычислим молярную массу эквивалента тригидроксида железа (Fe(OH)3): Mэкв. (Fe(OH)3) = 107 ⋅ 1/3 = 35,67 (г/моль) 50. На восстановление 3,6 г оксида металла израсходовано 1,7 дм3 водорода (н.у.). Вычислите молярную массу эквивалентов металла. Молярная масса эквивалента рассчитывается по формуле: m(Me) / Mэ(Me) = V(H2) / Vэ(H2) Определим молярную массу эквивалента металла: Mэ(Me) = 3,6 * 11,2 / 1,7 = 23,72 г/моль-экв 65.Какие значения принимают квантовые числа n, l, ml и ms, характеризующие состояние электрона в атоме? Приведите зна чения этих чисел для валентных электронов атома магния. n – главное квантовое число обозначает номер энергетического уровня и характеризует энергию электронов, занимающих данный энергетический уровень. Чем больше n, тем выше энергия. n принимает значения чисел натурального ряда: n = 1; 2; 3 … l – орбитальное квантовое число, определяет форму орбитали. l принимает целочисленные значения от 0 до n-1. l = 0; 1; 2; … n-1. Очевидно, что для каждого значения n существует свой набор значений l. Каждому значению l соответствует определенная форма орбитали, которая имеет и буквенное обозначение (l=0 - s; l=1 - p; l=2 - d; l=3 - f). ml - магнитное квантовое число, принимающее целочисленные значения от -l до +l: = -l…-2, -1, 0, +1, +2…+l, всего 2l+1 значение. Число значений, которое может принимать ml, соответствует числу орбиталей данной формы для заданного n. Например, для l = 0 (s-орбиталь) ml принимает единственное значение ml = 0, т.е. s-орбиталь одна, для l = 1 – три значения ml: -1, 0. +1, т.е. р-орбиталей – три, l = 2 – пять значений ml: -2, -1, 0, +1, +2, d-орбиталей пять и т.д. ms - спиновое квантовое число, которое характеризует собственное неорбитальное внутреннее движение электрона и принимает значения ms = ±1/2 (в единицах h/2). Для внешних электронов атома магния квантовые числа принимают следующие значения: n = 3 l = 0 ml = 0 ms = ±1/2 80.Что такое энергия ионизации? В каких единицах она измеряется? Как изменяется восстановительная активность s- и р-элементов в группах периодической системы с увеличением по рядкового номера? Почему? Энергия ионизации – это та энергия, которую необходимо затратить, чтобы оторвать электрон и удалить его на бесконечно большое расстояние от ядра. Измеряется в электронвольтах (эВ). Восстановительные свойства s-, p- элементов в группах с увеличением порядкового номера усиливаются, так как энергия ионизации соответственно уменьшается. 95. Что такое направленность ковалентной связи? Как метод валентных связей объясняет строение молекул кислорода и азота? Приведите схему перекрывания электронных орбиталей в них. Направленность ковалентной связи является результатом стремления атомов к образованию наиболее прочной связи за счет возможно большей электронной плотности между ядрами. Это достигается при такой пространственной направленности перекрывания электронных облаков, которая совпадает с их собственной. Исключение составляют s-электронные облака, поскольку их сферическая форма делает все направления равноценными. Образование молекулы азота N2 осуществляется тремя общими электронными парами. У каждого атома азота в образовании связей участвует 3 неспаренных р-электрона, направленных в трехмерном пространстве под углом 900 друг к другу и ориентированных соответственно по осям х, у, z (таковы свойства р-подуровня и р-орбиталей, диктуемые магнитным квантовым числом). Два атома азота, соединяясь в молекулу N2, могут образовать одну σ-связь (перекрываются облака, ориентированные вдоль оси х) и две π-связи (перекрываются облака, ориентированные вдоль осей у и z). 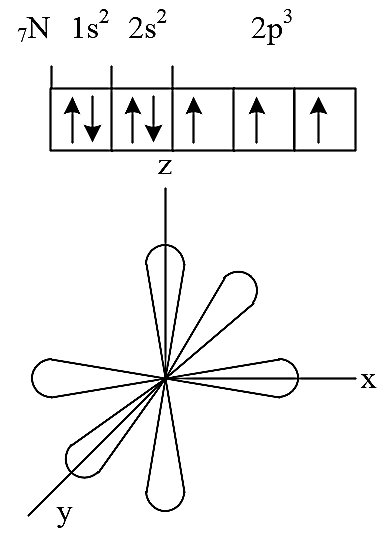 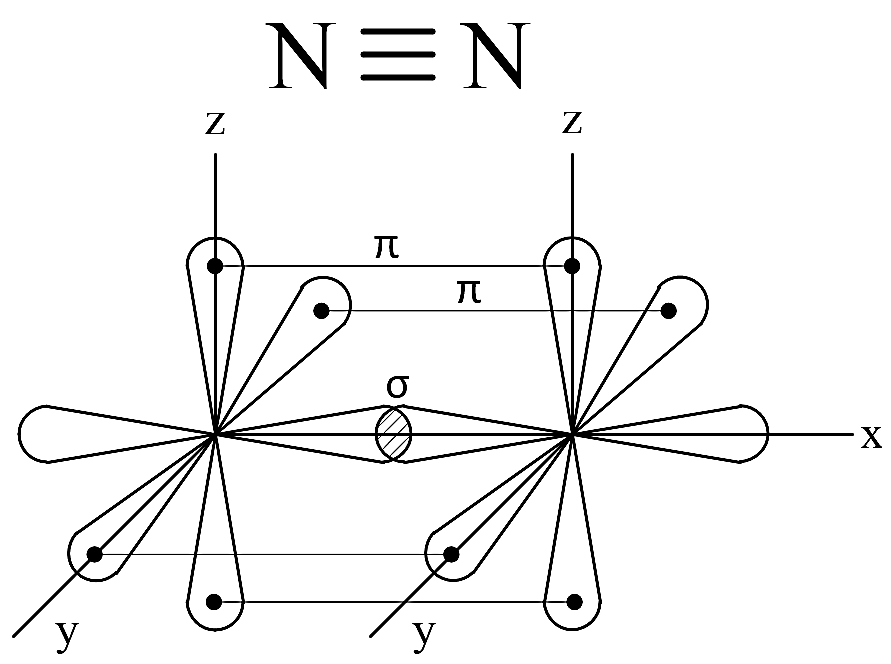 Электронная формула атома Кислорода - 8O 1s22s22p2, или 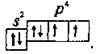 Два неспаренные р-электроны в атоме Кислорода могут образовать две совместные ковалентные пары с электронами второго атома Кислорода: 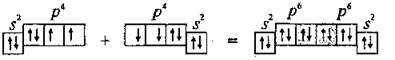 Одна пара идет на образование σ-связи: Другая, перпендикулярная к ней, - на образование π-связи: 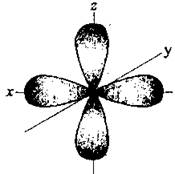 Еще одна p-орбиталь (рв), как и s-орбиталь, на которой находятся по две спаренные электроны, участия в связи не берут и не обобществляются. 115.Приведите энергетические диаграммы образования молекулярных частиц Сравните порядок, энергию связей и магнитные свойства частиц. Какая из молекулярных частиц является более прочной? * Н 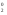 и H и H . .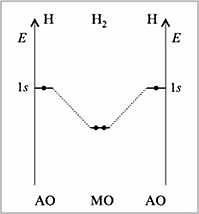 Рис. 1. Энергетическая диаграмма молекулы Н2 Слева и справа на вертикальных осях энергии отмечены энергии перекрывающихся 1s-АО двух атомов Н, а посередине — электроны на энергетическом уровне молекулы. Энергия МО ниже, чем исходных АО. Разность энергий АО и МО, т.е. энергия, выделяющаяся при переходе электронов с АО на МО, является энергией связи. Чтобы разорвать связь, т.е. вернуть электроны на исходные АО, необходимо такую же энергию затратить. Энергия связи тем больше, а связь тем прочнее, чем выше электронная плотность между ядрами. Последняя, при прочих равных условиях, зависит от размеров соединяющихся атомов. Чем атомы меньше, тем выше электронная плотность на их АО, следовательно, и на образующихся МО. Рассмотрим ион Н2–. На имеющейся МО третьему электрону места нет. И он занимает другую МО, на которой электронная плотность между ядрами понижена, как показано на рис. 2.  Рис. 4. Распределение электронной плотности на антисвязывающей Такое распределение электронной плотности приводит к отталкиванию «обнаженных» ядер и повышению потенциальной энергии системы. Эта МО называется антисвязывающей (или разрыхляющей), ослабляющей связь, в отличие от ранее рассмотренной связывающей МО. Энергетическая диаграмма иона Н2– показана на рис. 3. 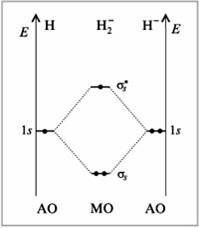 Рис. 3. Энергетическая диаграмма иона Н2– На этой диаграмме приведены и принятые обозначения МО. В данном случае связь – Трехэлектронная связь в ионе Н2– слабая. Здесь на связывающей МО на один электрон больше, чем на антисвязывающей, как и в ионе Н2+. Однако межэлектронное отталкивание (между тремя электронами) существенно уменьшает выигрыш в энергии. Энергия связи в молекуле-ионе Н2– составляет всего 17 кДж/моль. Это общее положение для соединений с трехэлектронными связями. Но именно такие связи образуются в соединениях благородных газов, у которых на всех АО имеется по два электрона. Поэтому их соединения неустойчивы. 130.Рассчитайте тепловой эффект Н 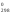 , изменение энтропии S , изменение энтропии S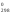 и изменение энергии Гиббса G и изменение энергии Гиббса G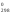 реакции: реакции:CaCO3(кр) = CaO(кр) + CO2(г) Определяем тепловой эффект реакции используя первое следствие из закона Гесса: ΔН0298 = 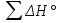 f,298(продуктов) - f,298(продуктов) - 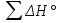 f,298(исходных веществ) f,298(исходных веществ)ΔН0298 = ΔН0f,298 (СО2) + ΔН0f,298(CаО) - ΔН0f,298(CаСO3) ΔН0298 = (-393,51) + (-635,09) – (-1206,83) = 178,23 кДж Вычисляем изменение энтропии реакции: ΔS0298 = 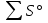 298(продуктов) - 298(продуктов) - 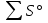 298(исходных веществ) 298(исходных веществ)ΔS0298 = S0298(СО2) + S0298(СаО) - S0298(СаСО3) ΔS0298 = 213,66 + 38,07 – 91,71 = 160,02 Дж/моль*К Вычисляем изменение энергии Гиббса: ΔG0298 = ΔН0298 – Т ΔS0298 стандартные условия Р = 101 325 Па, Т = 298 К. ΔG0298 = 178,23 – 298  (160,02 (160,02 10–3) = 130,55 кДж 10–3) = 130,55 кДжΔG0298 > 0, значит реакция не идет самопроизвольно в прямом направлении. 200.Какие вещества называют электролитами? Составьте уравнения процессов диссоциации следующих электролитов: HF, RbOH, Fe2(SO4)3, NaHCO3 Электролиты — это вещества, растворы или расплавы которых проводят электрический ток. HF: HF⇄H+ + F- RbOH: RbOH⇄Rb+ + OH- Fe2(SO4)3: Fe2(SO4)3 ⇄ 2Fe3+ + 3SO42- NaHCO3 На первой ступени диссоциации образуются катион металла и анион кислотного остатка, содержащего ион водорода: NaHCO3 = Na+ + HCO3– На второй ступени диссоциации катион водорода H+ отщепляется от аниона HCO3–: HCO3– ⇄ H+ + CO32– Таким образом, диссоциация данной кислой соли происходит в две ступени и имеет следующую последовательность: NaHCO3 = Na+ + HCO3– HCO3– ⇄ H+ + CO32– 215.составьте молекулярные и ионно-молекулярные уравнения реакций между водными растворами: а) нитрата свинца(II) и сульфида натрия б) хлорида магния и гидроксида калия Pb(NO3)2 + Na2S → PbS + 2NaNO3 Pb2+ + 2NO3- + 2Na+ + S2- = PbS + 2Na+ + 2NO3- Pb2+ + S2- = PbS Реакция взаимодействия нитрата свинца(II) и сульфида натрия с образованием сульфида свинца(II) и нитрата натрия. 2KOH + MgCl2 → 2KCl + Mg(OH)2↓ 2K+ + 2OH- + Mg+ + 2Cl- → 2K+ + 2Cl -+ Mg(OH)2↓ 2OH- + Mg+ → Mg(OH)2↓ В результате реакции гидроксида калия (KOH) с хлоридом магния (MgCl2) образуется хлорид калия (KCl) и гидроксид магния (Mg(OH)2) 230.Рассчитайте, какой объем воды необходимо добавить к 1 дм3 раствора муравьиной кислоты НСООН с молярной концентрацией 0,3моль/дм3, чтобы степень диссоциации кислоты удвоить. KD(CH3COOH) = 1,8 . 10-4. Поскольку муравьиная кислота слабая, KD = CM . Откуда: α = 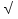 1,8-10*5/0,3 = 0,0077 1,8-10*5/0,3 = 0,0077Учитывая, что степень диссоциации муравьиной кислоты удвоилась, рассчитаем молярную концентрацию разбавленного раствора: См = Кд/α2=1,8*10-5/2*(0,3)2=1,8*10-5/0,18=0,0001 моль/дм3 Рассчитаем количество кислоты, содержащейся в 1 л 0.3М раствора её из пропорции: 1000:х = 1000:0,3 Х = 1000*0,3/1000 = 0,3 моль Теперь рассчитаем количество кислоты, содержащейся в 1 л 0,0001М раствора её из пропорции: 1000:х = 1000:0,0001 Х = 1000*0,0001/1000 = 0,0001 моль Рассчитаем объём раствора кислоты при разбавлении 1 л 0,3М раствора с учётом того, что его концентрация станет равной 0,0001М из пропорции: 1000*0,0001=х:0,3 Х = 1000*0,3/0,0001 = 3л Теперь найдём объём воды добавленный для разбавления начального раствора кислот: V = 3 - 1 = 2 л. Ответ: 2 л. |
