массообменные маликов. Контрольная работа по дисциплине Массообменные процессы химической технологии
 Скачать 40.39 Kb. Скачать 40.39 Kb.
|
|
Министерство науки и высшего образования РФ Федеральное государственное бюджетное образовательное учреждение высшего образования «Магнитогорский государственный технический университет им. Г.И. Носова» Кафедра металлургии и химических технологий КОНТРОЛЬНАЯ РАБОТА по дисциплине «Массообменные процессы химической технологии» Тема: «Расчёт равновесия в системе пар-жидкость при разделении бинарной смеси в тарельчатой ректификационной колонне» Исполнитель: ___________________________________ ____курс, гр. _________ Руководитель: Шубина Марианна Вячеславовна, доцент каф. М и ХТ Работа допущена к защите " ___" ___________ 20___ г. Работа защищена " ___" _________ 20___ г. с оценкой ________________________ Магнитогорск, 2022 Министерство науки и высшего образования РФ Федеральное государственное бюджетное образовательное учреждение высшего образования «Магнитогорский государственный технический университет им. Г.И. Носова» Кафедра металлургии и химических технологий ЗАДАНИЕ ДЛЯ КОНТРОЛЬНОЙ РАБОТЫ по дисциплине «Массообменные процессы химической технологии» Тема: «Расчёт равновесия в системе пар-жидкость при разделении бинарной смеси в тарельчатой ректификационной колонне» Студенту _______________________________________________________________ Вариант – 7 Исходные данные: Смесь: толуол – п-ксилол Производительность установки по исходной смеси F = 15000 кг/ч Составы жидкости, масс.доли НК: исходной смеси хF =0,75 дистиллята хP = 0,95 кубового остатка хW = 0,020 Давление в колонне (среднее) 0,0995 МПа Срок сдачи: «___»______________ 20___г. Расчёт равновесия в системе пар-жидкость при разделении бинарной смеси в тарельчатой ректификационной колонне Парциальное давление пара каждого компонента для идеальных жидких смесей зависит от температуры и пропорционально мольной доли данного компонента в жидкости (закон Рауля): 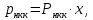 (1) (1)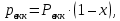 (2) (2)где рнкк и рвкк - парциальные давления низкокипящего и высококипящего компонентов, Па; Рнкк и Рвкк - упругость, или давление насыщенных паров над чистыми компонентами, Па; х - содержание низкокипящего компонента в жидкости, мольн. доли. Общее давление пара над жидкостью равно сумме парциальных давлений (закон Дальтона): 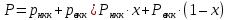 , (3) , (3)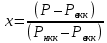 . (4) . (4)Парциальное давление компонента можно получить по закону Дальтона:  . (5) . (5)Или с учетом выражения (1) получаем: 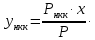 , (5а) , (5а)где ункк – содержание низкокипящего компонента в парах, мольн. доли. При совместном решении уравнений (1) и (5) можно получить равновесный состав пара: 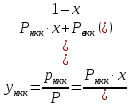 , (6) , (6)где α – относительная летучесть НКК. При решении приведенных уравнений строятся следующие графики: а) изобара равновесных составов, называемая кривой равновесия, определяющая равновесные составы пара и жидкости при постоянном давлении (рисунок 1); б) изобары температур кипения и конденсации, определяющие температуру кипения жидкости и температуру конденсации паров заданного состава (рисунок 2). Для построения этих графиков необходимо задаться рядом температур, лежащих между температурами кипения толуола (110,6 °С) и чистого уксусной кислоты (142°С). Давление паров отдельных компонентов при заданных температурах находится по уравнению Антуана: 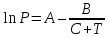 (7) (7)где Р – давление паров над чистым компонентом при какой-то температуре, мм рт.ст.; Т – температура, К; А, В, С – эмпирические константы (см. для заданных по условию веществ в справочнике Рида на образовательном портале). Таблица 1 – Значения констант А, В, С
Таблица 2 – Расчет равновесия смеси этиловый спирт – уксусная кислота
Давление паров толуола при температуре 110,6 0С по формуле (7): 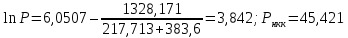 мм. рт. ст. мм. рт. ст.При температуре 110,6 0С давление паров п-ксилола равно: 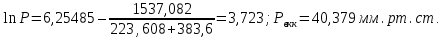 Давления паров этилового спирта Pнкк и уксусной кислоты Pвкк при других температурах в указанном интервале находятся аналогично, и данные заносятся в таблицу 2. По упругости паров компонентов при различных температурах находятся равновесные составы: для жидкости формула (4) и пара формула (5а), причем общее давление берётся Р = 45,421 мм рт. ст. (которое было рассчитано выше по формуле (7), и у каждого варианта оно свое). Равновесный состав для жидкости при температуре 110,6 0С по формуле (4): 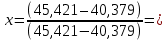 1,00. 1,00.Равновесный состав для пара при температуре 110,6 0С по формуле (5а): 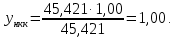 Определяем состав смеси, дистиллята и кубового остатка в мольных долях по низкокипящему компоненту по уравнению: 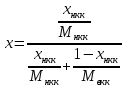 (8) (8)Пересчитаем по формуле (8) составы в мольных долях: 1) исходное питание ХF = 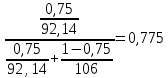 ; ;2) дистиллят ХР = 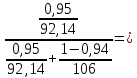 0,956; 0,956;3) кубовый остаток ХW= 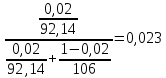 . .На основании расчетных данных строятся изобары равновесия y – x (см. рисунок 1) и изобары температуры кипения и конденсации (см. рисунок 2). 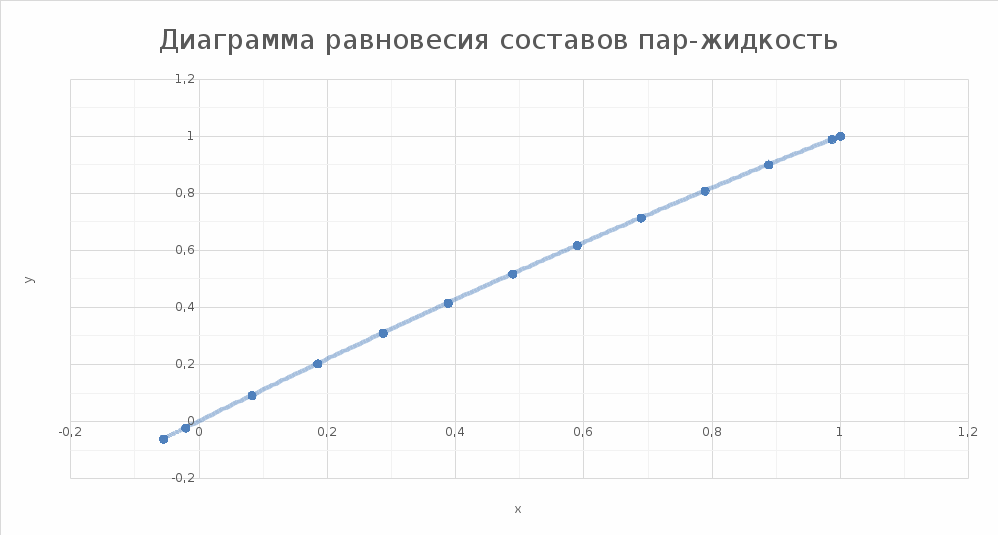 Рисунок 1 - Диаграмма равновесия составов пар-жидкость 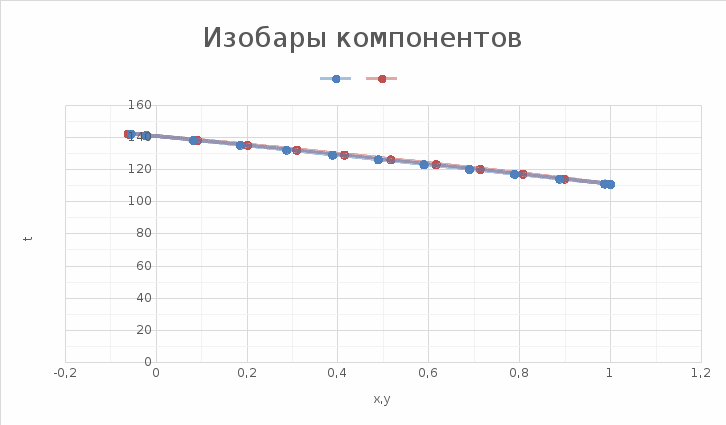 Рисунок 2 - Изобары компонентов |
