химия контрольная работа. химия. Контрольная работа по общей и неорганической химии Вариант 57 студент гр. Зукд122 Козлов Е. А. Проверил
 Скачать 50.13 Kb. Скачать 50.13 Kb.
|
|
Министерство науки и высшего образования РФ Федеральное государственное бюджетное образовательное учреждение высшего образования «Владимирский государственный университет им. А.Г. и Н.Г. Столетовых» Кафедра химии Контрольная работа по общей и неорганической химии Вариант № 57 Выполнил: студент гр. ЗУКд-122 Козлов Е.А. Проверил: Красильникова И.А. Владимир 2023 Задание№1 19. а) Напишите электронную формулу атома кадмия Cd. б) Распределите по квантовым ячейкам электроны двух последних уровней атома кадмия, соблюдая принцип Паули и правило Гунда. в) Зная, что кадмий в соединениях может проявлять высшую валентность, равную II, определите, на каких подуровнях находятся валентные электроны атома кадмия и укажите эти электроны. Напишите значения четырех квантовых чисел для всех валентных электронов атома кадмия. а)Электронная формула атома: Cd - 1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3D^10 4p^6 4d^10 5s^2 б)  в)  Задание№2 48. а) Определите число связей в молекуле NaH2PO4. б) Какая геометрическая конфигурация молекулы SiF4? в) В какой из приведённых молекул SiCl3, AlCl3, CCl4, GeF4 связь элемент - галоген имеет наиболее выраженный полярный характер? а) 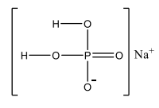 8 связей: 6 одинарных и 1 двойная(фосфор-кислород) б) Молекула фторида кремния SiF4 имеет тетраэдрическое строение . Кремний находится в sp3-гибридизованом состоянии, что соответствует тетраэдрической форме. в) Самая полярная, значит, наибольшая разница в значениях электроотрицательности элементов. Ответ : GeF4 Задание№3 72. а) Сколько эквивалентов железа вступит в реакцию с 500 мл 2 м раствора CuSO4? б) В каком количестве KOH содержится столько же эквивалентов, сколько их в 250 г Ca(OH)2? в) Мышьяк образует 2 оксида, из которых один содержит 65,2 % (масс.) As, а другой - 75,7 % (масс.) As. Определите эквивалентные массы мышьяка в обоих случаях а) Запишем уравнение химической реакции: CuSO4 + Fe = FeSO4 + Cu Определим количество вещества эквивалента для CuSO4: n(CuSO4) = с(CuSO4) ∙ V(CuSO4)р-ра = 2 ∙ 0,5 = 1 (моль) так как fэкв(CuSO4) = ½, то nэкв(CuSO4) = n(CuSO4) ∙ fэкв(CuSO4) = 1 ∙ ½ = 0,5 (моль) По закону эквивалентов: nэкв(Fe) = nэкв(CuSO4) = 0,5 моль Ответ: nэкв(Fe) = 0,5 моль б) Определим количество вещества гидроксида кальция. n(Ca(OH)2) = m(Ca(OH)2)/M(Ca(OH)2) = 250/74 = 3,4 моль Эквивалентное число гидроксида кальция ½, так как fэкв(Ca(OH)2) = ½ Количество вещества эквивалента гидроксида кальция равно: nэкв(Ca(OH)2) = n(Ca(OH)2) ∙ fэкв(Ca(OH)2) = 3,4 ∙ ½ = 1,7 (моль) По условию количество вещества эквивалента гидроксида калия равно количеству вещества эквивалента гидроксида кальция nэкв(KOH) = nэкв(Ca(OH)2) = 1,7 (моль) Рассчитаем массу гидроксида калия m(KOH) = nэкв(KOH) ∙ M(KOH) = 1,7 ∙ 56 = 95,2 (г) Ответ: m(KOH) = 95,2 г в) Формула оксида As2Ox, учитывая, что кислород в оксидах всегда имеет степень окисления -2 Атомная масса мышьяка 75, значит молярная масса первого оксида 2 ∙ 75/0,652 = 230, то есть кислорода в нем 230 - 150 = 80, что составляет пять атомов и формула оксида As2O5 Эквивалентная масса мышьяка в этом случае 75/5 = 15 Молярная масса второго составляет 2 ∙ 75/0,757 = 198, и на долю кислорода остается 198 - 150 = 48, что составляет три атома, то есть формула оксида As2O3. Эквивалентная масса мышьяка в этом оксиде 75/3 = 25 Задание№4 Написать уравнение следующих окислительновосстановительных реакций. Определить, какое вещество является окислителем и восстановителем, какое вещество создает среду. Указать степень окисления элемента окислителя и восстановителя, определить, сколько электронов отдает восстановитель и принимает окислитель. Уравнять коэффициенты в уравнениях реакций. 96. а) Pb + H2SO4 (конц.) = б) (NH4)2S + K2Cr2O7 + H2O = NH3 + в) K2SO3 + KMnO4 + NaOH = а) Pb + 3 H2SO4 → 2 H2O + SO2 + Pb(HSO4)2 Это окислительно-восстановительная реакция: Pb0 - 2 e- → PbII (окисление) SVI + 2 e- → SIV (восстановление) Pb является восстановителем, H2SO4 является окислителем. б) H2O + K2Cr2O7 + 3 (NH4)2S → 3 S + 2 KOH + 6 NH3 + 2 Cr(OH)3 Это окислительно-восстановительная (редокс) реакция: 3 S-II - 6 e- → 3 S0 (окисление) 2 CrVI + 6 e- → 2 CrIII (восстановление) (NH4)2S является восстановителем, K2Cr2O7 является окислителем. в) K2SO3 + 2 KMnO4 + 2 NaOH → H2O + 2 K2MnO4 + Na2SO4 Это окислительно-восстановительная (редокс) реакция: 2 MnVII + 2 e- → 2 MnVI (восстановление) SIV - 2 e- → SVI (окисление) KMnO4 является окислителем, K2SO3 является восстановителем. Задание№5 120. а) Рассчитайте, сколько миллилитров 20%-ного раствора H2SO4 (ρ =1,14 г/см3 ) необходимо взять для приготовления 300 мл 0,5 М раствора. б) В 250 мл воды растворили 5,85 г NaCl. Какова молярность и нормальность полученного раствора? в) Понижение давления пара над раствором бензойной кислоты, содержащим 0,100 моль бензойной кислоты в 760 г сероуглерода, при некоторой температуре равно 7,53 мм рт.ст. Давление пара сероуглерода при той же температуре 760 мм рт.ст. Вычислить молекулярную массу сероуглерода а) Сн (H2SO4)=10*w*p/Mэкв (H2SO4)=10*20*1,14 / (98/2)=4,65 моль-экв/л Сн1*V1=Сн2*V2 V=0,5*300/4,661=32,1 мл б) w(NaCl) = m(NaCl)/m(р-ра) = 5,85 г/(250+20) = 0,021,или 2,1% n(NaCl) = m/M = 5,85 г/58,5 г/моль = 0,1 моль Cm(NaCl) = n/V = 0,1 моль/0,25 л = 0,4 моль/л Для хлорида натрия нормальность и молярность - совпадают Задание№6 144. а) рН раствора азотной кислоты (HNO3) равен 2,8. Сколько граммов этой кислоты содержится в 1л раствора. б) Вычислите рН 0,01 М раствора гидроксида аммония NH4OH, К= 1,8 ·10-5 а) [H+] = 10^ (-2.8) = 1.58*10^ (-3) HNO3 - > H (+) + NO3 (-) H+] = C (HNO3) = 1.58*10^ (-3) m (HNO3) = C (HNO3) * V (HNO3) * M (HNO3) = 1.58*10^ (-3) * 1 * 63 = 0.0998 г б) Kb = 1,8 * 10^-5. Концентрация гидроксид-анионов в 0,01М растворе составит корень квадратный(1,8 * 10^-5 * 0,01) = 4,2 * 10^-4. Определим рН раствора NH4OH: pOH = -lg[OH^-] = — lg(4,2 * 10^-4) = 3,37; тогда рН = 14 — 3,37 = 10,63. Ответ: 10,63. Задание№7 Вычислить H°, G°, S° приведенных ниже реакций. Сделать вывод о возможности протекания приведенных реакций в указанном направлении при 25°С, если реакция при комнатных условиях не идет, выяснить, пойдет ли реакция при других температурах. 162. 4FeSтв + 7O2г = 2Fe2O3тв + 4SO2г Задание№8 В каждом задании равновесная система относится к пп. «а» и «б». Для п. «а» написать выражение константы равновесия и определить, в какую сторону сместится равновесие при повышении в заданной системе давления, температуры. Ответ обосновать. Какими ещё воздействиями на систему равновесие можно сместить вправо? 199. а) H2 (г) + Br2 (г) ↔2HBr (г). б) Вычислите исходную концентрацию H2, если равновесные концентрации H2, Br2, HBr равны соответственно 0,5 моль/л, 0,1 моль/л, 1,6 моль/л. а) ΔНº реакции = ΣΔНºобр. прод. – ΣΔНºобр. исх. в-в ΔНº реакции = ΔНºобр.2НBr(г) – ΔНºобр.Н2(г)– 3ΔНºобр.Br2(г) При ст. усл. (Т=298 К, р=1 атм.) ΔНºобр. простых вещ-в (Н2) = 0 ΔНº реакции = 52,3 – 226,75 < 0 - прямая реакция экзотермическая, , поэтому при повышении темп. равновесие сместится в сторону обратной эндотерм. реакции. Можно сместить равновесие вправо, взяв одно из исх. веществ (Н2 или Br2) в избытке. Тогда ускорится прямая реакция, в кот. конц-я этого реагента снижается в рез. превращения его в продукт. б)Соотношение веществ в реакции 1:1:1, т.е. конц-и всех веществ с момента начала реакции до достижения равновесия изменились на одинаковую величину. Снач. HBr = 1,6моль/л, Сравн. HBr = 1,6 моль/л ΔС HBr = С равн. – С нач.= +1,6 моль/л т.е. конц-я увеличилась на 1,6 моль/л, значит, до достижения равновесия идет преимущественно прямая реакция. При этом конц-и Н2 уменьшилась на 1,6 моль/л и стала Br2 0,1 моль/л, значит, нач. конц-я Br2 была 1,6+0,1=1,7 моль/л. Точно так же конц-и Н2 уменьшилась на 1,6 моль/л и стала 0,5 моль/л, значит, нач. конц-я Н2 была 1,6+0,5=2,1 моль/л. Задание№9 Напишите в молекулярной и краткой ионной форме уравнения гидролиза солей. Если гидролиз идёт по стадиям. Напишите уравнения гидролиза по стадиям. Укажите условия, при которых происходит данная стадия гидролиза. Укажите, как изменяется pH-среды 209.а) CuCl2 б) Na3PO4 в) Fe(CH3COO)2 а) Молекулярное уравнение CuCl2 + HOH ⇄ CuOHCl + HCl Полное ионное уравнение Cu2+ + 2Cl- + HOH ⇄ CuOH+ + Cl- + H+ + Cl- Сокращенное ионное уравнение Cu2+ + HOH ⇄ CuOH+ + H+ В результате гидролиза образовались ионы водорода (H+), поэтому раствор имеет кислую среду (pH < 7) б) Молекулярное уравнение Na3PO4 + HOH ⇄ Na2HPO4 + NaOH Полное ионное уравнение 3Na+ + PO43- + HOH ⇄ 2Na+ + HPO42- + Na+ + OH- Сокращенное ионное уравнение PO43- + HOH ⇄ HPO42- + OH- В результате гидролиза образовались гидроксид-ионы (OH-), поэтому раствор имеет щелочную среду (pH > 7) в) Молекулярное уравнение (CH3COO)2Fe + 2HOH ⇄ 2CH3COOH + Fe(OH)2 В результате гидролиза в растворе в большем количестве присутствуют ионы водорода (H+), потому что Kd. I(основания) = Kd. I(кислоты), следовательно раствор имеет слабо кислую среду (pH < 7) Задание№10 Рассчитать ЭДС следующих гальванических элементов: 254.Pt, H2 | р-р с рН = 5 | | MnSO4 0,03 н. | Mn Е° Pt +|Pt =+1,188В Е° H2+|H = 0 В Электродный потенциал E = E° + (0,059/n)lgC E = 1,188 + (0,059)∙lg0,01 = 1,07 В Вычислим ЭДС гальванического элемента: ЭДС = E0кат — E0ан = E02H+/H2 — E0Pt+/Pt ЭДС = 0 - 1,07 = -1,07 В Задание№11 264. Латунь, как известно, содержит 60% Cu и 40% Zn. Определите, в каких средах (щелочной, кислой, нейтральной) происходит коррозия латуни. Напишите уравнения реакций, протекающих на анодных и катодных участках при коррозии этой детали в щелочной, кислой и нейтральной средах. Коррозия латуни в кислой среде: A (-) Zn | HCl | Cu (+) K Анодный процесс: Zn – 2e = Zn2+ - окисление Катодный процесс: 2H+ + 2e = H2 – восстановление Перетекание электронов с анодных участков на катодные называется катодной поляризацией. Снятие электронов с катодных участков ионами водорода называется водородной деполяризацией, а ионы водорода – деполяризаторами. В кислых средах, не содержащих растворённого кислорода, коррозия протекает только с водородной деполяризацией. Данное уравнение будет выглядеть так: Zn + 2H+ = Zn2+ + H2↑ Zn + 2HCl = ZnCl2 + H2↑ Продукты коррозии: ZnCl2 и H2↑. Хлорид цинка - растворимая в воде соль, значит, поверхность металла она не защищает, и растворение цинка идёт до конца. Поэтому латунные изделия нельзя эксплуатировать в кислой среде. Коррозия латуни нейтральной среде: A (-) Zn | Н2O, O2 | Cu (+) K Анодный процесс: Zn – 2e = Zn2+ (х2) Катодный процесс: 2H2O + O2 + 4e = 4OH– 2Zn + 2H2O + O2 = 2Zn2+ + 4OH– 2Zn + 2H2O + O2 = 2Zn(OH)2↓ Латунные изделия можно эксплуатировать во влажной атмосфере воздуха, так как образуется нерастворимое соединение, защищающее поверхность от дальнейшей коррозии. Процесс идёт с кислородной деполяризацией. Задание№12 294. Вычислите время, необходимое для выделения 11,17 г железа из 1 л 1 М раствора FeSO4 током в 1,34 А. Определите, сколько граммов железа осталось ещё в электролите t=Q/I=m*F/(Mэ*I)=8, 36 часа. w(Fe)=M(Fe)/M(FeSO4)=0,368 или 36,8% c(FeSO4)=n/V=>n(FeSO4)=1 моль n=m/M=>m(FeSO4)=152 г mост. (Fe)=w*m(FeSO4)-11,17 г = 44,3 г |
