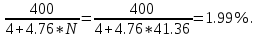|
|
Контрольная работа по теории горения и взрыва Студентки 3 курса, специальность Пожарная безопасность
Государственное автономное образовательное учреждение высшего образования
«Астраханский государственный архитектурно-строительный университет»
Кафедра ПБиВ
Заочное форма обучения
КОНТРОЛЬНАЯ РАБОТА
По теории горения и взрыва
Студентки 3 курса, специальность Пожарная безопасность
Факультет ИСиПБ группа зПБ-31-20
Шифр 20050120210 Ф.И.О. Гаврилова Дарья Олеговна
Дата сдачи контрольной работы «3» _декабря_______ 2022г.
Результаты проверки
Контрольной работы______________________________________
(зачтено, не зачтено)
Дата «___»__________20_______г.
Преподаватель___________________________________________
/Подпись, ФИО преподавателя/
Вариант 7
Задача №1
Условие: определить объем и состав продуктов горения образующихся при сгорании 1 кг вещества C₂H₄(OH)₂, если горение происходят при коэффициенте избытка воздуха ɑ = 1,4. Объем продуктов горения считать приведенным к нормальным условиям.
Дано:
C₂H₄(OH)₂ - этиленгликоль;
m(C₂H₄(OH)₂) = 1 кг;
ɑ = 1,4;
н.у.
|
Решение:
C₂H₄(OH)₂+2.5O₂+9.4N₂=2CO₂+3H₂O+9.4N₂
Определим Vºᵦ необходимое для сгорания одного кг C₂H₄(OH)₂:
Vºᵦ = 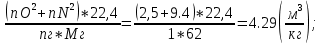
Определим действительный объем воздуха Vᵦ с учетом ɑ=1,4:
Vᵦ = Vºᵦ*ɑ = 4.29*1.4 = 6.606 ; ;
Δ Vᵦ = Vºᵦ*( ɑ - 1) = 4.29*(1.4 - 1) = 1.716
Определим объемы продуктов горения:
V(CO₂) = 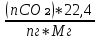 = =  = 0.72 = 0.72 ; ;
V(H₂O) = 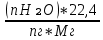 = = 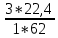 = 1.08 = 1.08 ; ;
Vº(N₂) =  = = 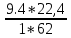 = 3.39 = 3.39 ; ;
Vºпг = V(CO₂) + V(H₂O) + Vº(N₂) = 0.72 + 1.08 + 3.39 = 5.19 ; ;
V(N₂) = Vº(N₂) + 0.79* Δ Vᵦ = 3.39 + 0.79*1.716 = 4.74 ; ;
V(O₂) = 0.21* Δ Vᵦ = 0.21*1.716 = 0.36 ; ;
Vпг = Vºпг + Δ Vᵦ = 5.19 + 1.716 = 6.906 ; ;
φ(CO₂) = 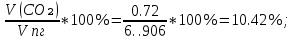
φ (H₂O) = 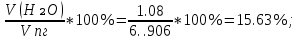
φ (N₂) = 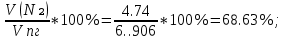
φ (О₂) = 
|
Найти:
V(CO₂) - ?
V(H₂O) - ?
V(N₂) - ?
φ(CO₂) -?
φ (H₂O) - ?
φ(N₂) - ?
|
Задача №2
Условие: определить объем и состав продуктов горения смеси газов, если горение происходит при коэффициенте избытка воздуха ɑ = 1.2.
Дано:
ɑ=1,2;
φ(CH₄) = 35%;
φ(C₅H₁₂) = 8%;
φ(C₅H₁₀) = 19%;
φ(CO₂) = 17%;
φ(O₂) = 21%
Найти:
V(CO₂) - ?
V(H₂O) - ?
V(N₂) - ?
φ(CO₂) -?
φ (H₂O) - ?
φ(N₂) - ?
|
Решение:
CH₄+2O₂+7.52N₂=CO₂+2H₂O+7.52N₂
C₅H₁₂+8O₂+30.08N₂=5CO₂+6H₂O+30.08N₂
C₅H₁₀+7.5O₂+28.2N₂=5CO₂+5H₂O+28.2N₂
Определим Vºᵦ:
Vºᵦ = 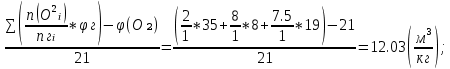
Определим действительный объем воздуха Vᵦ с учетом ɑ=1,2:
Vᵦ = Vºᵦ*ɑ = 12.03*1.3 = 14.43 ; ;
Δ Vᵦ = Vᵦ - Vºᵦ = 14.43 - 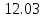 = 2.4 = 2.4
Определим состав продуктов горения, учитывая то, что горение протекает с избытком воздуха, но при расчете количество продуктов горения учитывается избыточное количество O₂ и N₂:
V(CO₂) = 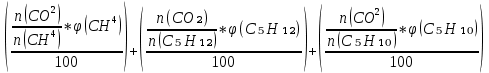 = =  ; ;
V(H₂O) =  = = 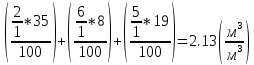 ; ;
Vº(N₂) =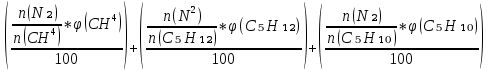 = =  ; ;
V(N₂) = Vº(N₂) + 0.79* Δ Vᵦ = 10.39 + 0.79*2.4 = 12.286 ; ;
V(O₂) = 0.21* Δ Vᵦ = 0.21*2.4 = 0.504 ; ;
Vпг = V(CO₂) + V(H₂O) + Vº(N₂) + V(O₂) = 1.7 + 2.13 + 12.286 + 0.504 = 16.62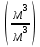 ; ;
Определим φ:
φ(CO₂) = 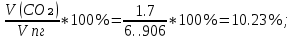
φ (H₂O) = 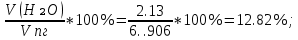
φ (N₂) = 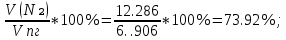
φ (О₂) = 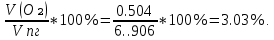
|
Задача №3
Условие: вычислить температуру горения вещества, если горение протекает при коэффициенте избытка воздуха ɑ, а доля потерь тепла излучение составляет ƞ.
Дано:
Керосин
ω(C) = 78%;
ω(H) = 13.7%;
ω(O) = 0.3%;
ω(S) = 0%;
ω(N)= 0%;
ω(W) = 8%;
ω(зола) = 0%;
ɑ=1,3;
ƞ = 0.4
Найти:
Тг - ?
|
Решение:
Определим Qn:
Qn = 339.4*C + 1257*H – 108.9*(O + N – S) – 25.1*(9*H + W) = 339.4*78 + 1257*13.7 – 108.9*(0.3 + 0 – 0) – 25.1*(9*13.7 + 8) = 40465.8(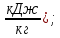
Определим состав продуктов горения:
V(CO₂) = 1.86*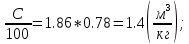
V(H₂O) = 11.2*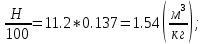
Vº(N₂) =  * *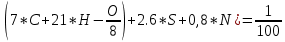 * *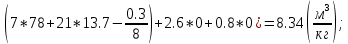
Определим Vºᵦ:
Vºᵦ = 
Определим Тг:
Тг = То + 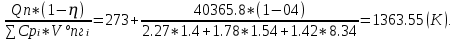
|
Задача №4
Условие: рассчитать адиабатическую температуру горения для стехиометрической смеси вещества А с воздухом (табл.4). Начальная температура горючей смеси Т0 = 273 К.
Для расчета рекомендуется использовать метод последовательных приближений.
Дано:
Глицерин
C₃H₅(OH)₃ - глицерин;
ΔНхр = -675.4 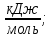
ΔН(CO₂) = -393.5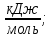
ΔН(H₂O) = -242 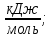
ɑ = 1. = 1.
Найти:
Та - ?
|
Решение:
4C₃H₅(OH)₃+6.5O₂+24.44N₂=7CO₂+6H₂O+24.44N₂
Определим состав продуктов горения:
V(CO₂) = 7 V(H₂O) = 6 V(H₂O) = 6 Vº(N₂) = 24.44 Vº(N₂) = 24.44 Δ Vᵦ = 0, т.к. ɑ = 1; Δ Vᵦ = 0, т.к. ɑ = 1;
Определим Qn:
Qn = (n*∑Hºобр.) – (m*∑ Hºисх.) = (7*(-393.5) + 4*(-242)) – 4*(-675.4) = -1000.9 
Так как, теплопотери отсутствует, то все выявленное тепло идет на прогревание пг:
Qср = 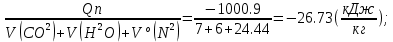
Уточним Та, при Т1 = 800:
Q1 = H(CO₂)* V(CO₂) + H(H₂O)* V(H₂O) + H(N₂)* Vº(N₂) = 38.2*7 + 29.9*6 + 24.6*24.44 = 1048.024 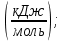
Q1 > Qn, берем Т2 меньше чем Т1, уточним Та, при Т2 = 700:
Q2 = H(CO₂)* V(CO₂) + H(H₂O)* V(H₂O) + H(N₂)* Vº(N₂) = 32.8*7 + 25.8*6 + 21.3*24.44 = 904.972 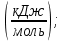
Q2 < Qn. Температура горения Та между 700 - 800ºС;
Определим Та:
Та = Т2 + 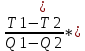 Qn - Qn - 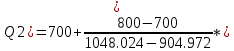 1000.9 - 1000.9 - 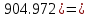 797 (К). 797 (К).
|
|
Задача №5
Условие: определить, какое количество вещества А (табл.5) может выгореть в закрытом помещении объемом Vп, если известно, что горение прекращается при содержании кислорода в помещении, равном 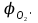 Для расчета коэффициента избытка воздуха рекомендуется воспользоваться формулой Для расчета коэффициента избытка воздуха рекомендуется воспользоваться формулой 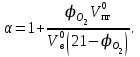
Дано:
C₆H₁₄ - гексан;
Vп = 250 м³;
φ(O₂) = 15%
Найти:
V(В) - ?
|
Решение:
C₆H₁₄ +9.5O₂+35.72N₂=6CO₂+7H₂O+35.72N₂
V(CO₂) = 6 V(H₂O) = 7 V(H₂O) = 7 Vº(N₂) = 35.72 Vº(N₂) = 35.72
Определим Vºпг:
Vºпг = V(CO₂) + V(H₂O) + Vº(N₂) = 6 + 7 + 35.72 = 48.72 
Определим Vºᵦ:
Vºᵦ = 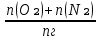 = = 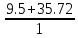 = 45.22 = 45.22  ; ;
Δ Vᵦ = Vᵦ - Vºᵦ = 14.43 - 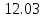 = 2.4 = 2.4
Определим ɑ:
ɑ = 1 + 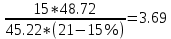
Определим Δ Vᵦ:
Δ Vᵦ = Vºᵦ *( ɑ - 1) = 45.228(3.69 – 1) = 121.64
V(N₂) = Vº(N₂) + 0.79* Δ Vᵦ = 35.72 + 0.79*121.64 = 131.81 ; ;
Так как ɑ > 1, появляется кислород:
V(O₂) = 0.21* Δ Vᵦ = 0.21*121.64 = 25.54 ; ;
Определим Vпг:
Vпг = V(CO₂) + V(H₂O) + Vº(N₂) + V(O₂) = 6 + 7 + 131.81 + 25.54 = 170.35 ; ;
7) Определим V(В):
V(В) = Vп – (Vпг + Δ Vᵦ) = 250 – (170.35 + 121.64) = 41.99  . .
|
Задача №6
Условие: определить, какое количество вещества В (табл. 6) может выгореть в закрытом помещении объемом Vп, если известно, что горение прекращается при содержании кислорода в помещении, равном 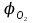 . Для расчета коэффициента избытка воздуха рекомендуется воспользоваться формулой . Для расчета коэффициента избытка воздуха рекомендуется воспользоваться формулой 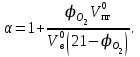
Дано:
Соляровое масло;
φ(C) = 86.5%;
φ(H) = 12.8%;
φ(O) = 0.3%;
φ(S) = 0.4%;
φ(N) = 0%;
φ(W) = 0%;
φ(O₂) = 12%;
Vп = 650 м³.
Найти:
V(В) - ?
|
Решение:
Определим Vºᵦ:
Vºᵦ = 0.269*(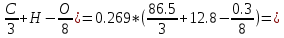 11.18 11.18 
Определим продукты горения:
V(CO₂) = 1.86*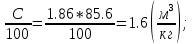
V(H₂O) = 11.2*
Vº(N₂) = 
Определим Vºп:
Vºпг = V(CO₂) + V(H₂O) + Vº(N₂) = 1.6 + 1.43 + 14.79 = 17.82 
Определим ɑ:
ɑ = 1 + 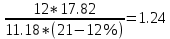
Определим Δ Vᵦ:
Δ Vᵦ = Vºᵦ *( ɑ - 1) = 11.18*(1.24 – 1) = 2.68 
V(N₂) = Vº(N₂) + 0.79* Δ Vᵦ = 14.79 + 0.79*2.68 = 16.907  ; ;
V(O₂) = 0.21* Δ Vᵦ = 0.56 ; ;
Определим Vпг:
Vпг = V(CO₂) + V(H₂O) + V(N₂) + V(O₂) = 20.59  ; ;
Определим V(В):
V(В) = Vп – (Vпг + Δ Vᵦ) = 650 – (20.59 + 11.18) = 618.26  . .
Определим φ:
φ(CO₂) = 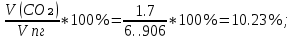
φ (H₂O) = 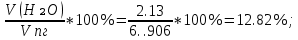
φ (N₂) = 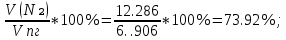
φ (О₂) = 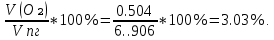
|
Задача №7
Условие: определить, какое минимальное количество горючей жидкости (табл.7) (кг) должно испариться в закрытом помещении объемом Vп при нормальных условиях, чтобы создалась взрывоопасная концентрация горючих паров. Условно принять, что пары горючего равномерно распределены в объеме помещения. Нижний концентрационный предел распространения пламени рассчитать по предельной теплоте сгорания.
Дано:
C₆H₆ - бензол ;
Vп = 500 м³;
Qn = 3141 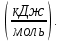
Найти:
НКПР - ?
|
Решение:
В соответствии с тепловой теорией наличие ПРП можно объяснить тем, что для распространения пламени у горячей паровоздушной среде необходимо выделение определенного количества тепла.
Экспериментально установлено, что количество тепла выделяющееся при горении смеси содержанием горючего отвечающего КПРП для большинства веществ является величиной постоянной и обозначается Qпр = 1830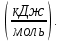
Эту величину называют предельной теплотой сгорания, если известно Qn, то можно расчистить долю горючего смеси по следующей формуле: φn = 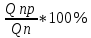 . .
Где 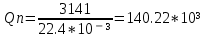
φn = 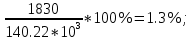
Массу воздуха в помещении при н.у. найдем из формулы М.Каперона:
pV = 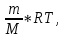 следовательно, m = следовательно, m = 
Определим m(min) = m*φ = 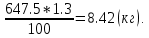
|
Задача №8
Условие: рассчитать минимальную флегматизирующую концентрацию инертного разбавителя, об. %, исходя из минимальной адиабатической температуры горения паровоздушной смеси вещества А при разбавлении ее флегматизатором Ф (табл.8), а также минимальное взрывоопасное содержание кислорода и безопасную концентрацию кислорода.
Дано:
C₆H₁₄ - гексан ;
Ф - 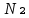
Qn = 3864 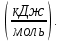
Найти:
φф - ?
φгф - ?
φ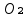 ф - ? ф - ?
φ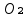 без - ? без - ?
|
Решение:
Определим минимальную флегматизирующую концентрацию при условии минимальной адиабатической теплотой горения:
Тг = 1500 (К);
Vф = 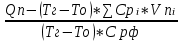
C₆H₁₄+9.5O₂+35.72N₂=6CO₂+7H₂O+35.72N₂
V(CO₂) = 6 V(H₂O) = 7 V(H₂O) = 7 Vº(N₂) = 35.72 Vº(N₂) = 35.72
Ср(N₂) = 3.18*10⁻²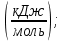
Ср(CO₂) = 5.08*10⁻²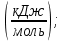
Ср(H₂O) = 3.99*10⁻²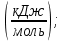
Vф = 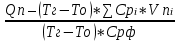 = = 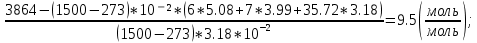
Определим минимальную флегматизирующую концентрацию H₂O:
φф = 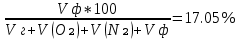 ; ;
Определим концентрацию горючего в точке флегматизациий:
φгф = 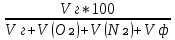 = 1.79%; = 1.79%;
Определим минимальную взрывное соединение 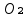 : :
φ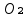 ф = ф = 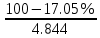 = 187.12%; = 187.12%;
Определим безопасное соединение 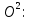
φ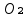 без = 1.2* φ без = 1.2* φ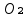 ф – 4.2 = 1.2*17.12 - 4.2 = 16.344%. ф – 4.2 = 1.2*17.12 - 4.2 = 16.344%.
|
Задача №9
Условие: рассчитать температурные пределы воспламенения вещества А (табл.9 ) по его концентрационным пределам распространения пламени, значения которых вычислить по аппроксимационной формуле.
Дано:
C₂H₅OC₂H₅ - диэтиловый эфир.
Найти:
Тн - ?
Тв - ?
|
Решение:
C₂H₅OC₂H₅+6O₂+22.56N₂=4CO₂+5H₂O+22.56N₂
φнв = 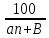 ; ;
φв = 
φн = 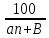 = = 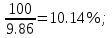
Используя формулу Антуана, получаем Тн:
Тн = 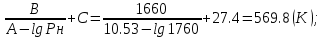
Получим Рв:
Рв = 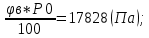
Получим Тв:
Тв =  = = 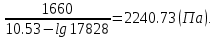
|
Задача №10
Условие: вычислить температуру вспышки или температуру воспламенения горючей жидкости по формуле В.И. Блинова. Коэффициент диффузии паров жидкости Д0 приведен в табл. 10. Сравнить найденное значение с экспериментальным, взятым из справочника.
Дано:
СН3СОСН3 – ацетон ;
Д0 = 8.610-6, (м2/с);
Температура воспламенения
Найти:
Твсп - ?
|
Решение:
Для решения задачи по формуле Блинова, необходимо иметь значение коэффициента  – это коэффициент перед – это коэффициент перед 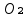 в материальном балансе: в материальном балансе:
СН3СОСН3+4O₂+15.04N₂=3CO₂+3H₂O+15.04N₂
Следовательно 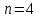 ; ;
Вычислим произведение:
Рнп*Твсп = 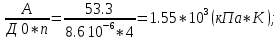
Найдем температуру, при которой произведение РТ будет равно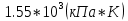 . Тогда найденное значение То будет соответствовать Твсп. . Тогда найденное значение То будет соответствовать Твсп.
Воспользуемся для этого зависимостью давления насыщенного пара от температуры жидкости.
Для ацетона: Т1 = 263.6 (К); Р1 = 5.332 (кПа)
Т1*Р1 = 1352(кПа*К) 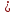 Рнп*Твсп Рнп*Твсп
Т2 = 271 (К); Р2 = 7.999 (кПа)
Т2*Р2 = 2167(кПа*К)  Рнп*Твсп Рнп*Твсп
Это означает, что Твсп имеет значение:
Твсп = Т1 + 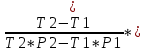 Рнп*Твсп Рнп*Твсп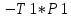 ) = 265.38 (К). ) = 265.38 (К).
|
Задача №11
Условие: рассчитать стандартную температуру самовоспламенения вещества А (табл.13) по средней длине углеродной цепи, определив число концевых групп и число цепей.
Дано:
Изобутилбензол
Найти:
Тсв - ?
|
Р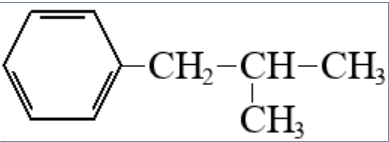 ешение: ешение:
1)
Мр(число концевых групп) = 2
m = 
2) Найдем цепи и установим их длину:
Углеродная цепь mᵢ
|
1-3
|
1-4
|
3-4
|
Длина цепи lᵢ
|
3
|
4
|
2
|
3)Определим среднее арифметическое значение длины углеродных цепей:
Lср = 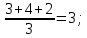
Исходя из таблицы Тсв = 743 (К).
|
Задача №12
Условие: в результате неисправности вентиля из баллона с пропан-бутановой смесью (табл. 12) произошла утечка газа в помещении размерами АхВхС. При этом масса баллона изменилась на m. Определить, возникнет ли опасность взрыва. Помещение считать герметичным, а распределение газа по объему равномерным. Для определения концентрационного предела распространения пламени для смеси газов воспользоваться формулой Ле-Шателье.
Дано:
φ(С₃Н₈) = 55%;
φ(С₄Н₁₀) = 45%;
Δm = 3.5 кг;
А*В*С = 6*5*3
Найти:
НКПРП - ?
ВКПРП - ?
|
Решение:
По формуле Ле-Шателье определим
ПРП: φв(н) = 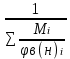
φᵢ(н)в – это значение НКПРП и ВКПРП ᵢ-го вещества.
Находим по таблице:
φн(С₃Н₈) = 2.37%; φн(С₄Н₁₀) = 1.86%
φв(С₃Н₈) = 9.5%; φв(С₄Н₁₀) = 8.41%
φн.смеси = 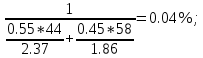
φв.смеси = 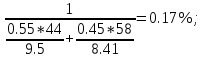
Вычисляем молекулярную массу смеси:
Мсмеси = φ(С₃Н₈)*М(С₃Н₈) + φ(С₄Н₁₀)*М(С₄Н₁₀) = 0.55*44 + 0.45*58 = 50.3 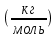
Найдем плотность смеси:
ρ смеси = 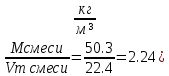 ); );
Вычислим объем смеси:
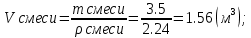
Вычислим %-ое содержание газовой смеси в объеме данного помещения:
φсмеси = 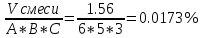
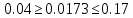 отсюда ρ смеси < φн, значит смесь пожаровзрывобезопасный. отсюда ρ смеси < φн, значит смесь пожаровзрывобезопасный.
|
Задача №13
Условие: построить зависимость концентрационных пределов распространения пламени для вещества А в воздухе от содержания в горючей смеси инертного разбавителя (флегматизатора Ф табл.13). Значение нижнего и верхнего концентрационных пределов рассчитать по аппроксимационной формуле, а значение минимальной флегматизирующей концентрации, исходя из минимальной адиабатической температуры горения стехиометрической смеси.
Дано:
С₇Н₁₆ – гептан ;
Qn = 4491  ; ;
Ф = H₂O
Найти:
НКПРП - ?
ВКПРП - ?
|
Решение:
Определим минимальную флегматизирующею концентрацию при минимальной адиабатической температуре горения:
С₇Н₁₆ +11O₂+41.36N₂=7CO₂+8H₂O+41.36N₂
V(CO₂) = 7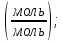 V(H₂O) = 8 V(H₂O) = 8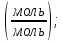 V(N₂) = 41.36 V(N₂) = 41.36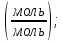 V(O₂) = 11 V(O₂) = 11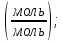
Ср(N₂) = 3.18*10⁻²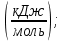
Ср(CO₂) = 5.08*10⁻²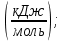
Ср(H₂O) = 3.99*10⁻²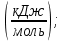
Vф = 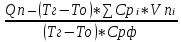 = = 
Определим минимальную флегматизирующую концентрацию H₂O:
φф = 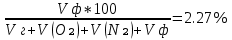 ; ;
Определим концентрацию горючего в точке флегматизациий:
φгф = 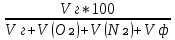 = 1.05%; = 1.05%;
Определим минимальную взрывное соединение  : :
φ ф = ф = 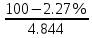 = 20.17%; = 20.17%;
Определим безопасное соединение 
φ без = 1.2* φ без = 1.2* φ ф – 4.2 = 1.2*20.17 - 4.2 = 20.004%; ф – 4.2 = 1.2*20.17 - 4.2 = 20.004%;
Найдем НКПР и ВКПР:
НКПР =  ; ;
ВКПР = 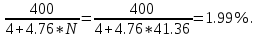

| |
|
|
 Скачать 134.27 Kb.
Скачать 134.27 Kb. Для расчета коэффициента избытка воздуха рекомендуется воспользоваться формулой
Для расчета коэффициента избытка воздуха рекомендуется воспользоваться формулой 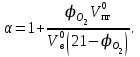
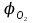 . Для расчета коэффициента избытка воздуха рекомендуется воспользоваться формулой
. Для расчета коэффициента избытка воздуха рекомендуется воспользоваться формулой 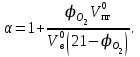

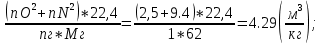
 ;
;
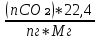 =
=  = 0.72
= 0.72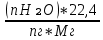 =
= 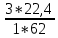 = 1.08
= 1.08 =
= 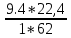 = 3.39
= 3.39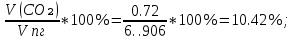
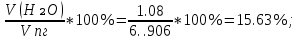
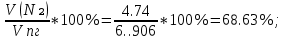

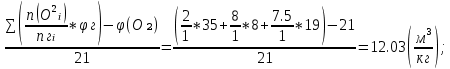
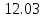 = 2.4
= 2.4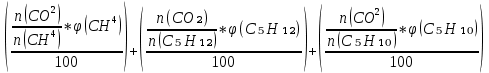 =
=  ;
; =
= 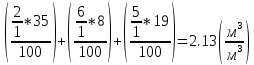 ;
;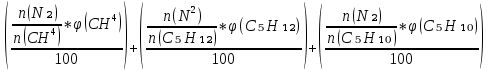 =
=  ;
; ;
;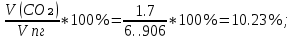
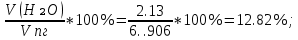
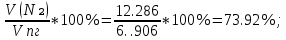
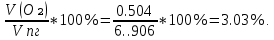
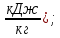
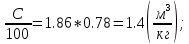
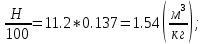
 *
*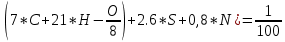 *
*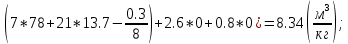

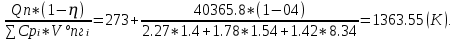
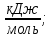
 = 1.
= 1. 
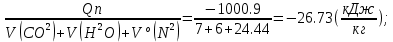
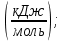
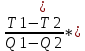 Qn -
Qn - 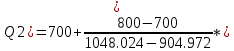 1000.9 -
1000.9 - 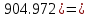 797 (К).
797 (К).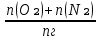 =
= 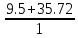 = 45.22
= 45.22 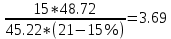
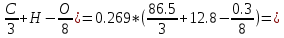 11.18
11.18 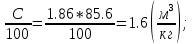


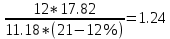
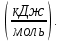
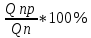 .
.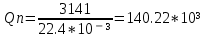
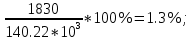
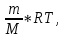 следовательно, m =
следовательно, m = 
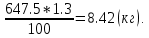
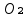 ф - ?
ф - ?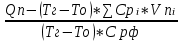
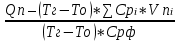 =
= 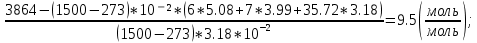
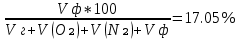 ;
;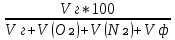 = 1.79%;
= 1.79%;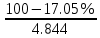 = 187.12%;
= 187.12%;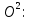
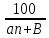 ;
;
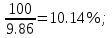
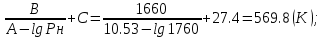
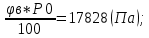
 =
= 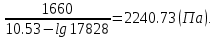
 – это коэффициент перед
– это коэффициент перед 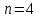 ;
;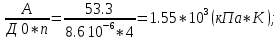
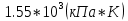 . Тогда найденное значение То будет соответствовать Твсп.
. Тогда найденное значение То будет соответствовать Твсп.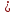 Рнп*Твсп
Рнп*Твсп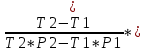 Рнп*Твсп
Рнп*Твсп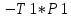 ) = 265.38 (К).
) = 265.38 (К). ешение:
ешение:
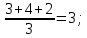
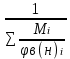
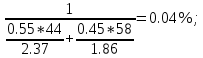
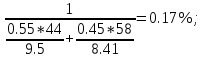
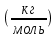
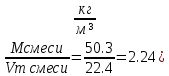 );
);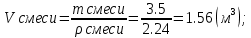
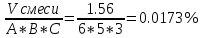
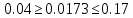 отсюда ρ смеси < φн, значит смесь пожаровзрывобезопасный.
отсюда ρ смеси < φн, значит смесь пожаровзрывобезопасный.  ;
;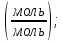 V(H₂O) = 8
V(H₂O) = 8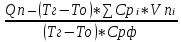 =
= 
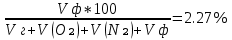 ;
;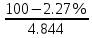 = 20.17%;
= 20.17%; ;
;