Контрольные вопросы 1111. Контрольные вопросы Что такое раствор
 Скачать 81.25 Kb. Скачать 81.25 Kb.
|
|
Контрольные вопросы Что такое раствор? Какие существуют способы выражения концентрации рас- твора? Что называется растворенным веществом? Какой компонент раствора принимается за растворитель? По какому уравнению осуществляется перерасчет от нор-мальной концентрации к молярной? Что называется титрованием? Какое состояние химической системы называется «точка эквивалентности»? Что является задачей титрования? Как экспериментально определить точку эквивалентности при титровании кислоты щелочью? По какому уравнению рассчитывается концентрация ана-лизируемого вещества при титровании? Раствор –гомогенная система,содержащая не менее двухсоставных частей. Составная часть (составляющее вещество) –часть систе-мы, которая может существовать вне системы Растворитель –составная часть раствора,которой больше,чем остальных, и агрегатное состояние которой совпадает с агрегат-ным состоянием раствора. Растворенные вещества – все составные части раствора за исключением растворителя. Для количественного описания свойств растворов в качестве основного параметра используют концентрацию. Известны различные способы выражения концентрации рас- творов. Массовая доля i-го компонента–отношение массыi-го ком-понента mi к общей массе системы =mi ∑mi  i или массовое содержание i-го компонента, выраженное в процентах (массовые проценты, масс.%) ω%,i = ∑mmii 100 = ωi100 .  i Молярная доля i-го компонента–отношение количествавещества i-го компонента ni к общему количеству вещества системы 41
или молярное содержание i-го компонента, выраженное в процен-тах (молярные проценты, мол.%) %,i = ∑nini 100 = Χi100 .  i Молярная концентрация i-го компонента–количество рас-творенного вещества i-го компонента в 1 л раствора
Моляльная концентрация i-го компонента–количествовещества i-го компонента, растворенного в 1 кг растворителя
Массовая концентрация i-го компонента–масса в граммахрастворенного вещества i-го компонента в 1 л раствора
Молярная концентрация эквивалента i-го компонента(нормальная концентрация) – количество вещества эквивалентов i-го компонента в 1 л раствора  cNi=VnЭi,моль/л. р-ра Нормальная концентрация cN связана с молярной концен-трацией c соотношением 42 c N= zc , где z – эквивалентное число. Для элемента z соответствует степени его окисления в про-дукте реакции. Для кислоты z соответствует основности кислоты. Для основания z соответствует кислотности основания. Для соли z рассчитывают как произведение числа атомов и степени окисления металла в составе соли. Для окислителей и восстановителей в окислительно-восста-новительных реакциях z – изменение их степени окисления в ходе реакции. Растворы часто готовят путем разведения более концентри-рованного раствора до необходимой величины концентрации. Кон-центрацию приготовленного раствора уточняют количественным химическим анализом, например титрованием. Титрование – прием количественного анализа, при котором к раствору определяемого вещества по каплям приливают раствор реагента точно заданной концентрации. Состояние системы, в котором аналитическая реак-ция прошла полностью в соответствии со стехиометрическим урав-нением при отсутствии избытка реагента, называют точкой эквива-лентности. Задача титрования – определить эквивалентный объем добавляемого реагента – титранта, необходимый для установле-ния точки эквивалентности, так как в ней числа эквивалентов опре-деляемого вещества и титранта равны между собой. Из определения нормальной концентрации следует, что количество вещества экви-валентов в растворе равно произведению нормальной концентрации на объем раствора. Следовательно: cNXVa=cNTVT. Отобрав для титрования мерной пипеткой точный объем пробы – аликвоту Va , зная нормальную концентрацию титранта cNTи определив объем титранта,ушедший на титрование VT,мож-но вычислить концентрацию пробы cN X . 43 До эквивалентной точки в ходе титрования в растворе при-сутствует избыток определяемого вещества, а после – избыток тит-ранта. Поэтому в эквивалентной точке свойства раствора резко из-меняются, в частности, изменяется окраска специально подобранных цветных индикаторов, что позволяет определить объем титранта, ушедший на титрование 1. What is a solution? A solution is a homogeneous mixture of two or more substances. A solution may exist in any phase. ... The amount of solute that can be dissolved in solvent is called its solubility. For example, in a saline solution, salt is the solute dissolved in water as the solvent. 2. What are the ways to Express the concentration of solutions?  The Concentration of a Solution is defined as the relative amount of solute present in a solution. It basically talks about how to find the amount of solute present in solvent which together forms solution.There are various methods used to find this, 3. What is called a dissolved substance? The dissolved substance of a solution is called the solute. The substance it is dissolved in is called the solvent. Dissolved substance is a solid, liquid or gas matter dissolved in a solvent. 4. What component of the solution is taken as a solvent? Solvent: The component of a solution which dissolves the other component in itself is called solvent. A solvent constitutes the larger component of the solution. For example, a solution of sugar in water is solid in the liquid. Here, sugar is the solute and water is the solvent. Solute: The component of the solution which dissolves in the solvent is called solute. The solute is the smaller component of the solution. For example, a solution of iodine in alcohol known as ‘tincture of iodine’, iodine is the solute. Similarly, in carbonated drinks (Soda water), carbon dioxide gas is the solute. Solute and solvent are the two components of a solution. A solvent is a substance that dissolves the solute. And the solute is the substance being dissolved. To identify them, take note that if the subtance present in a solution undergoes change of state, it is the solute. 5. What equation is used to recalculate from normal to molar concentration? 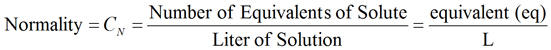 6. What is called titration? A titration is a technique where a solution of known concentration is used to determine the concentration of an unknown solution. Typically, the titrant (the know solution) is added from a buret to a known quantity of the analyte (the unknown solution) until the reaction is complete. 7. What state of the chemical system is called the "equivalence point"? The equivalence point or stoichiometric point is the point in a chemical reaction when there is exactly enough acid and base to neutralize the solution 8. What is the titration task? Титриметрический анализ (титрование) — метод количественного/массового анализа, который часто используется в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом. Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать начиная от других отметок не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (не следует путать с точкой эквивалентности) определяют с помощью индикаторов или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода и т. д.). По количеству затраченного на титрование рабочего раствора рассчитывают результаты анализа. 9. How to experimentally determine the equivalence point when titrating an acid with an alkali? 10. What equation is used to calculate the concentration of the analyzed substance during titration? | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
