Аналитика. Аналитическая химия. Контрольные задания Вариант 23 1
 Скачать 75.23 Kb. Скачать 75.23 Kb.
|
|
Контрольные задания Вариант № 23 1. Предложите рациональную схему анализа и приведите уравнения реакций, лежащих в основе разделения и обнаружения анионов при совместном присутствии J-,NO2-, CH3COO-. Классификация анионов, основанная на реакциях осаждения
Реакции обнаружения иодид-иона, I– Нитрат серебра образует с ионами I– желтый осадок AgI, нерастворимый в НNO3, NH3, (NH4)2СО3, но хорошо растворимый в Na2S2O3 и KCN. Предел обнаружения 1 мкг. I– + Ag+ → AgI↓ Выполнение реакции. К 2 – 3 каплям раствора, содержащего ионы I–, добавляют 2 – 3 капли раствора AgNO3. Образуется желтый осадок. Реакции обнаружения нитрит-иона, NO2– Реакция с солями аммония – реакция удаления NO2–. Ион NO2– при нагревании окисляет катионы аммония NH4+ до свободного азота N2: NO2– + NН4+ → N2↑ + 2Н2О. Аналогично нитрит-ионы разрушаются до N2 и при реакции с карбамидом: 2NO2– + 2Н+ + СО(NН2)2 → 2N2↑ + СО2↑ + 3Н2О Эти реакции используют для удаления NO2– из раствора, в частности, для устранения его мешающего влияния при обнаружении NO3–. Выполнение реакции. В пробирку вносят 5 капель раствора, содержащего ионы NO2–, кристаллы NН4Cl или (NН4)2SO4 до получения насыщенного раствора и осторожно нагревают смесь. Наблюдается выделение пузырьков газа – азота. Полноту удаления проверяют в капле, взятой из пробирки, используя реакцию с КI в присутствии крахмала. Обнаружение СН3СОО– и NO2– выполняют после отделения анионов I и II групп нитратом серебра в нейтральной среде. 2. Раскройте основные положения теории растворов электролитов, используемых в аналитической химии, а также понятия о сильных и слабых электролитах, константе и степени электролитической диссоциации. Их математические выражения. Покажите влияние на степень диссоциации слабых электролитов добавления электролита с одноименным ионом. Напишите формулы известных Вам сильных кислот и оснований, слабых кислот и оснований, применяемых в качестве реагентов. Электролитическая диссоциация — это процесс, в ходе которого молекулы электролитов взаимодействуют с водой или другим растворителем и распадаются на ионы. Она может иметь обратимый или необратимый характер. Обратный процесс называется моляризацией. Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2. Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2О). Константа диссоциации (ионизации) Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид: Применяя закон действующих масс, запишем выражение константы равновесия: где [Аm+], [Bn— ] — равновесные концентрации ионов Аm+ и Bn—, [АnВm] — равновесная концентрация недиссоциированных молекул АnВm. Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации. 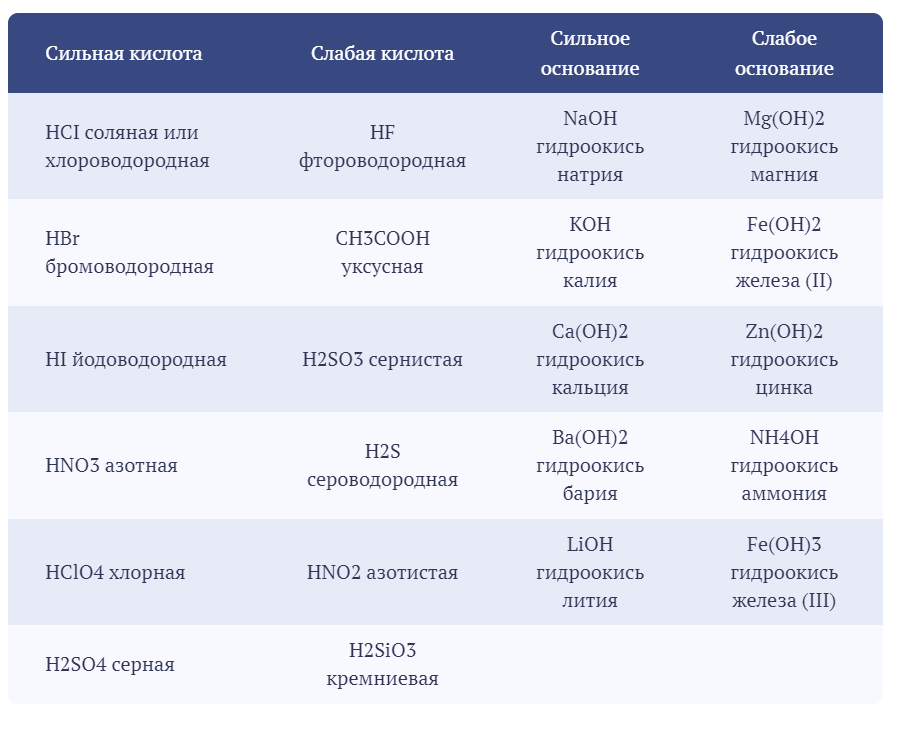 3. Закончите и уравняйте ионно–электронным методом или методом электронного баланса уравнения окислительно-восстановительных реакций: KJ + KMnO4 + H2SO4 = KCrO4 + H2O2 + KOH = Na2S2O3 + J2 = 10 KJ + 2 KMnO4 + 8 H2SO4 → 5 J2 + 2 MnSO4 + 6 K2SO4 + 8 H2O 2 Mn7+ + 10 e- → 2 Mn2+ (восстановление) 10 J- - 10 e- → 10J0 (окисление) KMnO4 является окислителем, KJ является восстановителем. 2KCrO2 + 3H2O2 + 2KOH → 2K2CrO4 + 4H2O 2 Cr3+ - 6 e- → 2 Cr6+ (окисление) 6 O- + 6 e- → 6 O2- (восстановление) KCrO2 является восстановителем, H2O2 является окислителем. 2 Na2S2O3 + I2 → Na2S4O6 + 2 NaI 4 S2-2 e- → 4 S+5/2 (окисление) 2 I0 + 2 e- → 2 I- (восстановление) Na2S2O3 является восстановителем, I2 является окислителем. 4. Дайте определение рН-индикаторам, укажите требования к ним, их характеристики: интервал перехода окраски. Обоснуйте принцип выбора индикатора. Окраска органического соединения определяется его молекулярным строением, и соответственно изменение окраски происходит в результате внутримолекулярной перегруппировки, изменяющей строение молекулы индикатора. Окраска органических соединений обусловлена присутствием в молекуле особых функциональных групп – хромофоров. К ним относятся цепочка сопряженных одинарных и двойных углерод - углеродных связей, в которую могут быть включены хиноидная и другие группы (>C=O, -N=O, -N=N-, >C=N-), содержащие гетероатомные двойные связи. Наличие цепочки сопряженных двойных связей приводит к тому, что молекула взаимодействует с электромагнитным излучением, избирательно поглощая волну, соответствующую видимой области спектра. На окраску органических соединений влияет также присутствие другого рода групп, называемых ауксохромами. В отличие от хромофоров, ауксохромы сами по себе не способны сообщать окраску соединению, но, присутствуя совместно с хромофорами, и участвуя как донорные группы в сопряжении двойных связей, они усиливают их действие, углубляя окраску, вызванную хромофорами. Важнейшими ауксохромами являются группы -ОН и -NH2, а также их производные, содержащие различные радикалы, например группы -ОСН3, -N(СН3)2, -N(С2Н5)2 и т. д. Например, фенолфталеинотносится к кислотным индикаторам. Одно из трех бензольных ядер, входящих в молекулу фенолфталеина, претерпевает хиноидную перегруппировку, и в растворе устанавливается равновесие:  При введении в раствор ионов ОН– равновесие сдвигается вправо. Следствием этого является изменение окраски фенолфталеина. Метиловый оранжевый относится к основным индикаторам. При диссоциации молекулы метилового оранжевого образуют амфотерные ионы («амфионы»), несущие одновременно как положительные, так и отрицательные заряды. Эти ионы накапливаются при подкислении раствора и придают ему красную окраску. При подщелачивании раствора происходит взаимодействие указанных амфотерных ионов с ионами ОН–, сопровождающееся изменением строения индикатора и переходом его окраски из красной в желтую: 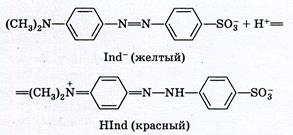 Таким образом, с изменением рН раствора форма существования индикатора в растворе изменяется. Условно можно записать следующее уравнение диссоциации для рН - индикатора: HInd молекулярная ионная кислотная форма щелочная форма С добавлением щелочи положение равновесия диссоциации индикатора смещается вправо, в щелочной среде индикатор существует преимущественно в ионной щелочной форме. При добавлении кислоты равновесие диссоциации индикатора смещается влево, в кислой среде индикатор существует преимущественно в молекулярной кислотной форме. Кислотная и щелочная формы индикатора имеют разные окраски. Например, лакмус содержит индикаторную кислоту, молекулы HInd которой красного цвета, а анионы – Ind–синего.Изменение окраски рН - индикаторов происходит при введении в раствор ионов Н+ или ОН–. Следовательно, окраска индикаторов зависит от величины рН. Связь между окраской рН-индикатора и величиной рН раствора можно вывести из константы диссоциации рН - индикатора. 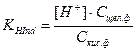 , , где Сщел ф = [Ind–] – молярная концентрация щелочной формы; Скисл ф = [HInd] – молярная концентрация кислотной формы рН – индикатора. Решая уравнение относительно [H+] и логарифмируя, получим: где рKHInd = –lgKHInd - показатель константы диссоциации индикатора. Глаз имеет ограниченную способность к восприятию окрасок и перестает замечать присутствие одной из окрашенных форм индикатора наряду с другой его формой, если концентрация ее в 10 раз меньше концентрации последней. Если Cкисл.ф/Cщел.ф ≥ 10, наблюдается окраска только кислотной формы. И наоборот, если Cкисл..ф/Cщел..ф ≤ 10-1, наблюдается окраска только щелочной формы. Если 10-1≤ Cкисл.ф/Cщел.ф ≤ 10, в растворе присутствуют две формы в сравнимых количествах и раствор приобретает смешанную окраску. Окраска любого индикатора изменяется не при всяком изменении рН, а лишь внутри определенного интервала значений рН, называемого областью перехода окраски индикатора, которая может быть выражена формулой ∆рН=рKHInd ± 1. Титрование с индикатором завершают при определенной окраске. То значение рН, при котором заканчивается титрование с данным индикатором, называется показателем титрования индикатора:рТ ≈ рНконца титр. Если величина рТ не дана, можно принять, что она лежит в середине области перехода, то есть приблизительно равна показателю константы диссоциации индикатора рКHInd.
Интервал перехода окраски индикатора зависит только от свойств данного индикатора и не зависит от природы реагирующих между собой кислоты и основания. Изменение окраски индикатора происходит не строго в точке эквивалентности, а с отклонением от нее. Такое отклонение влечет за собой ошибку, называемую индикаторной ошибкой титрования. При правильном выборе индикатора ошибка не выходит за обычные пределы аналитических погрешностей (≈0,1%). рН - Индикаторы должны удовлетворять следующим требованиям: 1) окраска индикатора должна быть интенсивной; 2) окраски двух форм резко различаются; 3) изменение окраски должно быть обратимым и быстрым; 4) изменение окраски происходит в узком интервале рН; 5) индикатор должен быть устойчивым в растворе и на воздухе. 5. Рассчитайте содержание цинка в растворе, если на титрование пошло 10,8 мл 0,1 н трилона Б? С (1/2TrB)*V(TrB) = C(1/2ZnSO4)*V(ZnSO4) С (1/2TrB) = 0,11*24,45/25=0,1076 mol/l - молярная конц. эквивалента (нормальность) T=C(1/2TrB)*M(1/2TrB)/1000 - титр, г/мл M(1/2TrB)=M/2 - молярная масса эквивалента | |||||||||||||||||||||||||||||||||||||||||||||||||||||
